
1.碳族元素的化合价
碳族元素常见化合价为+2和+4,其中碳、硅、锗、锡的 价化合物较稳定,而铅的 价化合物稳定。由氧化还原反应的化合价升降来研究碳族元素的物质,其性质规律如下:
(1)碳族元素的单质以 为主,如碳、硅都被氧气氧化。碳作还原剂,温度越高,还原性 ,高温时碳可还原氧化铜。锡、铅都能与盐酸反应置换出氢气等。
(2) 价化合物有还原性。如CO高温时能还原某些金属氧化物(Fe2O3、CuO等)。
(3) 价化合物有氧化性。如CO2和碳高温下反应生成CO,PbO2在化学反应中是强氧化剂等。
9.(07上海18)用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断
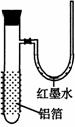 下列说法错误的是
下列说法错误的是
A 实验中发生的反应都是氧化还原反应
B 铝是一种较活泼的金属,
C 铝与氧气反应放出大量的热量
D 铝片上生成的白毛是氧化铝和氧化汞的混合物
8.由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):

⑴取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式) 。
⑵Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是 。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是 。
⑶向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号) 。
⑷取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I―时,共转移3 mol电子,该反应的离子方程式是 。
⑸另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示) 。
7. 等物质的量的Na、Mg、Al分别与1L 1mol/L的盐酸反应,产生的气体体积在相同状况下分别为VNa、VMg、VAl。设金属的物质的量为X,当X取不同数值时,填写表中(1)(2)处产生的氢气的体积关系,及表中(3)(4)处X的取值范围
|
Na、Mg、Al等物质的量Xmol |
X<1/2 |
1/2≤X<1 |
(3) |
(4) |
|
H2的体积 |
(1) |
(2) |
VNa>VMg=VAl |
VNa=VMg=VAl |
6.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)气体,所得溶液中加KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的混合物能得到铁
A.11.2g B.2.8g C.5.6g D.无法计算
5.取Xg铜和镁的合金完全溶于浓硝酸,若反应中硝酸被还原只产生8960mL的NO2气体和672mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为17.02g,则X等于
A、8.64g B、9.20g C、9.00g D、9.44g
4.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体不是纯净物的是
A.向Fe、FeO和Fe2O3的混合物中加入过量的盐酸
B.等物质的量浓度、等体积的(NH4)2SO4与 BaC12溶液
C.等物质的量的 NaHCO3与 Na2O2固体
D.在NaBr溶液中通入过量氯气
3.不能由化合反应而直接得到的化合物是
A.FeCl2 B.Al2S3 C.Fe(OH)3 D.H2SiO3
2.常温下取金属钠、铝、铁各n克,加入1mol/L的硫酸V毫升,要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,V和n的数值关系是
A.V≤ B.V≤ C.V< D.V≥
1.将过量CO2分别通入:①CaCl2溶液 ②Na2SiO3溶液 ③Ca(OH)2溶液 ④饱和Na2CO3溶液 ⑤NaAlO2 ⑥C6H5ONa最终溶液变浑浊的是
A.①②⑤⑥ B.②④⑤⑥ C.①②③⑤ D.②③④⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com