
5.SiO2是H2SiO3的酸酐,但它不溶于水,不能直接将它与水作用制备H2SiO3。
4.非金属单质一般为非导体,但Si为 。
3.非金属单质一般不跟非氧化性酸作用,但Si能与HF作用:Si+4HF=
2.非金属单质跟碱液作用一般无H2放出,但Si却放出H2:Si+2Na2OH+H2O=
1.Si的还原性大于C,但C却能在高温下还原出Si:2C+SiO2
4.CO32-和HCO3-的检验
(1)CO32-的检验方法:向待检溶液中滴加过量的 溶液,生成 ,再加入
,白色沉淀又溶解,且生成无色、无味的气体,则检得溶液中有CO32-。
(2)HCO3-的检验方法:向待检溶液中滴加足量的 的可溶性盐溶液,若无明显现象,再向溶液中加入足量的 (如 等)溶液,溶液中逸出无色、无味的气体,则待检溶液中有HCO3-。
|
[特别提醒]:①检验CO32-:试剂CaCl2溶液也可用Ca(NO3)2、BaCl2、Ba(NO3)2等的溶液代替,但不可用Ca(OH)2溶液或Ba(OH)2溶液,原因是无法排除HCO3-的干扰。②检验HCO3-:Ca2+或Ba2+的溶液不可用Ca(OH)2溶液或Ba(OH)2溶液,原因是OH-将HCO3-转化为CO32-;加酸后要通过气体的气味排除HSO3-的干扰。 |
 [例2](2007年上海理综)(1)钟乳石和石笋的主要成分是碳酸钙,其形成过程如右图所示。随着旅游人数的增加,潮湿溶洞中的钟乳石和石笋受到二氧化碳侵蚀,其化学方程式为:__________________________________。
[例2](2007年上海理综)(1)钟乳石和石笋的主要成分是碳酸钙,其形成过程如右图所示。随着旅游人数的增加,潮湿溶洞中的钟乳石和石笋受到二氧化碳侵蚀,其化学方程式为:__________________________________。
(2)某学生提出一个修复溶洞底部受损石笋的研究方案,由以下五步组成,正确的实验步骤依次是__________。
①将盛有碱溶液的容器置于石笋的上部 ②配制一定浓度的碱溶液 ③选择合适的碱 ④调节碱溶液下滴的速度 ⑤观察石笋表面复原情况
[解析]从图可见,石笋受损是由于地表水中溶有CO2,CO2可溶解石笋,生成Ca(HCO3)2,而Ca(HCO3)2在受热的情况下会分解生成CaCO3,形成钟乳石和石笋。修复溶洞底部受损的石笋应用能与Ca(HCO3)2反应的碱。故实验的第一步是选择合适的碱,再配制一定浓度的碱溶液后进行修复操作①④⑤。
[答案](1)CaCO3+CO2
+ H2O Ca(HCO3)2 (2)③②①④⑤
Ca(HCO3)2 (2)③②①④⑤
[误区警示]认为应先观察石笋表面复原情况,根据石笋表面复原情况调节碱溶液下滴的速度,易将④和⑤搞反。
考点3 硅及其化合物的特性
3.酸式盐与碱反应时的产物要根据相对用量判断。如在Ca(HCO3)2溶液中滴加NaOH溶液:Ca(HCO3)2+NaOH (NaOH少量)
(NaOH少量)
Ca(HCO3)2+2NaOH (NaOH过量)
(NaOH过量)
2.稳定性:难溶性的碳酸盐、(NH4)2CO3及酸式盐受热 ;可溶性的碳酸盐较稳定,受热 ;一般来说:稳定性大小顺序为正盐 酸式盐。
1.溶解性规律:碱金属的正盐溶解度 酸式盐(如:Na2CO3 NaHCO3);碱土金属(第ⅡA族)的正盐溶解度 酸式盐(如:CaCO3 Ca(HCO3)2)。
2.除去CO、CO2气体中混有的杂质(括号内为杂质)
(1)CO(CO2) :通过盛有的 洗气瓶。
(2)CO2(CO):通过盛放 的硬质玻璃官。
(3)CO2(O2):通过盛放 的硬质玻璃管。
(4)CO2(SO2):通过 或 。
(5)CO2(HCl):通过 。
(6)CO2(H2S):通过 。
[例1](2007年山东)下图所示为常见气体制备、分离、干爆和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。


(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 。需要加热的仪器装置有 (填代号),m中反应的化学方程式为 。
(3)若气体入口改通空气,分液漏斗内改改加浓氨水,圆地烧瓶内改加 NaOH 固体,E内装有铂铹合金网,按A→G→E→D装置程序制取干燥氧气,并验证氨的某些性质。
①装置A中能产生氨气的原因有: 。
②实验中观察到E内有红棕色气体现出,证明氨气具有 性。
[解析](1)根据实验要求,A装置中通入的气体为CO和CO2的混合气,在A中,CO2 被氢氧化钠吸收,若要获得纯净干燥的CO,需要选取装置C,证明CO2 被除尽,然后通过盛有浓硫酸的B除去水蒸气,要验证CO的还原性,需要装有CuO的装置E,验证CO的氧化产物CO2 ,还需要装置C,最后需要F除去为反应的CO。所选装置的连接顺序是ACBECF,能验证CO的氧化产物的实验现象是:AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊。
(2)停止通入CO和CO2 的混合气体,需要关闭活塞a,然后打开活塞b,此时稀硫酸与碳酸钠溶液(CO2 与NaOH反应生成的)反应,反应生成的CO2气体进入E中,并与 与Na2O2反应产生氧气,氧气通过D除去可能存在的CO2,通过B除去水蒸气,得到纯净干燥的氧气,氧气氧化乙醇的条件是需要加热且有铜做催化剂,因此需要加热k使乙醇挥发,并且加热m,使氧气与乙醇蒸气反应,反应的化学方程式是:2CH3CH2OH+O2
2CH3CHO+2H2O。
(3)氢氧化钠固体易吸水并且在溶于水时放出大量的热,氢氧化钠溶于水后溶液中的OH-的浓度增大,这些因素均能浓氨水中的化学平衡:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-向逆反应方向移动,使浓氨水中的氨气放出。根据常识可以判断出在E中出现的红棕色气体应该是NO2,由氨气和NO2中氮元素的化合价可以判断氨气被氧化生成NO2 氨气体现出的是还原性。
NH4++OH-向逆反应方向移动,使浓氨水中的氨气放出。根据常识可以判断出在E中出现的红棕色气体应该是NO2,由氨气和NO2中氮元素的化合价可以判断氨气被氧化生成NO2 氨气体现出的是还原性。
[答案](1)ACBECF AB之间的C装置中溶液保持澄清,EF之同的C装置中溶液变浑浊 (2)关闭 打开 k m 2CH3CH2OH+O2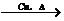 2CH3CHO+2H2O
2CH3CHO+2H2O
(3)①氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。②还原
[方法技巧]本题得分的关键是应明确实验目的:证明混合气体中有CO和H2。要想达到目的,只能利用它们的还原性将之转化为CO2和H2O来检验,同时又要防止CO2和水蒸气的干扰,所以,用CO和H2还原CuO之前,必须首先除去CO2和水蒸气。本题应先解决第(4)问。
考点2 碳酸盐性质的一般规律
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com