
32.(1)S2- + H2O HS- +OH- HS- + H2O
HS- +OH- HS- + H2O H2S +OH-(可不写)
H2S +OH-(可不写)
(2)2.7×10-3 (3)172.5
(4)使BaSO4得到充分的还原(或提高BaS的产量) ①②为吸热反应,炭和氧气反应放热维持反应所需高温
31.(1)124.2
(2)C3H8+5O2=3CO2+4H2O 负
(3)4.2×10-7 mol·L-1
(4)> HCO3-+H2O=CO32-+H3O+(或HCO3-=CO32-+H+)、HCO3-+H2O=H2CO3+OH-,HCO3-的水解程度大于电离程度
36. (06广东卷23).水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液p H变化的关系如下图所示:
(06广东卷23).水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液p H变化的关系如下图所示:
[1表示Pb2+、2表示Pb(OH)+、3表示Pb(OH)2、4表示Pb(OH)3-、5表示Pb(OH)42-]
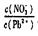 ⑴Pb(NO3)2溶液中
____2(填“>”、“<”或“=”);往该溶液中滴入氯化铵溶液后, 增加,可能的原因是:_________________________________________________。
⑴Pb(NO3)2溶液中
____2(填“>”、“<”或“=”);往该溶液中滴入氯化铵溶液后, 增加,可能的原因是:_________________________________________________。
 ⑵往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液存在的阳离子(
Na+除外 )有:_______。
⑵往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液存在的阳离子(
Na+除外 )有:_______。
pH=9时主要反应的离子方程式是:_______________________________________________。
⑶某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:

上表中除 Pb2+ 外,该脱铅剂对其他离子的去除效果最好的是:________________________>
⑷如该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2 EH(s) + Pb2+ = E2Pb(s) + 2 H+
则脱铅最合适的pH范围为_______(填代码)。
A.4-5 B.6-7 C.9-10 D.11-12
Ⅱ卷非选择题答案
35.(2007年高考江苏卷·17)(10分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III 填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积__________(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
(2)滴定结果如下表所示:
|
滴定 次数 |
待测溶液的体积 /mL |
标准溶液的体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为___________。
34.(07年高考广东化学卷·26) (12分)羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
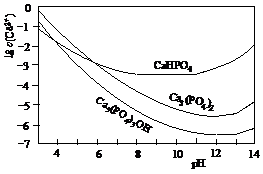
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+__________+_________
②5Ca(OH)2+3H3PO4=_________________________________________
(2)与方法A相比,方法B的优点是__________________________________________。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是_________________。
(4)图中所示3种钙盐在人体中最稳定的存在形式是______________________(填化学式)。
(5)糖黏附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因__________________________________________________________________。
33.(08年海南化学·13)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4︰5,化合物D是重要的工业原料。

(1)写出A在加热条件下与H2反应的化学方程式_____________________________。
(2)写出E与A的氢化物反应生成A的化学方程式___________________________。
(3)写出一个由D生成B的化学方程式____________________________________。
(4)将5 mL0.10 mol·L-1的E溶液与10 mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式__________________________________________;
②反应后溶液的pH ____7(填“大于”、“小于”或“等于”),理由是 ;
③加热反应后的溶液,其pH_____(填“增大”、“不变”或“减小”),理由是_______________。
32.(08年江苏化学·17)工业上制备BaCl2的工艺流程图如下:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)
+ 4C(s) 4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
BaSO4(s)
+ 2C(s) 2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,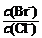 =
。
=
。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g) 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
, 。
31.(08年山东理综·29)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC
 CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH3CH
 CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC
 CH(g ) △H2=32.4 kJ·mol-1
CH(g ) △H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH
 CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5
mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
30. (06重庆卷9.)温度相同、浓度均为0.2 mol的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、
⑤ ⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是
⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是
A. ③①④②⑥⑤ B. ①③⑥④②⑤
C. ③②①⑥④⑤ D. ⑤⑥②④①③
Ⅱ卷非选择题
29. (06广东卷14).室温时,将x m L pH=a的稀NaOH溶液与y m L pH=b的稀盐酸充分反应,下列关于反应后溶液p H的判断,正确的是
A.若x=y,且a+b=14,则pH>7 B.若10x=y,且a+b=13,则pH =7
C.若ax=by,且a+b=13,则pH =7 D.若x=10y,且a+b=14,则pH>7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com