
2.气体的溶解度
在一定温度和1.01×105Pa时,1体积溶剂里达到溶解平衡时溶解的气体体积数(要换算成标准状况时的气体体积)。气体溶解度随温度的升高而减小,随压强的增大而增大。
1.固体的溶解度
(1)定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
注意点:①一定温度 ②100g溶剂 ③达到溶解平衡状态(饱和状态)④单位是克(g)
(2)有关关系式:S(溶解度)=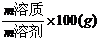
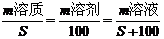
 (3)溶解度曲线:
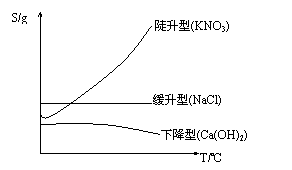
(3)溶解度曲线:
溶解度曲线是溶解度随温度变化的一种
表示方法。溶解度曲线可表示:
①同一物质在不同温度时的不同溶解度;
②不同物质在同一温度时不同溶解度;
③物质溶解度受温度变化影响的大小;
④比较不同物质的溶解度的大小。
4.溶解平衡
在一定条件下,溶解速率等于结晶速率的状态叫溶解平衡。溶解平衡是动态平衡,溶解和结晶仍在进行。达到溶解平衡的溶液是饱和溶液,它的浓度一定,未达到溶解平衡的溶液是不饱和溶液,通过加入溶质、蒸发溶剂、改变温度等方法可使不饱和溶液成为饱和溶液。
未溶解的固体溶质 溶液中的溶质
溶液中的溶质
[例1](2008·眉山市)向200C的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是( )
A.溶液温度末冷却到200C时,溶液一定是饱和溶液
B.溶液温度末冷却到200C时,溶质质量分数比甲溶液大
C.溶液温度恢复到200C时,溶液质量比甲溶液小
D.溶液温度恢复到200C时,溶液的溶质质量分数和甲溶液的相等
[解析]Ca(OH)2的溶解度随着温度的升高而降低。向200C的饱和澄清石灰水中投入适量的氧化钙粉末,加入的CaO会与水反应生成Ca(OH)2,不仅消耗了溶剂水,并且反应会放出大量的热,使溶液的温度升高,所以当溶液的温度等于200C时,肯定会有溶质Ca(OH)2析出,所得的溶液仍为饱和溶液,溶质的质量分数不变。
[答案]B
考点二 溶解度、溶质的质量分数
3.溶解过程:溶质分散到溶剂里形成溶液的过程叫溶解。物质溶解时,同时发生两个过程:

溶解是一个物理、化学过程,并伴随着能量变化,溶解时溶液的温度是升高还是降低,取决于上述两个过程中放出和吸收热量的相对大小。如:浓硫酸稀释溶液温度升高,NH4NO3溶于水溶液温度降低。
2.溶液的组成:溶液=溶质+熔剂
 溶质:被分散的物质。如食盐水中的NaCl;氨水中的NH3;碘酒中的I2
溶质:被分散的物质。如食盐水中的NaCl;氨水中的NH3;碘酒中的I2
溶剂:溶质分散其中的物质。如食盐水、氨水中的水;碘酒中的酒精
1.溶液的概念:一种或几种物质分散到另一种物质里形成的均一、稳定的混合物。
2.附加隐含条件的应用规律:
⑴溶液无色透明时,则溶液中一定没有有色离子,如Cu2+、Fe3+、Fe2+、MnO4-
⑵强碱性溶液中肯定不存在与OH-反应的离子,如Fe3+、 Fe2+、HCO3-、NH4+、Al3+
⑶强酸性溶液中肯定不存在与H+反应的离子,如HCO3-、CO32-、S2-、CH3COO-、AlO2-
[例3](2008·全国理综)在溶液中加入少量Na2O2后仍能大量共存的离子组是( )
A.NH4+、Ba2+、Cl-、NO3- B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
[解析]由题意知,往溶液中加入少量Na2O2后,①Na2O2会与原溶液中的水反应生成NaOH,使溶液呈碱性,故NH4+、Mg2+、HCO3-不能与其大量共存,A、C不正确;②Na2O2有强氧化性,会氧化溶液中的一些还原性离子,如Fe2+、SO32-等,故D不正确。
[答案]B
1.离子共存条件:
同一溶液中若离子间符合下列任意一个条件就会发生离子反应,它们之间便不能在溶液中大量共存。
⑴生成难溶物或微溶物:如:Ba2+与CO32-,Ag+与Br-,Ca2+与SO42-等不能大量共存。
⑵生成气体或挥发性物质:如:NH4+与OH-,H+与CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等不能大量共存。
⑶生成难电离物质:如:H+与CH3COO-、CO32-、S2-、SO32-等因生成弱酸不能大量共存;OH-与NH4+因生成的弱碱不能大量共存;H+与OH-生成水不能大量共存。
⑷发生氧化还原反应:
氧化性离子(如Fe3+、NO3-、ClO-、MnO4-(H+)等)与还原性离子(如S2-、I-、Fe2+、SO32-等)不能大量共存。
3.离子方程式的书写:
(1)书写规则:
①单质、氧化物、不溶物、难电离的物质(弱酸、弱碱及水等)不能拆开来写。如Cl2、Na2O等不可以拆开写成Cl-、Na+、O2-;BaSO4不可以拆开写成Ba2+、SO42-形式。
②易溶于水,易电离的物质的离子符号的改写同电离方程式中的离子形式。如NaHCO3改写Na+、HCO3-;NaHSO4应改写Na+,H+,SO42-
③微溶物,若出现在反应物中一般改写成离子符号(悬浊液除外);若出现在生成物中一般不改写。
④固体与固体物质反应不写离子方程式。如实验室制取NH3的离子方程式为:
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
⑤浓H2SO4、浓H3PO4一般不拆开写成离子形式;HCl、HNO3无论浓稀,均应改写成离子符号。如Cu片与浓H2SO4反应的离子方程式为:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
(2)书写步骤(以CuSO4溶液与BaCl2 溶液反应为)
①写出反应的化学方程式:CuSO4+BaCl2==CuCl2+BaSO4↓
②把易溶于水、易电离的物质拆开写成离子形式,难溶的物质或难电离的物质以及气体等仍用化学式来表示。上述化学方程式可改写成:
Cu2++SO42-+Ba2+ +2Cl- =Cu2++2Cl-+BaSO4↓
③删去方程式两边不参加反应的离子符号:Ba2+ + SO42- =BaSO4↓
④检查离子方程式两边各元素的原子个数和电荷总数是否相等。
|
特别提醒: 常见离子方程式的书写错误 (1)不配平(一般表现为等式两边原子不守恒或电荷数不守恒)。如Fe3++Cu =Cu2++Fe2+; Na+H2O=Na++OH-+H2↑ (2)该改的不改或不该改的改了。如Na2O溶于水:O2- + H2O = 2OH-;大理石和稀盐酸反应:CO32-+2H+=CO2↑+H2O;醋酸铵溶液与烧碱溶液共热:CH3COONH4+OH- =CH3COO-+ NH3↑+H2O;乙醛做银镜反应:CH3CHO+2[Ag(NH3)2]OH→CH3COO-+NH4++2Ag↓+3NH3+H2O等等…… (3)与反应事实不相符合。如铁片溶于稀HCl:2Fe+6H+ =2Fe3++ 3H2↑;铝条溶于稀HNO3:2Al+6H+ = 2Al3++3H2↑ (4)不是离子反应的写离子方程式。离子反应发生在水溶液中或熔融状态下,否则就不能写离子方程式。如浓硫酸与食盐共热制HCl;浓硫酸与Cu共热制SO2;实验室制CH4和NH3等都无离子方程式。   (5)乱用↑、↓、 、 符号。如FeCl3溶液的水解:Fe3+ + 3H2O = Fe(OH)3↓+ 3H+;F2通入水中:2F2+2H2O=4HF+O2↑;Na2CO3的水解:CO32-+H2O=HCO3-+OH- (5)乱用↑、↓、 、 符号。如FeCl3溶液的水解:Fe3+ + 3H2O = Fe(OH)3↓+ 3H+;F2通入水中:2F2+2H2O=4HF+O2↑;Na2CO3的水解:CO32-+H2O=HCO3-+OH-  (6)多步水解或电离的方程式一步完成或水解与电离方程式分不清楚。如Na2S溶于水:S2-+2H2O H2S +2OH-
;H2S溶于水:H2S 2H+
+ S2-。 (6)多步水解或电离的方程式一步完成或水解与电离方程式分不清楚。如Na2S溶于水:S2-+2H2O H2S +2OH-
;H2S溶于水:H2S 2H+
+ S2-。(7)漏写一种产物。如CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓;Ba(OH)2溶液中滴加稀H2SO4:H+ + OH- = H2O。 (8)随便约简或不约简。如Ba(OH)2溶液不断滴加稀H2SO4:Ba2++H++OH-+SO42-=BaSO4↓+ H2O;Al2(SO4)3溶液中加氨水:2Al3+ +6NH3·H2O=2Al(OH)3↓+6NH4+ |
[例2](2008·上海)下列离子方程式书写正确的是( )
A.AgNO3溶液中滴入少量的Na2S溶液 2Ag+ + S2-==Ag2S↓
B.过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O==HCO3-+HClO
C.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+==CO2↑+H2O
D.向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-==BaSO3↓+SO32-+2H2O
[解析]CH3COOH为弱电解质,不可拆开写成离子形式,故C不正确;因加入的NaHSO3溶液少量,则在反应中Ba(OH)2过量,书写离子方程式时应以少量的NaHSO3为主,其离子方程式应为:HSO3-+Ba2++OH-==BaSO3↓+ H2O,故D不正确。
[答案]A B
考点三 溶液中的离子共存
2.离子方程式:用实际参加反应的离子符号表示化学反应的式子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com