
1.常见阳离子的检验
|
物质 |
检验方法 |
|
H+ |
能使紫色石蕊试液或橙色的甲基橙试液变为红色。 |
|
Na+、K+ |
用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过蓝色钴玻璃片观察钾离子焰色)。 |
|
Ba2+ |
能使稀H2SO4或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀HNO3。 |
|
Mg2+ |
能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。 |
|
Al3+ |
能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。 |
|
Ag+ |
能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀HNO3,但溶于氨水,生成 [Ag(NH3)2]+。 |
|
NH4+ |
铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蕊试纸变蓝或有刺激性气味的NH3气体。 |
|
Fe2+ |
能与少量NaOH溶液反应,开始时生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。有关反应方程式为:2Fe2+ + Cl2=2Fe3+
+ 2Cl-。 |
|
Fe3+ |
能与KSCN溶液反应,变为血红色溶液;能与NaOH溶液反应,生成红褐色Fe(OH)3沉淀。 |
|
Cu2+ |
蓝色溶液(浓的CuCl2溶液显绿色)能与NaOH溶液反应,生成蓝色的
沉淀,加热后可转变为黑色的CuO沉淀。含Cu2+溶液能与Fe、Zn片等反应,在金属片上有红色的铜生成。 |
2.物质分离提纯的常用方法
①物理方法: 过滤、结晶重结晶、蒸发、蒸馏、分馏、分液、萃取、升华、渗析、溶解、盐析、洗气等。
②化学方法:
(1)加热法:混合物中混有 性差的物质时,可直接加热,使热稳定性差的物质分解而分离出去,有时受热后能变为被提纯的物质。例如,食盐中混有氯化铵。
(2)沉淀法:在混合物中加入某试剂,使其中一种以沉淀形式分离出去的方法。使用该种方法一定要注意不能引入新 。若使用多种试剂将溶液中不同离子逐一沉淀,这时应注意后加试剂能将先加试剂的过量部分除去,最后加的试剂不引入新杂质。例如,加适量BaCl2溶液除去NaCl中的Na2SO4。
(3)转化法:不能通过一次反应达到分离的目的,而要经过转化为其他物质才能分离,然后在将转化物质恢复为原物质。例如,苯酚中混有硝基苯时,先加入NaOH溶液后分液,再向苯酚钠溶液中通入CO2重新生成苯酚等。注意转化过程中尽量减少被分离物的损失。
(4)酸碱法:被提纯物不与酸反应,而杂质与酸可反应,用酸作除杂试剂;被提纯物不与碱反应,而杂质与碱易反应,用碱作除杂试剂。例如,用氢氧化钠除去铁粉中的铝粉。
(5)氧化还原法:对混合物中含有还原性杂质,加入适当氧化剂使其氧化为被提纯物质;对混合物中含氧化性杂质,可加入适当还原剂将其还原为被提纯物质。例如,FeCl2中含有FeCl3,加入铁粉,振荡过滤,即可除去FeCl3而又不引入新的杂质。
②化学方法:加热法、沉淀法、转化法、酸碱法、氧化还原法等。
特别提醒:在解答物质提纯试题时,选择试剂和实验措施应考虑三个方面:①不能引入新杂质;②提纯后的物质成分不变;③实验过程和操作方法简单易行。
[例1](黄冈中学2009届高三月考)下列各组混合物的分离或提纯方法不正确的是( )
A.用过滤法分离Fe(OH)3胶体和FeCl3溶液的混合物
B.用结晶法提纯NaCl和KNO3的混合物中的KNO3
C.用蒸馏法分离乙醇和苯酚的混合物
D.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
[解析]胶体不能透过半透膜,能透过滤纸,不能用过滤的方法分离Fe(OH)3胶体和FeCl3溶液的混合物。
答案:A
考点2 物质的检验
1.物质的分离、提纯的一般原则:分离或提纯一般应遵循 “两不两易”原则,即不增加 ,不减少所需物质,所选试剂便宜易得,欲得物质易于 。
实验室五防:(1)防 (2)防 (3)防 (4)防 (5)防堵塞:
特别提醒: 为保证试剂存放安全、减少变质,常用化学试剂的保存应注意以下几点:
①防氧化(隔离空气):如活动金属(钠、钾)应保存在煤油里;少量白磷要在水中保存。
②防吸收空气中的水和酸性气体:固体烧碱、浓硫酸、生石灰、碱石灰、电石、过氧化钠等,因易吸收水或二氧化碳,应密封在试剂瓶中保存。
③防见光分解:浓硝酸、溴水、新制氯水、硝酸银溶液、硝酸盐等见光易分解变质的物质,应保存在棕色瓶中。
④防挥发:浓硝酸、浓盐酸、液溴、浓氨水、碳酸氢铵等易挥发或易分解的试液,要放在阴凉处;液溴也要用冷水来密封保存。
⑤防瓶塞打不开或腐蚀试剂瓶:强碱溶液、浓氨水、水玻璃(Na2SiO3溶液)、碳酸钠溶液等碱性试剂,应放在带胶塞(不得用玻璃塞)的试剂瓶中保存;氢氟酸应保存在塑料瓶中。
[例5](广东省实验中学2008学年高三第二次阶段测试试卷 )下列叙述中正确的是( )
A.碘易升华所以要保存在铁盖旋紧的试剂瓶中
B.液溴应保存在磨口玻璃棕色试剂瓶中,并加少量水进行水封
C.碘易溶于酒精,所以用酒精从碘水中萃取碘
D.能使湿润淀粉碘化钾试纸变蓝的气体可能是氯气
[解析]A项碘易升华所以要保存在棕色的试剂瓶中;C项酒精与水互溶,所以不能用酒精从碘水中萃取碘。
(二)取用试剂的一般原则:
1.化学药品很多是有毒或有有腐蚀性、易燃或易爆的。取用药品时要严格做到“三不”:不能用 接触药品,不要把 凑到容器口去闻药品(特别是气体)的气味,不得 任何药品的味道。
2.注意节约药品。严格按照实验规定的用量取用药品。如果没有说明用量,一般应按最少量取用,液体 毫升,固体只盖试管底部。
3.取用粉末状或小颗粒状固体用 ,若 不能伸入试管,可用 ,要把药品送入试管底部,而不能沾在管口和管壁。块状和大颗粒固体 夹取。
4.取少量液体可用胶头滴管。取用较多的液体用倾注法,注意试剂瓶上的标签向 。向容量瓶、漏斗中倾注液体时,要用 引流。
5.用剩的药品不能 ,以免污染试剂;也不能随意抛洒,以免发生事故。要放入指定的容器中。
(一)试剂存放的一般原则:
1.固体试剂装在 口瓶中,液体试剂装在 口瓶中,见光易分解的装在 色瓶中,放在 低温处。如AgNO3固体装在棕色广口瓶中,浓HNO3装在棕色细口瓶中。
2.易挥发或易升华的要密封保存。如液溴易挥发,装在棕色细口瓶中,加适量 覆盖在液溴表面,起水封作用。碘易升华,装在 色广口瓶中密封保存。
3.能腐蚀玻璃的如氢氟酸不能用 瓶装,而装入塑料瓶中。能使玻璃试剂瓶瓶塞与瓶颈磨砂部分粘连的,如NaOH、KOH等强碱溶液和水玻璃等碱性溶液不能用 塞,通常用
塞。而能使 腐蚀的液溴、浓HNO3和使橡皮溶胀的有机溶剂如汽油、苯、甲苯等只能用玻璃塞而不能用橡皮塞。
4.有些试剂能与空气中O2、H2O(g)、CO2等发生反应,要根据试剂的性质选用不同的方法隔绝空气。如钾、钙、钠易与空气中的O2和水蒸气反应,实验室中通常保存在 中(锂的密度比煤油小,会浮在煤油上,通常保存 中);白磷易在空气中缓慢氧化而自燃,实验室保存在 中;固体NaOH易 要密封保存;Na2O2、电石等易空气中的水蒸气反应,都要密封保存。
3.胶体的重要性质
①丁达尔现象:光通过胶体时所产生的光亮的通路的现象。胶体的丁达尔现象是由于胶体微粒对光线的散射而形成的,溶液无此现象,故可用此法区别溶液和溶胶。
②布朗运动:胶体粒子所作的无规则的、杂乱无章的运动。布朗运动是分子运动的体现。
③电泳现象:在外加电场的作用下,胶粒在分散剂里向阴极或阳极作定向移动的现象。工业生产中可利用电泳现象来分离提纯物质。
|
胶体微粒 |
吸附的离子 |
胶粒带的电荷 |
在电场中胶粒移动方向 |
|
金属氢氧化物、金属氧化物 |
阳离子 |
正电荷 |
阴极 |
|
非金属氧化物、金属硫化物 |
阴离子 |
负电荷 |
阳极 |
例如:在电泳实验中,Fe(OH)3胶体微粒向阴极移动,使阴极附近颜色加深,呈深红褐色;而As2S3胶体微粒向阳极移动,使阳极附近颜色加深,呈深金黄色。
④胶体的聚沉:一定条件下,使胶体粒子凝结而产生沉淀。胶体聚沉的方法主要有三种:a.加入电解质 b.加入与胶粒带相反电荷的另一种胶体 c.加热。如:制皂工业生产中的盐析,江河入海口三角洲的形成等等。
⑤渗析:依据分散系中分散质粒子的直径大小不同,利用半透膜把溶胶中的离子、分子与胶粒分离开来的方法。利用渗析可提纯胶体。
[例3](2008·湖北仙桃) Fe(OH)3胶体中常混有FeCl3和HCl。试回答有关问题:
(1) 实验室制取Fe(OH)3胶体的方法是______________________________________,用__________方法除去胶体中的浑浊;根据____________现象证明胶体已经制成。
(2) 鉴别溶液中存在Fe3+和H+的方法是_____________________________________
_________________________________________________________________________。
(3) 除去胶体中混有的FeCl3和HCl的方法是____________________________。
(4) 如何用实验方法证明胶体和Cl-两者已经分离?______ _______________ _______________________________________________________。
[解析]向沸水中滴加饱和FeCl3溶液可制得Fe(OH)3胶体;利用过滤法可分离浊液和胶体,利用渗析法可分离浊液和胶体;利用丁达尔效应可以检验胶体的存在。
[答案](1)在沸腾的蒸馏水中滴加饱和FeCl3溶液,待溶液呈红褐色,停止加热,即制得胶体 ;过滤 ;丁达尔现象
(2)滴加KSCN溶液,变红色说明有Fe3+,pH试纸检验,变红,说明有H+
(3)渗析(将胶体装入半透膜中,然后置于蒸馏水中)
(4)取半透膜外最后一次的溶液少许于试管中,加入AgNO3溶液,若无沉淀产生,证明两者已经分离。
2.胶体的分类
 气溶胶--雾、云、烟
气溶胶--雾、云、烟
 按分散剂状态分 液溶胶--Fe(OH)3胶体、蛋白质溶液
按分散剂状态分 液溶胶--Fe(OH)3胶体、蛋白质溶液
胶体 固溶胶--烟水晶、有色玻璃
 按分散质分 粒子胶体-分散质微粒是很多分子或离子的集合体,如Fe(OH)3胶体
按分散质分 粒子胶体-分散质微粒是很多分子或离子的集合体,如Fe(OH)3胶体
分子胶体-分散质微粒是高分子,如淀粉溶液,蛋白质溶液
1.胶体的本质特征:分散质粒子的直径大小在1nm-100nm之间
3.溶质质量分数(a%)
溶质质量分数=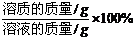
[例2](2008·南昌一模)右图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线。
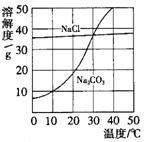 (1)当温度为10℃时,碳酸钠的溶解度为
;
(1)当温度为10℃时,碳酸钠的溶解度为
;
(2)当温度 时,氯化钠的溶解度大于碳酸钠的溶解度;
(3)生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”。请你解释原因:“夏天晒盐” ;
“冬天捞碱” 。
[解析]由题给中的溶解度曲线易看出,10℃时,碳酸钠的溶解度为10g;30℃时,氯化钠、碳酸钠的溶解度大致相等,当温度高于30℃,氯化钠的溶解度小于碳酸钠的溶解度,当温度低于30℃时,氯化钠溶解度大于碳酸钠的溶解度;且氯化钠的溶解度随温度的变化不大,碳酸钠的溶解度随温度的变化很大,所以加热蒸发浓缩有利于氯化钠晶体的析出,降温冷却则有利于碳酸钠晶体的析出。
[答案](1)10g (2)小于30℃ (3)氯化钠的溶解度受温度影响不大,夏天温度高水分蒸发快,氯化钠易结晶析出;碳酸钠的溶解度受温度影响大,冬天温度低,碳酸钠易结晶析出。
考点三 胶体及其性质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com