
1.中和热的测定
8、白色世界
(1)基态:Pb(蓝白色)、Hg、铝粉、大多数块状金属、 PbSO4 、BaSO4 、AgCl 、BaCO3 、 Ba3(PO4)2 、BaSO3 、CaCO3 、 Fe (OH)2 (不稳定)、 Mg (OH)2 、 Al (OH)3 、 ZnS
(2)化学变化:
①H2在Cl2中燃烧呈现苍白色火焰,
②NH3遇 HCl 产生白烟,
③Mg 、 Al在氧气中燃烧发出耀眼的白光
④红磷在氯气中燃烧时产生白色烟雾,
⑤红磷在氧气中燃烧时产生白烟。
[例2]只用一种试剂即可区别NaBr、NaI、NaOH、Na2CO3、NaSCN、H2S、AgNO3、C6H5OH等八种无色溶液,这种试剂为( )
A.硫酸 B.氨水 C.FeCl3溶液 D.盐酸
[解析]FeCl3溶液与NaBr不反应,与NaI反应生成I2产生紫色沉淀,与NaOH生成Fe(OH)3 红褐色沉淀,与Na2CO3产生沉淀和气体,与NaSCN生成血红色溶液,与H2S产生淡黄S沉淀、与AgNO3产生白色沉淀,与C6H5OH显紫色。
答案 C
考点3特殊的除杂方法
特别提醒:在使用常规的方法无法进行除杂操作时,即根据物理方法或化学反应不能将杂质直接除去,可突破定势思维,“一反常规”,将被提纯的物质先转化为其他物质,然后再利用化学反应将其重新还原为被提纯物质,在此过程中杂质即被除去。
[例3] (09届盐城高三联考) 七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
|
pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
|
温度 / ℃ |
10 |
30 |
40 |
50 |
60 |
|
CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
|
MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:
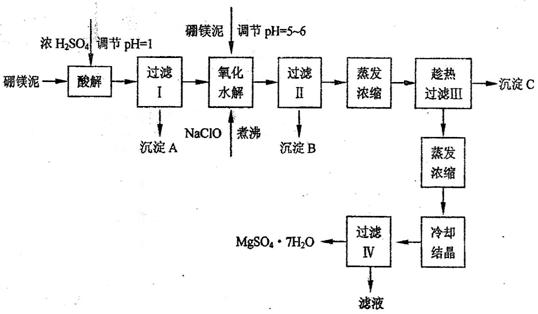
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5-6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 _______ 。加热煮沸的主要目的是_ _______ 。
(2)沉淀B中除MnO2、SiO2外还含有 _______ (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 _______ ;
(4)沉淀C的化学式是 _______ 。过滤II需趁热过滤的理由是 _______
[解析]向硼镁泥中加硫酸时MnO2、SiO2不溶解,PH=5-6时Fe(OH)3 、 Al(OH)3也会沉淀,加热煮沸的主要目的是促进Al3+、Fe3+水解及Mn2+氧化成MnO2 ,由于MgSO4的溶解度不大,温度低时结晶析出,所以过滤II需趁热过滤。
答案:(1)Mn2++ClO-+H2O=MnO2↓+2H++Cl-
促进Al3+、Fe3+水解及Mn2+氧化成MnO2 (2)Fe(OH)3 Al(OH)3
(3)取过滤II后的滤液1-2 ml于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+
(4)CaSO4·2H2O或CaSO4 以防MgSO4在温度低时结晶析出。
7、紫色世界
(1)基态:KMnO4 (H+)、紫色石蕊、碘单质呈紫黑色
(2)激发态:充氩气的灯光呈紫蓝色,钾元素的焰色呈紫色(透过蓝色钴玻璃观察)
(3)化学变化:
①I2 升华生紫烟,
②NH4I受热生紫烟,
③紫色石蕊在(5.0<pH<8.0)溶液中呈紫色,
④锌粉与碘的混合物中滴入水会生紫烟(反应放热使碘升华)
6、蓝色世界
(1)基态:CuSO4 (溶液)、 CuSO4 •5H2O (晶体)、液氧、臭氧
(2)化学变化:
①紫色石蕊在碱性溶液(pH>8)中变蓝,
②润湿的红色石蕊试纸遇碱性气体变蓝,
③无水 CuSO4 (白色粉末)遇水变蓝,
④H2、H2S 、 CH4 、C2H5OH 燃烧火焰呈淡兰色,CO燃烧火焰呈蓝色,
⑤S8在空气中燃烧呈淡蓝色火焰,在纯氧中燃烧呈现明亮的蓝紫色火焰,
⑥淀粉遇 I2 (aq)变蓝,
⑦Cl2 、 Br2 、 NO2 、O3遇湿润的淀粉碘化钾试纸变蓝
5、青色世界
(1)基态:铁粉、银粉及大多数金属粉末、石墨、CuO 、 CuS 、Cu2S FeO 、 Fe3O4 、 MnO2
(2)化学变化:
①蔗糖遇浓硫酸被炭化变黑,
②润湿的白色醋酸铅试纸遇H2S变黑,
③硫磺粉与白色的水银反应生成黑红色的HgS,
④H2S通入Pb(NO3)2 、 AgNO3 、 CuSO4溶液产生不溶于水也不溶于稀盐酸和稀硫酸的黑色沉淀。
4、绿色世界
(1)基态:F2 (浅黄绿色)、Cl2 (黄绿色)、Cu 2(OH)2CO3 (绿色)CuCl2(浓溶液呈绿色)、FeSO4 (浅绿色)
(2)激发态:铜元素的焰色呈绿色
(3)化学变化:Fe (OH)2 (白色)-- 灰绿色--Fe (OH)3(红棕色)
3、黄色世界
(1)基态:工业盐酸(含有 Fe3+)、Au 、 S8 、Na2O2 (淡黄色)、AgBr(淡黄色)、AgI、 Ag3PO4
(2)激发态:钠元素焰色呈黄色
(3)化学变化:
①甲基橙在(pH>4.4)溶液中呈黄色,
②久置的浓硝酸因溶有自身分解产生的二氧化氮而变黄
2、橙色世界
(1)基态:浓溴水 、甲基橙试剂、Br2 (CCl4)呈橙红色。
(2)化学变化:甲基橙在酸性溶液(3.1<pH< 4.4)中呈橙色,甲基红在酸性溶液(4.4<pH< 6.0)中呈橙色。
1、红色世界
(1)基态:Fe2O3 (红褐色)、Fe (OH)3 (红 棕色)、[Fe (SCN)]2+ (血红色)、Cu (紫红色)、Cu2O (砖红色)、NO2 (红棕色)、P(红磷、暗红色)、Br2 (深红棕色)、红色石蕊试纸、 品红溶液。
(2)激发态:充氦气的灯光呈粉红色,充氖气的灯光呈红色,钙元素的焰色呈砖红色。
(3)化学变化:
①紫色石蕊在酸性溶液(pH<5.0)中变红,
②润湿的蓝色石蕊试纸遇酸性(CO2、SO2 、H2S 、HCl)变红,
③酚酞在碱性溶液中呈浅红色(8.2<pH<10.0)或红色(pH>10),
④甲基橙在酸性溶液(pH<3.1)中呈红色,
⑤甲基红在酸性溶液(pH<4.4)中呈红色,
⑥pH试纸(黄色)遇酸性溶液(pH<2)变红,
⑦已经被二氧化硫褪色的品红溶液在加热时会出现红色,
⑧C(NaHSO4)>0.001mol/L时遇甲基橙变红。
2.常见阴离子的检验
|
物质 |
检验方法 |
|
OH- |
能使① 无色酚酞、② 紫色石蕊、③ 橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。 |
|
C1- |
能与AgNO3溶液反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成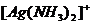 。 。 |
|
Br- |
能与AgNO3溶液反应,生成淡黄色AgBr沉淀,沉淀不溶于稀HNO3。 |
|
I- |
① 能与AgNO3反应,生成黄色AgI沉淀,沉淀不溶于稀HNO3。② I-也能与氯水反应生成I2,使淀粉溶液变蓝 |
|
SO42- |
能与含Ba2+溶液反应,生成白色BaSO4沉淀,沉淀不溶于硝酸。 |
|
SO32- |
① 浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色。② 能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体。注:BaSO3在硝酸中也不溶解,而是转化为BaSO4沉淀,但有NOx放出。 |
|
S2- |
能与Pb(NO3)2或CuSO4溶液反应,生成黑色PbS或CuS沉淀。 |
|
CO32- |
能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味能使澄清石灰水变浑浊的CO2气体。 |
|
HCO3- |
① 取含HCO3-盐溶液煮沸,放出无色无味CO2气体,气体能使澄清石灰水变浑浊。或 ② 向HCO3-盐酸溶液里加入稀MgSO4溶液,无现象,加热煮沸,有白色沉淀生成,同时放出CO2气体。 |
|
PO43- |
含PO43-的中性溶液,能与AgNO3反应,生成黄色Ag3PO4沉淀,该沉淀溶于硝酸。 |
|
NO3- |
浓溶液或晶体中加入铜片、浓H2SO4加热,放出红棕色气体。有关反应方程式为:NO3-+H2SO4=HSO4-+HNO3,Cu+4HNO3 Cu(NO3)2+2NO2↑+ 2H2O。 Cu(NO3)2+2NO2↑+ 2H2O。 |
特别提醒:无机物鉴别颜色方面的突破口:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com