
1.卤素及化合物的特性
卤族元素是最外层电子数最多的主族元素,卤族是唯一全部由非金属元素构成的元素族,卤素的非金属性比同周期其他元素都强。
(1)氟是 的非金属,单质的氧化性 ,氟离子(F-)很难被氧化。氟元素在化合物中化合价只有 , 正价,常温下氟气与水剧烈反应且 其他卤素(产物不同,原理不同), 从其他卤化物的水溶液中置换出其他卤素(先与水发生置换反应),能与稀有气体反应(常见的产物均为白色)。
(2)溴在常温下为 色液体(唯一液态非金属单质),极易挥发产生红棕色且有毒的溴蒸气。实验室通常将溴密闭保存在 处,且在试剂瓶中加 进行液封,不能用 。
(3)碘是 色固体,具有金属光泽,易升华(常用于 )、易吸潮(遇铁在水催化下易反应,故盛碘的瓶子不能用铁盖),使淀粉变 色(常用来检验碘的存在),碘的氧化性较其他卤素弱,与变价金属铁反应生成 而不是 。
(4)氢氟酸为 酸,有剧毒, 腐蚀玻璃,实验室中常用 容器保存。AgF易溶于水,无感光性,其他卤化银难溶于水,具有感光性。
2.工业制法:电解饱和食盐水: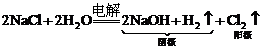
|
[特别提醒]:本实验中盐酸要过量,因随着反应的进行,盐酸的浓度降低,而MnO2与稀盐酸不反应,则反应中盐酸不可能完全消耗。 |
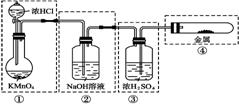 [例2]已知KMnO4与浓HCl在常温下反应能产生Cl2。若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
[例2]已知KMnO4与浓HCl在常温下反应能产生Cl2。若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
A.①和②处 B.只有②处
C.②和③处 D.②③④处
[解析]由KMnO4与浓HCl在常温下反应能产生Cl2知①正确;反应放热,浓HCl易挥发,故产生的Cl2中可能混有HCl,需要净化,洗液不能用NaOH,因为NaOH能和Cl2反应,应该用饱和食盐水,②错误;净化后的Cl2可以用浓H2SO4干燥,但气体应用长导管直接通入浓H2SO4中,③错误;干燥的氯气和金属反应的容器只有气体进入的导管,一段时间后压强升高,可能会使橡皮塞弹开,④错误。故D选项符合题意。
[答案]D
[规律总结]实验室制取气体方法及装置的选择依据
(1)选取试剂的主要依据是制取气体的性质,如氯气具有氧化性,常用氧化其离子的方法来制取,因此要选用含有氯离子的物质(如盐酸)和具有氧化性的物质(如MnO2、KMnO4等)来制取。
(2)选取发生装置的依据是制取气体所用试剂的状态和反应条件(加热与否)。如实验室用:2NaCl+3H2SO4+MnO2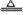 2NaHSO4+MnSO4+2H2O+C12↑法制取氯气,也是加热固体与液体的混合物,以此分析可知,所以它们的发生装置相同。
2NaHSO4+MnSO4+2H2O+C12↑法制取氯气,也是加热固体与液体的混合物,以此分析可知,所以它们的发生装置相同。
考点3 卤素及化合物的特性与卤素的检验
1.实验室制法
(1)反应原理: 。
说明:①若没有浓盐酸时,可用 代替; ②若没有MnO2时可用 代替,此时可不加热。另外KClO3、K2Cr2O7、Ca(ClO)2、PbO2等也可代替MnO2;③加热温度不宜过高,否则制得的Cl2中HCl气体杂质较多。
(2)发生装置:用分液漏斗、圆底烧瓶等组装的典型固液加热制气装置。
(3)气体的净化与干燥:C12的净化用 或 洗气,除去混在C12中的HCl气体;用 干燥。
(4)收集: 法或排 法(饱和食盐水可除去Cl2中的HCl气体)。
(5)气体的检验:用 检验。
(6)尾气处理:用 吸收多余的Cl2,以防Cl2污染大气。
2.Cl2+H2O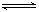 H++Cl-+HClO平衡移动的应用
H++Cl-+HClO平衡移动的应用
|
向氯水中加入 的物质 |
浓度变化 |
平衡移动 的方向 |
应 用 |
|
可溶性氯化物 |
c(Cl-) |
|
①用饱和食盐水除Cl2中的HCl②用排饱和食盐水法收集Cl2 |
|
盐酸 |
c(H+)和c(Cl-) |
|
次氯酸与浓盐酸反应制Cl2 |
|
NaOH |
c(H+) |
|
用NaOH溶液吸收多余的Cl2 |
|
Ca(OH)2 |
c(H+) |
|
制漂白粉 |
|
CaCO3 |
c(H+) |
|
制高浓度HClO溶液 |
|
光照 |
c(HClO) |
|
氯水闭光保存或现用现配 |
[特别提醒]:Cl2+H2O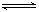 H++Cl-+HClO平衡移动的各种情况均可归结到勒夏特列原理,故掌握知识要“以不变应万变”。 H++Cl-+HClO平衡移动的各种情况均可归结到勒夏特列原理,故掌握知识要“以不变应万变”。 |
[例1](2009届龙岩一中第一学段考试)下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的 ( )
A.将NaHCO3固体加入新制氯水,有无色气泡(H+)
B.使红色布条褪色(HCl)
C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2)
D.滴加AgNO3溶液生成白色沉淀(Cl-)
[解析]氯水中存在H+,与NaHCO3反应产生CO2,与H+相关;氯水使红色布条褪色是因为氯水中存在HClO,而不是因为氯水中存在HCl;氯水中存在Cl2能氧化Fe2+→Fe3+,故滴加KSCN溶液,溶液呈血红色;氯水中存在Cl-能与AgNO3溶液生成白色沉淀。
[答案]B
[方法技巧]解此题的关键是掌握氯水中含有的各种粒子以及他们对应的性质。强酸性--H+的性质;漂白性--HClO的性质;强氧化性--Cl2、HClO的性质。
考点2 氯气的制法
1.氯水的成分和性质
|
成分 |
表现的性质 |
反应实例 |
|
|
Cl2 |
①呈黄绿色 ②强氧化性 ③加成反应 |
Cl2+Mg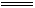 Cl2+2KI Cl2+2KI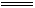
Cl2+H2SO3+H2O 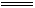
Cl2+CH2=CH2→ |
|
|
H+ |
强酸性 |
2H++CaCO3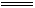
|
滴入紫色石蕊试液先 ,后 |
|
HClO |
①弱酸性 ②强氧化性 |
HClO+OH-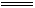 ClO-+H2O ClO-+H2O漂白、杀菌、消毒 |
|
|
Cl- |
沉淀反应 |
Cl-+Ag+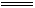 AgCl↓ AgCl↓ |
2. 中和滴定
中和滴定的步骤可归纳为如下五步:
①准备:检查 的活塞或 的橡皮部分是否漏水。用待装的溶液润洗滴定管2-3次,每次 mL。
②取液:通常将标准液装入滴定管中。用滴定管或 管将待测液移入锥形瓶中。
③滴定:滴定前,记下滴定管中的液面刻度读数,向锥形瓶中滴入 滴酸碱指示剂。滴定时,左手 ,右手 ,眼睛 。滴定完毕,再记下液面刻度读数。
④重滴:为使滴定结果准确,再重复滴定一至两次。
⑤计算:若两次滴定结果相近,取平均计算。若两次结果相差很大,应查明原因再重滴,然后再计算。
[特别提醒]:能根据误差分析的原理对实验数据进行分析,认识定量分析在化学研究中的重要性。
[例3](广东高要市二中09届模拟)(1)某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程是:取一小块钠在空气中加热片刻后与一定量的水反应,收集到VmL气体(标准状况),向所得溶液中滴入1.000mol•L-1的盐酸30.00mL恰好中和完全(如图所示)。试回答:

①甲、乙、丙三套装置共有________处错误。
②丙操作中,若以酚酞作指示剂,滴定终点时锥形瓶内溶液颜色变化是 。
③若V=168mL(标准状况),在一定条件下将其引燃,恰好完全反应。请将钠块在空气中加热片刻后所得到的固体成分及质量填在下表(表格可不填满也可补充):
|
成
分 |
|
|
|
|
质量/g |
|
|
|
(2)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度_____(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
[解析]钠加热可以生成过氧化钠、氧化钠、还有一部分没反应完的钠;甲中酒精灯盛装酒精过多,乙中应短管进气长导管排水,丙应用酸式滴定管;滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度小,否则不能用这种指示剂。
答案:(1)①三处 ②浅红色或红色变成无色,且在半分钟不褪色
③
|
成 分 |
Na2O |
Na |
Na2O2 |
|
质量/g |
0.31g |
0.23g |
0.39g |
(2)小 难
[方法技巧] 滴定达到终点的判断:当滴入最后一滴标准液,溶液颜色发生突变,且半分钟不再变化;本题指示剂的选择要根据实际情景选择,但原理相同。
1. 氧化还原滴定
2.一定物质的量浓度溶液的配制。
一定物质的量浓度溶液的配制步骤一般有五步:
①计算:计算出所需固体溶质的 或液体溶质的 。
②称量:用托盘天平称取固体溶质的 或用合适的量筒取液体溶质的 。
③溶解:将溶质倒入 中,加适量蒸馏水,用 搅拌,使溶质全部溶解,冷却到 ,用玻璃棒 ,把溶液注入一定容量的 。
④洗涤:用适量蒸馏水洗涤 和 2-3次,并将洗涤注入 。振荡,使溶液混合均匀。
⑤定容:继续向容量瓶中小心地加蒸馏水,至液面离刻度 厘米处,改用 加入至 底端与刻度线相切。塞好瓶塞,反复摇匀。将配好溶液转移到试剂瓶或容器中。
[例2]实验室配制480 mL 0.1 mol·L-1Na2CO3溶液,完成下列问题:
(1)应用托盘天平称取无水碳酸钠粉末__________g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠粉末是__________g(1 g以下用游码)。
(3)配制Na2CO3溶液时需用的主要仪器有________、_______、______、______、_______。
(4)使用容量瓶配制溶液时,下列情况会使所配溶液浓度偏低的是__________。
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 ②无水碳酸钠粉末已部分吸水变成晶体 ③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 ④转移溶液前容量瓶内有少量蒸馏水 ⑤定容时,俯视容量瓶的刻度线 ⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
[解析]在实验室中不存在480 mL的容量瓶,所以应取500 mL的容量瓶配制溶液。若物品与砝码的位置颠倒,当不使用游码时,不产生误差;当使用游码时,物品的质量为砝码的质量减去游码指示的质量,也就是比应称量的质量少游码指示的质量的二倍。在进行误差分析时,可以从公式 c=n/V着手分析。
答案:(1)5.3 (2)4.7 (3)500 mL容量瓶 托盘天平 玻璃棒 胶头滴管 烧杯
(4)①②③⑥
[方法技巧]配制溶液用的容量瓶的规格通常有25mL、50mL、100mL、250mL、500mL、1L;若物品与砝码的位置颠倒则应称量的质量少游码指示的质量的二倍;误差分析可以从公式着手分析。
考点3.滴定实验
1.一定溶质质量分数溶液的配制。
2.硫酸铜晶体中结晶水含量的测定
(1)实验原理:硫酸铜晶体是一种比较稳定的结晶水合物,当加热到258℃左右结晶水全部失去,据加热前后的质量差,可推算出其晶体的结晶水含量。
设硫酸铜晶体为CuSO4·xH2O。
=或∶=
[m(H2O)=m(CuSO4·xH2O+瓷坩埚)-m(CuSO4+瓷坩埚)]
(2)实验步骤:“四称”、“两热”
(1)称坩埚(W1g);(2)称坩埚及晶体(W2g);(3)加热至晶体完全 ;
(4)冷却称重(W3g);(5)再 ;(6)冷却称量(两次称量误差不得超过 g);
(7)计算(设分子式为CuSO4·xH2O)。 x=
[特别提醒]:注意化学实验中收集有关数据,学会对数据、图表的分析处理,并科学地得出结论。
[例1](山西省实验中学09届高三月考)在测定硫酸铜晶体中结晶水的含量的实验操作中:
(1)加热前晶体应该放在 中研碎,加热时是放在 中进行,加热失水后,应放在 中冷却。
(2)判断是否完全失水的方法是 。
(3)做此实验时,最少应该进行称量操作 次。
(4)下面是某学生一次实验的数据,请完成计算,填入下面的表中。
|
坩埚质量 |
坩埚与晶体的总质量 |
加热后坩埚与固体的总质量 |
测得晶体中结晶水个数 |
|
11.7g |
22.7g |
18.6g |
|
(5)这次实验中产生误差的原因可能是( ) (填选项)
A.硫酸铜晶体中含有不挥发的杂质B.实验前晶体表面有水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
[解析]本题可以通过对硫酸铜晶体中结晶水含量的测定实验的复习逐一解答.
实验仪器:托盘天平、研钵、酒精灯、玻璃棒、坩埚 、三角架、泥三角、坩埚钳、干燥器
实验步骤:“四称”、“两热”、“ 一算”
计算:(设化学式为CuSO4·nH2O)
n=160(m2-m3)/(m3-m1)
答案:(1)研体 坩埚 干燥器
(2)最后连续两次加热冷却后称量的质量差不超过0.1g
(3)4 (4)5.3g (5)BC
[方法技巧] 硫酸铜晶体中结晶水含量的测定实验中除了要熟练掌握实验所需要的仪器和实验步骤外,还应当注意几个事项:一是坩埚可以直接加热,要放到泥三角上,二是加热完全失去结晶水后,坩埚要放到干燥器中冷却以免无水硫酸铜吸水。
考点2 溶液的配制
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com