
3.检验的误区
干扰检验的离子:Ag+能与SO42-离子反应生成难溶于水的白色沉淀Ag 2SO4;Ag+还能与Cl-反应生成难溶于水的白色沉淀AgCl;SO32-、CO32-、SiO32-、PO43-等能与Ba2+反应生成难溶于水的白色沉淀。但这些白色沉淀溶于强酸中。
2.试剂: 。
1.原理:利用Ba2++SO42- BaSO4↓(白色),BaSO4 盐酸、硝酸的特性。
BaSO4↓(白色),BaSO4 盐酸、硝酸的特性。
2.化学性质
相同点:都是 氧化物。
①都能和水反应,生成的酸 稳定,只能存在于溶液中CO2+H2O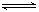 H2CO3;
H2CO3;
SO2+H2O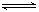 H2SO3。
H2SO3。
②都能与碱反应,用量比不同,可以生成两种盐。
SO2、CO2气体通入澄清石灰水中,都是先生成沉淀,当SO2、CO2过量时又溶解。
Ca(OH)2+SO2 CaSO3+SO2+H2O
CaSO3+SO2+H2O
Ca(OH)2+CO2 CaCO3+CO2+H2O
CaCO3+CO2+H2O
不同点:
①SO2常表现 性:2SO2+O2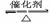 2SO3 CO2表现 性:CO2+C
2SO3 CO2表现 性:CO2+C 2CO
2CO
SO2被高锰酸钾、氯水、溴水、碘水等氧化剂氧化,CO2不能。
②SO2具有漂白性,能漂白某些有色物质,CO2不能。
③造成环境破坏的原因不同:SO2形成 ,CO2引起 。
|
[特别提醒]:①能使品红溶液腿色的物质有:SO2
、Cl2、O3、H2O2、Na2O2、活性碳等。 ②SO2使氯水、溴水、酸性KMnO4溶液腿色,不是由于其漂白性,而是因为其还原性。③干燥的SO2气体无漂白作用。④等物质的量SO2 和Cl2混合后通入品红溶液中,不能使之腿色。原因是SO2 和Cl2发生反应生成了无漂白性的盐酸和硫酸。 |
[例2] 下列实验能证明某无色气体为SO2的是 ( )
①能使澄清石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使品红试液褪色,加热后又显红色 ④能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀产生
A.①②③④ B.①③④ C.③④ D.②③④
[解析]能使澄清石灰水变浑浊的气体有SO2、CO2;能使湿润的蓝色石蕊试纸变红的气体为酸性气体(如:HCl、HBr、SO2、CO2等);能使品红褪色的气体有Cl2、SO2,但Cl2有颜色,褪色后加热又显红色的只有SO2;能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀生成,只有SO2气体符合。
[答案]C
[规律总结] SO2和CO2都能使澄清的石灰水变浑浊,若通入的气体过量,则沉淀都可消失。所以不能用澄清的石灰水鉴别SO2和CO2。通常可用以下方法:
①用品红溶液,使品红溶液褪色的是SO2,不能使品红溶液褪色的是CO2。
②用氢硫酸,出现浑浊的是SO2,无明显现象的是CO2。2H2S+SO2 2H2O+3S↓
2H2O+3S↓
③用高锰酸钾溶液,紫色褪去的是SO2,无明显现象的是CO2。
2KMnO4+5SO2+2H2O K2SO4+2MnSO4+2H2SO4
K2SO4+2MnSO4+2H2SO4
④用溴水,使橙色褪去的是SO2,无明显现象的是CO2。Br2+2H2O+SO2 2HBr+H2SO4
2HBr+H2SO4
⑤用硝酸酸化的硝酸钡溶液,产生白色沉淀的是SO2,无明显现象的是CO2。
2H2O+2HNO3+3SO2 3H2SO4+2NO Ba(NO3)2+H2SO4
3H2SO4+2NO Ba(NO3)2+H2SO4 BaSO4↓+2HNO3
BaSO4↓+2HNO3
⑥用FeCl3溶液,使棕黄色颜色变浅的是SO2,无明显现象的是CO2。
2FeCl3+SO2+2H2O FeCl2+FeSO4+4HCl
FeCl2+FeSO4+4HCl
考点3 浓硫酸和稀硫酸氧化性比较
|
比较项目 |
浓硫酸 |
稀硫酸 |
|
氧化性强弱 |
氧化性(S) |
氧化性(H+) |
|
氧化性的原因 |
|
|
|
还原产物 |
一般是 ,可以是硫单质 |
H2 |
|
与金属单质的反应 |
在常温下,使铁、铝钝化,因加热条件下可以反应。规律:金属+H2SO4→ |
能与排在金属活动顺序表氢之前的金属发生置换反应。 |
|
与非金属单质的反应 |
加热条件下可以和某些非金属单质反应 |
不能反应 |
|
与H2S等还原性物质反应 |
能够反应 |
不能反应 |
|
[特别提醒]:①硫酸的性质取决于硫酸的浓度。②98.3%的浓H2SO4密度为1.84 g·cm-3,比水的密度大;硫酸的浓度越大,密度越大,如将50%的H2SO4溶液和10%的H2SO4溶液等体积混合,则所得溶液的质量分数大于30%;浓H2SO4或密度小于浓硫酸的溶液被稀释或与浓H2SO4混合时,都是将浓H2SO4沿玻璃棒注入其中,并不断搅拌,使其散热。 |
[例3](2008届创博智典联考题)中学教材高中化学第一册有如下图1所示的铜与浓硫酸反应实验装置,该实验过程中会有二氧化硫气体放出,污染室内空气,严重地损害师生健康.为此某课外小组对此实验进行如图2所示的改进,改进的实验操作简单现象明显,并且几乎无二氧化硫气体泄漏。实验步骤如下:
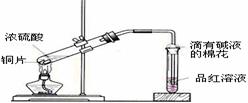
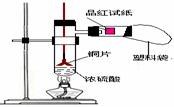
图1 图2
①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
回答下列问题:
(1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ;
(2)塑料袋作用是: ;
(3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是: ;相关的离子方程式是: 。
[解析]当铜片接触热浓硫酸时,有大量的白雾产生(白雾是由于二氧化硫气体与水结合形成亚硫酸小液滴缘故)并沿支管口喷在品红试纸上,使品红试纸的红色开始褪色,而且原来无色硫酸溶液开始变绿,当品红试纸完全褪成白色后,把铜片向上提使其离开浓硫酸溶液,反应马上停止。
[答案](1)支管口有白雾,试管中出现绿色,品红试纸褪色,铜片部分溶解。
(2)收集多余的SO2气体,防止污染空气;
(3)在反应后的试管中、塑料袋中加适量的碱吸收SO2气体
SO2+2OH- H2O+SO32-或SO2+OH-
H2O+SO32-或SO2+OH- HSO3-
HSO3-
[规律总结]浓硫酸的吸水性:吸收物质中由水分子组成的的水蒸气或结晶水。可用作干燥剂,但一般不能干燥碱性和还原性气体。脱水性:将某些化合物中(主要是有机化合物)中H、O两原子按水的组成比2∶1脱去。(浓硫酸可用作有机反应的催化剂和脱水剂)
浓硫酸使湿润的石蕊试纸先变红(酸性引起),后变黑(脱水性引起);而稀硫酸则只能使湿润的石蕊试纸变红,不能使之变黑或褪色。
考点4 溶液中SO42-的检验
1.物理性质
相同点:常温下,都是 色气体,密度都 空气。
不同点:CO2 气味,SO2有 气味;CO2 毒,SO2 毒;CO2 水(1体积水大约溶解1体积气体),SO2 水(1体积水大约溶解40体积气体);SO2易液化。
2.化学性质
硫原子最外层6个电子,较易得电子,表现较强的氧化性。
(1)与金属反应:Na+S (剧烈反应并发生爆炸)
(剧烈反应并发生爆炸)
Al+S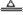 (制取 的唯一途径) Fe+S
(制取 的唯一途径) Fe+S 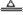 (黑色)
(黑色)
(2)与非金属的反应:S+O2 S+H2
S+H2
 H2S
H2S
(3)与化合物的反应S+6HNO3(浓)
S+2H2SO4(浓) S+NaOH
S+NaOH 
|
[特别提醒]:①在溶液中通过化学反应生成少量硫时,有时称乳白色。②硫的溶解性:不溶于水,微溶于酒精,易溶于CS2。因此用物理方法洗去试管壁上的硫,只能用CS2作溶剂。③由硫能溶于热碱溶液可知,用热碱溶液可洗去试管壁上的硫,由于NaOH碱性强,腐蚀玻璃,故实验室常用热Ca(OH)2溶液而不用热NaOH溶液除去试管内的硫。 |
[例1](1)将m g铁粉和n g硫粉均匀混合,在密闭容器中加热到红热,冷却后加入____Lb mol·L-1的盐酸就不再产生气体。若把已放出的气体收集起来,在标准状况下的体积是______。
(2)若把0.1 mol铁粉和1.6 g硫粉均匀混合后,铺在石棉网上用酒精灯加热引燃,完全反应后,将残渣全部放入过量的稀H2SO4中充分反应,结果所产生的气体体积在标准状况下明显少于2.24 L,其原因是__________________________________________________。
[解析](1)由Fe+S FeS,FeS+2HCl
FeS,FeS+2HCl FeCl2+H2S↑,得Fe-2HCl;又由Fe+2HCl
FeCl2+H2S↑,得Fe-2HCl;又由Fe+2HCl FeCl2+H2↑,得Fe-2HCl,即产生气体的总体积和消耗的盐酸的量与硫粉量无关,只由铁的量确定。
FeCl2+H2↑,得Fe-2HCl,即产生气体的总体积和消耗的盐酸的量与硫粉量无关,只由铁的量确定。
设加入b mol·L-1盐酸的体积为V,则
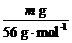 ×2=V×b mol·L-1,得V=
×2=V×b mol·L-1,得V=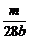 L或
L或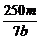 mL
mL
标准状况下产生气体的体积为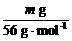 ×22.4
L·mol-1=0.4m L。
×22.4
L·mol-1=0.4m L。
(2)n(S)=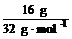 =0.05 mol<0.1 mol,铁粉过量,过量的铁粉在加热的条件下被空气中的氧气氧化,生成的铁的氧化物与H2SO4反应不再放出H2,故放出气体的体积小于2.24
L。
=0.05 mol<0.1 mol,铁粉过量,过量的铁粉在加热的条件下被空气中的氧气氧化,生成的铁的氧化物与H2SO4反应不再放出H2,故放出气体的体积小于2.24
L。
[答案](1)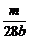 0.4m L
0.4m L
(2)与硫反应的铁粉过量,过量的铁粉在加热的条件下被空气中的氧气氧化,生成了铁的氧化物,与H2SO4反应不再放出H2,故放出气体的体积小于2.24 L
[方法技巧]本题定量考查硫与铁化合及其生成的FeS与酸反应,通过分析,明确一定量的硫与铁的混合物反应后,加盐酸产生的气体的物质的量只与铁粉有关,且与铁的物质的量相等。但利用此结论解题时需注意反应的条件和环境。
考点2 二氧化碳和二氧化硫性质的异同
1.物理性质
硫有 同素异形体。如单斜硫、斜方硫、弹性硫等。常温为 色晶体(淡黄色固体有: 等)。
2. 不同的卤素之间可以互相化合,形成一系列化合物,如IBr等,这类化合物称为卤素互化物,与卤素单质的性质相似。
与水反应:IBr+H2O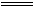
与碱反应:IBr+2NaOH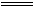 其中非金属性弱的卤素显 价。
其中非金属性弱的卤素显 价。
|
[特别提醒]:卤素互化物,与卤素单质的性质相似,具有较强的氧化性,如KBr+BrCl=KCl+Br2
SO2+2H2O+BrCl=HCl+HBr+H2SO4。 |
 [例4]卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
[例4]卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
(1)卤素互化物BrCl能发生下列反应
H2O+BrCl=HBrO+HCl KBr+BrCl=KCl+Br2
①写出KI与IBr反应的化学方程式______________。
②写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式_____________。
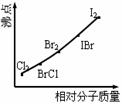
(2)右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是____________。
(3)试推测ICl的沸点所处的最小范围______________。
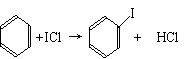 [解析]从题给信息可知:卤素互化物与卤素单质结构相似、性质相近,BrCl与Cl2相似,IBr与Br2相似。KI与IBr反应相当KI与Br2反应,方程式为:KI+IBr=KBr+I2。C6H6与ICl发生取代反应相当C6H6与Cl2发生取代反应,方程式为:C6H6+ICl→C6H5I+HCl。ICl属分子晶体,相对分子质量(162.5)介于Br2和IBr之间,故ICl的沸点介于Br2和IBr之间。
[解析]从题给信息可知:卤素互化物与卤素单质结构相似、性质相近,BrCl与Cl2相似,IBr与Br2相似。KI与IBr反应相当KI与Br2反应,方程式为:KI+IBr=KBr+I2。C6H6与ICl发生取代反应相当C6H6与Cl2发生取代反应,方程式为:C6H6+ICl→C6H5I+HCl。ICl属分子晶体,相对分子质量(162.5)介于Br2和IBr之间,故ICl的沸点介于Br2和IBr之间。
[答案](1)①KI+IBr=KBr+I2
②C6H6+ICl→C6H5I+HCl;或
(2)相对分子质量越大,分子间作用力越强。(3)介于Br2的沸点和IBr的沸点之间
[规律总结]
“拟卤素”如:(CN)2、(SCN)2、(OCN)2、IBr等性质与卤素相似,表现在单质的氧化性、与碱溶液反应生成卤化物和次卤酸盐、与Ag+结合的生成物的难溶性等。但是,由于拟卤素的组成不是一种元素,其各元素的化合价有差别,在参加化学反应中价态的变化与卤素单质不完全相同,如IBr+H2O HBr+HIO的反应不属于氧化还原反应等。
HBr+HIO的反应不属于氧化还原反应等。
1. 与卤素单质的性质相似,其原子团是化合物中的阴离子,也有与卤素阴离子相似的性质。如:氰(CN)2 ,硫氰(SCN)2等物质,称为拟卤素。
可以和碱反应:(CN)2+2NaOH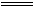
与氧化剂反应:(CN)2+MnO2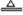
2.卤素的检验
(1)氯气为黄绿色,有刺激性气味,并可使某些潮湿的有色物质褪色。氯气具有强氧化性,可使湿润KI淀粉试纸呈现 色,因此可用于检验氯气的存在。
(2)利用碘单质能与淀粉溶液呈现 色的性质可用于检验碘单质的存在。
(3)AgCl、AgBr、AgI都不溶于稀HNO3,且颜色逐渐加深,分别为 色、 色、
色,所以,可用 溶液来检验Cl-、Br-、I-的存在。
(4)也可以用卤素单质间的置换反应和有机溶剂萃取的方法来检验卤素单质。
|
[特别提醒]:检验X-时,要先加稀HNO3酸化,以排除CO32-、PO43-等离子的干扰。 |
[例3](2007年上海)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是 ( )
A.K+一定存在 B.100mL溶液中含0.01mol CO32-
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
[解析]加入NaOH溶液加热后有气体产生,说明溶液中含NH4+;加足量BaCl2溶液后有沉淀产生,说明溶液中含CO32-或SO42-或CO32-、SO42-均有,经盐酸洗涤、干燥后,沉淀部分溶解,故CO32-、SO42-均有。因溶液中含CO32-、SO42-,故不含Mg2+、Ba2+;从实验(3)可见,溶液中含SO42-0.01mol,含CO32-0.02mol,从实验(2)得知,溶液中含NH4+0.04mol,故应还最少含K+0.02mol,Cl-可能存在也可能不存在。
[答案]AC
[误区警示]用AgNO3溶液检验卤素离子,必须加入少量稀硝酸,观察沉淀不溶解。只能加少量稀硝酸,不能加浓硝酸,也不能硝酸过量,更不能用盐酸或硫酸酸化。因为除了AgX产生沉淀外,还有Ag2SO3和Ag3PO4会产生白色或浅黄色沉淀,加硝酸的目的就是这些银盐会溶于酸以排、去干扰。不能用盐酸,硫酸酸化,因为这些就本身会生成银盐沉淀,硝酸不能多,也不能浓,因为硝酸多了,会把SO32-氧化成SO42-,这样又会造成新的错觉,把SO32-当成了卤离子。这个方法不能检验F-,因为AgF会溶于水。
考点4 卤素互化物与拟卤素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com