
1.Na2O2的结构特点
在Na2O2和H2O2中,氧是 价,这是因为两个氧原子之间以一对共用电子相结合(非极性键),形成了一种不太稳定的结构。
3.钠与盐溶液的反应
实质上是先与水反应生成 NaOH,NaOH再与盐反应。
与CuSO4溶液反应:2Na+2H2O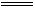 NaOH+H2↑
(1) CuSO4+2NaOH
NaOH+H2↑
(1) CuSO4+2NaOH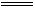 Na2SO4
Na2SO4
+Cu(OH)2 (2) 合并(1)(2)得:
(2)与FeCl3溶液反应:
|
[特别提醒]:钠和盐溶液反应,不能置换出盐中的金属,这是因为金属阳离子在水中一般是以水合离子形式存在,即金属离子周围有一定数目的水分子包围着,不能和钠直接接触。钠与熔融的盐反应才可能置换出盐中的金属。 |
[例1] 下列关于钠与水反应的说法不正确的是 ( )
①将小块钠投入滴有石蕊试液的水中,反应后溶液变红;②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应;③钠在水蒸气中反应时因温度高会发生燃烧;④将两小块质量相等的金属钠,一块直接投入水中,另一块用锡箔包住,在锡箔上刺些小孔,然后按入水中,两者放出的氢气质量相等。
A.①② B.②③ C.②③④ D.①②③④
[解析]钠与水反应产生氢氧化钠只能使酚酞变红,而不能使石蕊变红。钠与水的反应本质是钠与H+的反应,所以钠先与盐酸溶液中的酸反应。钠在水蒸气中反应产生的是氢气,尽管温度高且反应放热,因无氧气不能燃烧。钠的密度比水大,浮在水面上时,就有部分钠被氧气氧化,而用锡箔包住的钠不会被氧气氧化,所以与水反应的钠质量不相等,两者放出氢气的质量也不相等。
[答案]D
[黑色陷阱]忽视了钠与水反应产生H2,无氧气存在而漏选③;忽略了钠直接投入水中,在水面上部分钠被氧化而漏选④。
考点2 过氧化钠的结构与性质
2.钠与酸溶液反应
当钠投入酸溶液中,钠首先与酸电离出的H+反应: ;当酸完全反应后,过量的钠再与水反应,故钠与酸溶液反应比钠与水反应 。
1.钠与水的反应可以概括为: 五个字来记忆。
(1)钠投入水中并浮在水面上--密度 水。
(2)钠立即跟水反应,并 ,发出嘶嘶声,产生气体。
(3)同时钠熔成一个闪亮的小球并在水面上向各方向迅速游动最后消失-- 。(4)反应后的水溶液使酚酞 --与水反应生成NaOH。
3.铜的常见化合物颜色、溶解性:CuO-- 色、难溶;Cu2O-- 色、难溶;Cu2S--
色、难溶;CuSO4-- 色、易溶;CuSO4·5H2O-- 色、易溶;Cu2(OH)2CO3--
色、难溶;Cu(OH)2-- 色、难溶。
[例2](南通市2008届高三第一次调研测试)研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论正确的是 ( )
A.铜与浓硫酸反应所得白色固体是CuSO4
B.加BaCl2溶液后所得白色沉淀是BaSO3
C.白色固体中夹杂的少量黑色物质可能是CuO
D.白色固体中夹杂的少量黑色物质中含元素Cu、S
[解析]黑色物质不可能是CuO,原因是烧杯中有硫酸,黑色固体不溶于硫酸;加BaCl2溶液用硝酸酸化后所得白色沉淀是BaSO4。
2.化学性质:金、银、铜都属于 金属,相对而言,其活泼程度依次 。
①金:金是最稳定的金属之一,在高温下 与氧气反应, 被硝酸等强氧化性酸氧化。但金 溶解在王水中。
②银:银虽然不能与盐酸、稀硫酸反应,但却能溶解在硝酸等强氧化性酸中:
Ag+2HNO3 (浓)= ;3Ag+4HNO3 (稀)=
③铜:a.与非金属单质反应:2Cu+O2 2CuO;2Cu+S
2CuO;2Cu+S ;Cu+Cl2
;Cu+Cl2 CuCl2
CuCl2
b.与酸反应:与银相似,铜不能与盐酸、稀硫酸反应,但却能溶解在硝酸等强氧化性酸中:Cu+2H2SO4(浓) Cu+4HNO3(浓)=
。
Cu+4HNO3(浓)=
。
c.与盐溶液反应:Cu+2FeCl3=CuCl2+2FeCl2
d.铜的锈蚀:铜在干燥空气中性质稳定,但在潮湿空气中会被腐蚀,在其表面逐渐形成一层绿色的铜锈:2Cu+O2+H2O+CO2=Cu2(OH)2CO3
1.物理性质
①特性:金是 色金属;银是 色金属;铜是 色金属。
②共性:硬度较小,熔点较高,密度较大,有金属光泽、良好的延展性、导电和导热性。
3.制备物质
(1)工业冶炼铁,如:Fe3O4+4CO 3Fe+4CO2
3Fe+4CO2
(2)制取氢氧化亚铁
实验原理:
实验现象: 。
要制得白色的Fe(OH)2沉淀,要注意以下几点:
①硫酸亚铁溶液中不能含有Fe3+,因此,硫酸亚铁溶液应是 。
②实验用的氢氧化钠溶液,溶解亚铁盐的蒸馏水应煮沸,以 。
③实验时,用长胶头滴管吸取氢氧化钠溶液后,把滴管插入硫酸亚铁溶液的 ,再轻轻挤胶头滴管的胶头,逐滴加入氢氧化钠溶液,这时就会析出Fe(OH)2白色絮状沉淀。
|
[特别提醒]:Fe(OH)2制备的方法很多,核心问题两点,一是溶液中的溶解氧必须除去,二是反应过程必须与O2隔绝。 |
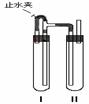 [例1](2008 届金湖中学第二次质量检测)由于Fe(OH)2在空气中易被氧化,同学们为了观察到白色的Fe(OH)2固体想了很多方法。甲同学:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等制备。
[例1](2008 届金湖中学第二次质量检测)由于Fe(OH)2在空气中易被氧化,同学们为了观察到白色的Fe(OH)2固体想了很多方法。甲同学:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等制备。

(1)在试管I里加入的试剂是 。
(2)II中的试剂加入前应如何处理: 。
(3)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
乙同学:只是将甲同学所用药品中的铁屑改为FeS固体,其余都与甲相同。
(5)对乙同学的这一改变请你作出评价:__________________________________。
丙同学:认为甲乙两同学所用的装置太复杂,难以组装,该同学应用试管取了一些不含Fe3+的FeSO4溶液,然后向其中加入经煮沸并冷却的NaHCO3溶液,结果也制得了白色沉淀并较长时间保持白色。
(6)请你解释原因并写出相关反应的离子方程式:______________________________。
[解析]用FeSO4溶液与NaOH溶液反应制备Fe(OH)2并观察沉淀的颜色变化是必修Ⅰ重要的演示实验。Fe(OH)2、FeSO4均易被氧化,FeSO4又易水解,应避免生成的Fe(OH)2沉淀接触O2,可得答案。
乙同学将药品中的铁屑改为FeS固体,与稀H2SO4反应生成H2S,H2S有强还原性。
[答案](1)稀H2SO4和铁屑 (2)煮沸 (3)稍等片刻后关闭止水夹
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不易进入。
(5)反应中生成的H2S也能防止Fe(OH)2被氧化,白色沉淀能存在较长时间,但易产生空气污染。(6)因双水解反应:Fe2++2HCO3–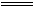 Fe(OH)2↓+2CO2↑,CO2既能排净试管中的空气,也能防止空气进入试管。
Fe(OH)2↓+2CO2↑,CO2既能排净试管中的空气,也能防止空气进入试管。
[规律总结]制备方法探究
① 在液面上加隔氧剂:用密度比水小的且不溶于水的有机溶剂,如汽油、苯等物质滴加在反应液面上进行液封,以减少Fe(OH)2与O2接触。(不能用四氯化碳,因为四氯化碳比水密度大,加入它后会处于试管底部,起不到隔离空气的作用。)
在液面上加隔氧剂:用密度比水小的且不溶于水的有机溶剂,如汽油、苯等物质滴加在反应液面上进行液封,以减少Fe(OH)2与O2接触。(不能用四氯化碳,因为四氯化碳比水密度大,加入它后会处于试管底部,起不到隔离空气的作用。)
②用右图装置
向试管中加入煮沸过的稀硫酸,加入稍过量的还原铁粉,充分反应后得到FeSO4溶液,静置。液面上充满氢气。打开止水夹可见白色沉淀。
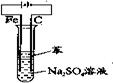 ③用电解实验
③用电解实验
电极材料:石墨碳棒和铁片,(注:铁片表面氧化膜要去掉)将铁片与直流电源的正极连接,石墨棒与直流电源的负极连接。
电解液:可选择Na2SO4溶液或NaOH溶液。 方法:在进行电解前应对电解液进行简单处理:加热一段时间驱赶溶液中氧气,然后再向电解液中加入苯,隔绝空气,防止Fe(OH)2被氧化。
考点2 金、银、铜等金属材料
2.分离与提纯
(1)FeCl2(杂质FeCl3),加入 或 后过滤。
(2)FeCl3(杂质FeCl2),通入 或滴加 或加入“绿色”氧化剂 :
。
1.共存问题
(1)Fe2+在酸性条件下不能与强氧化性离子共存,如: 等。不能与发生复分解和双水解反应的离子共存,如: 等。
(2)Fe3+:不能与还原性离子共存,如: 等。不能与发生复分解和双水解反应的离子共存,如: 等;不能与SCN-共存;不能与苯酚共存。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com