
2.盖斯定律的应用
盖斯定律在科学研究中具有重要意义。因为有些反应进行的很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。此时如果应用盖斯定律,就可以间接的把它们的反应热计算出来。
[例4] (08宁夏卷)已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.-44.2kJ·mol-1 B.+44.2kJ·mlo-1
C.-330kJ·mol-1 D.+330kJ·mlo-1
[解析] 由题意可知:C2H4(g)+3O2(g) 2CO2(g)+2H2O(l);△H=-1411.0kJ·mol-1,
2CO2(g)+2H2O(l);△H=-1411.0kJ·mol-1,
C2H5OH(1)+3O2(g) 2CO2(g)+3H2O(l);△H=-1366.8kJ·mol-1,将上述两个方程式相减得:C2H4(g)+H2O(l)
2CO2(g)+3H2O(l);△H=-1366.8kJ·mol-1,将上述两个方程式相减得:C2H4(g)+H2O(l) C2H5OH(l);△H=-44.2kJ·mol-1。
C2H5OH(l);△H=-44.2kJ·mol-1。
[答案] A
[方法技巧] 用盖斯定律解题首先要知道有关的反应式和相应的反应热,然后将反应合并成所求的反应式,其相应的反应热要同样合并。
1.盖斯定律的涵义:
化学反应的反应热只与反应的 (各反应物)和 (各生成物)有关,而与反应的 无关。即如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
3.热化学方程式书写正误判断方法是:
(1)检查是否标明聚集状态;
(2)检查ΔH的 是否与吸热、放热一致;
(3)检查ΔH的数值是否与反应物或生成物的 相对应(成比例)。
本考点考查较多的是热化学方程式的书写与正误判断,以及由热化学方程式判断物质的稳定性或比较反应热的大小。
[例2] 已知在25℃,101kPa下,1g辛烷C8H8燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
A.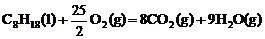 ;△H=-48.40kJ/mol
;△H=-48.40kJ/mol
B. ;△H=-5518kJ/mol
;△H=-5518kJ/mol
C. ;△H=+5518kJ/mol
;△H=+5518kJ/mol
D.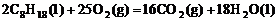 ;△H=+11036kJ/mol
;△H=+11036kJ/mol
[解析] 1 molC8H18 燃烧放出热量48.40kJ/g×114g=5518kJ。2molC8H18放热为11036mol,但是一定要注意符号是“+”还是“-”.
[答案]B
[规律总结]:放热为“+”吸热为“-”,但是焓变△H表达是“+”表示吸热,“-”表示放热.
考点3使用化石燃料的利弊及新能源的开发
(1)重要的化石燃料: 。
(2)煤作燃料的利弊问题。
(3)燃料充分燃烧的条件:①要有足够的 。②跟空气有足够大的 。
(4)新能源的开发:①调整和优化能源结构,降低 在能源结构中的比率。
②最有希望的新能源是核能、太阳能、燃料电池、风能和氢能、潮汐能、地热能等。这些新能源的特点是资源丰富,且有些可以再生,为再生性能源,对环境没有污染或污染少。
[例3] (2007年高考理综上海卷)氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括( )
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A.①② B.①③ C.③④ D.②④
[解析]水是广泛的氢来源,但是氢气储存不方便,制备时候要消耗大量能源
[答案] :A
[规律总结]水是多的,但是用水得到氢气的制备工艺并不是廉价易行。能源问题是高考考查的一个热点,开发利用新能源、清洁能源是绝大多数同学都熟知的内容,进一步考查这方面的知识是高考的一个明显趋势
考点4盖斯定律及其应用
2.书写热化学方程式的注意事项:
(1)需注明反应的 ;因反应的温度和压强不同时,其△H不同。
(2)要注明反应物和生成物 。
(3)热化学方程式各物质前的化学计量数不表示分子个数,它可以是整数也可以是分数。对于相同物质的反应,当化学计量数不同时,其△H也不同。
1.定义:表示 的化学方程式,叫做热化学方程式。
4.Al(OH)3的用途:由于Al(OH)3具有吸附性,既能凝聚水中悬浮物,又能吸附色素,因此Al(OH)3可作净水剂和色素吸附剂。
[例2]使溶液中Ba2+、Mg2+、Al3+、Ag+、Cu2+分步逐一沉淀析出,加入下列试剂的顺序正确的是 ( )
A.NaCl→Na2S→Na2SO4→NaOH→HNO3 B.H2SO4→HCl→H2S→NaOH→CO2
C.HCl→H2SO4→H2S→NaOH→CO2 D.Na2S→Na2SO4→NaCl→NaOH→HCl
[解析]SO42-能同时除去Ba2+和Ag+,S2-能同时除去Ag+和Cu2+,所以不能放在第一位,排除BD;AC相比,在加入前四种试剂后,Al3+以AlO2-形式存在,加酸可使AlO2-以Al(OH)3形式沉淀。但HNO3量 不好控制,所以最好的选项为C。
[答案]C
[规律总结]解除杂题应注意①除杂试剂的选择。本题要求将离子分步逐一除去,所以试剂要一一对应:Ba2+-SO42-,Mg2+-OH-,Ag+-Cl-,Cu2+-S2-,②除杂的顺序。为了将杂质除干净,除杂试剂一般是过量的,这样势必引入新杂质。所以后续的除杂试剂在去除对应杂质的同时,还要有将前一过量除杂试剂清除的作用。
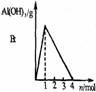
考点3 镁和铝的图像
|
基本坐标图像 |
实验现象及反应原理 |
衍生坐标图像 |
化学反应原理 |
 |
铝盐溶液与强碱反应 现象: 。 原理: |
 |
 |
 |
铝酸盐溶液与强酸反应 现象: 。 原理: |
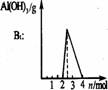 |
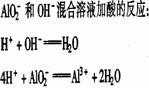 |
|
|
|
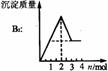 |
 |
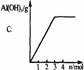 |
铝盐溶液与弱碱反应 现象: 。 原理: |
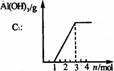 |
 |
 |
铝酸盐溶液与弱酸反应 现象: 。 原理: |
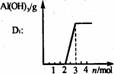 |
 |
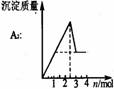
[例3]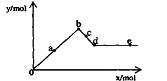 (2006年上海)已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
( )
(2006年上海)已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
( )
A.a-b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:AlO2–比Ba2+多
C.a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH–
[解析]采用定量法分析。假设有1molA12(SO4)3则溶液中含有2molA13+、3molSO42–。向溶液中逐滴加入Ba(OH)2溶液时发生的反应为:Al3++3OH- Al(OH)3↓、SO42–+Ba2+
Al(OH)3↓、SO42–+Ba2+
BaSO4↓。则当2molA13+完全沉淀时,消耗Ba(OH)23mol,此时3molSO42–全部沉淀;生成沉淀为2molAl(OH)3和3molBaSO4共5mol,因此,在整个反应过程中BaSO4的物质的量始终大于Al(OH)3的物质的量;再加入Ba(OH)2溶液时发生Al(OH)3+OH-=[Al(OH)4] -,沉淀的量将逐渐减少,因此b点是沉淀的最大值,b-d中Al(OH)3沉淀逐渐溶解转化为Ba(AlO2)2,由于AlO2-微弱水解,因此再b-d中AlO2-的物质的量大于Ba2+;d点时Al(OH)3沉淀恰好完全溶解,此时溶液中只存在Ba(AlO2)2,因此随Ba(OH)2的加入在某一点,当d-e中加入的Ba(OH)2的物质的量等于Ba(AlO2)2的物质的量时,溶液中Ba2+与OH-的量相等。
[答案]BD
[规律总结]析图或作图时不仅要注意加入酸或碱的强弱,而且要注意所加入的量或滴加顺序,正因滴加顺序不同可产生的现象不同。若产生沉淀有多种,则应细细分析相关量间的关系。要持别关注沉淀是否同步完全,沉淀物是否溶于所加入的过量试剂中,同时要注意纵生标的物理量意义。对于一些复杂问题可先分解后组合,进行图像的叠加工作。抓住一些关键点(如最高点,最低点,转折点)和变化趋势,才能较顺利地解决图像问题。
3.Al(OH)3的制取
①铝盐与碱反应:实验室制取氢氧化铝时采用过量的氨水,而不用强碱与可溶性铝盐溶液反应是因为 。
②四羟基合铝酸盐与酸反应:一般用向偏铝酸盐溶液中通入CO2的方法制取Al(OH)3。
当CO2不足或适量时: ;(填离子反应方程式,下同)CO2过量时: 。
|
[特别提醒]:(1)制取Al(OH)3也可用铝盐与强碱作用,但应严格控制加入碱的量,因为强碱过量会使制得的Al(OH)3转化为四羟基合铝酸盐:Al(OH)3+OH-=[Al(OH)4]-。 (2)一般不用强酸,因为强酸的量控制不当会使制得的Al(OH)3溶解:[Al(OH)4] -+H+=Al(OH)3↓+H2O;Al(OH)3+3H+=Al3++3H2O。 |
2.化学性质
①与酸反应:Al(OH)3 +3HCl=AlCl3+3H2O(离子反应方程式: )
②与碱反应:Al(OH)3+NaOH=Na[Al(OH)4](离子反应方程式: )
1.物理性质:Al(OH)3是几乎不溶于水的 ,具有 性。
0.1mol 0.1mol 0.05mol 0.1mol 0.15mol
若铝箔足量,共生成H2:0.05mol+0.15mol=0.2mol
V(H2)=0.2mol×22.4mol/L=4.48L。
[答案]C
[规律总结]铝和强碱溶液反应,不是铝直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
考点2 氢氧化铝
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com