
2.勒沙特列原理
如果改变平衡的一个条件(如浓度、温度、压强等),平衡就会向 的方向移动。
[例2] (08天津卷)对平衡CO2(g) CO2(aq);△H= -19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
CO2(aq);△H= -19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
A.升温增压 B.降温减压 C.升温减压 D.降温增压
[解析] 增大二氧化碳气体在水中的溶解度,即使平衡向正向移动,而正向为一气体体积减少同时放热,因此可以降低温度,同时还可增大压强。
[答案]D。
特别提醒:改变固体或纯液体的量.化学平衡不移动;恒温、恒容时,通入稀有气体,化学平衡不移动;恒温、恒压时,通入稀有气体,化学平衡向着气体分子数增大的方向移动;加入一种反应物后另一种反应物的转化率会增大,其本身的转化率反而减小;对于等体积反应,改变体系压强对化学平衡无影响。
考点3化学平衡图象
解平衡图象要注意识图方法,总的来说有以下几点:
一看面(即横坐标和纵坐标);
二看线(即看线的走向、变化的趋势);
三看点(看线是否通过原点,两条线的交点及线的拐点)(重点理解);
四看辅(要不要作辅助线,如等温线、等压线);
五看数 (定量图像中有关数值的多少大小)。
[例3](08全国Ⅰ卷)已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H=-1025kJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
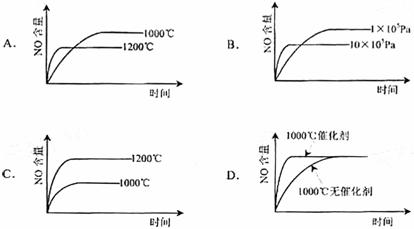
[解析]根据“先拐先平数值大”的原则,选项A、B正确;根据升高温度,平衡向吸热反应方向移动(即逆反应方向移动),可确定A、B正确;根据使用催化剂只能改变化学反应速率,缩短达到平衡的时间,但对化学平衡的移动无影响,所以选项D正确。
[答案]C
[方法技巧]化学平衡经常会以图像来考查,不仅要掌握影响化学平衡的因素及勒沙特列原理,同时还要掌握识图的方法和一些规律,如“先拐先平数值大”和“定一议二”等原则。
考点4等效平衡规律
1.影响化学平衡的条件
主要有 和间接条件等。
要注意的是:使用催化剂可以改变反应速率但是不能使化学平衡移动。因为催化剂能同等程度的改变正、逆反应的反应速率,始终有v(正)=v(逆),故不会影响化学平衡移动,但可以大大提高反应速率,缩短达到平衡的时间,从而提高生成物的产率。
3.化学平衡状态的判定
|
例 举 反 应 |
m
A(g) + n B(g)  p C(g) + q D(g) p C(g) + q D(g) |
|
|
混合物体系中各成分的含量 |
各物质的
物质的量或各物质的质量分数一定 |
平衡 |
|
各物质的质量或物质的质量分数一定 |
平衡 |
|
|
各气体的体积或体积分数一定 |
平衡 |
|
|
总体积、总压强、总物质的量一定 |
不一定平衡 |
|
|
正、逆反应速率相等 |
在单位时间内消耗了m mol A,同时也生成了m mol A,即v(正)=v(逆) |
平衡 |
|
在单位时间内消耗了n mol B,同时也消耗了p mol C,即v(正)=v(逆) |
平衡 |
|
|
v(A): v(B): v(C):
v(D)=m:n:p:q,v(正)不一定等于v(逆) |
不一定平衡 |
|
|
在单位时间内生成了n mol B,同时也消耗了p mol C,因均指v(逆) |
不一定平衡 |
|
|
压强 |
m + n ≠ p + q 时,总压强一定(其他条件一定) |
平衡 |
|
m + n = p + q 时,总压强一定(其他条件一定) |
不一定平衡 |
|
|
混合气体的平均相对分子质量M r |
M r一定时,且m + n ≠ p + q时(非气体的不算) |
平衡 |
|
M r一定时,且m + n = p + q时(非气体的不算) |
不一定平衡 |
|
|
温度 |
任何化学反应都伴有能量的变化,当体系温度一定时(其他不变) |
平衡 |
|
气体的密度 |
密度一定 |
不一定平衡 |
|
颜色 |
反应体系内有色物质的颜色稳定不变 |
平衡 |
注意:“同边异,异边同”原理(平衡的判断方法之一)
同一边的物质(都是反应物或者都是生成物)一个“消耗”一定量,同时另一个“生成”一定量才可以说明是达到了平衡;而两个不同一边的物质(一个是反应物而另一个是生成物)都“同时消耗”一定量或者“同时生成”一定量也可以表示达到了平衡。
[例1]对可逆反应A2(g)+B2(g) 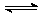 2AB(g) 在一定条件下,达到平衡状态的标志是( )
2AB(g) 在一定条件下,达到平衡状态的标志是( )
A、平衡时容器内各物质的物质的量比为1∶1∶2
B、平衡时容器内的总压强不随时间而变化
C、单位时间内生成2n mol AB的同时,生成n mol的B2
D、单位时间内,生成n mol A2的同时,生成n mol的B2
[解析] 平衡时容器内各物质的物质的量之比是没有规律的,只是各物质的物质的量浓度保持不变是一般规律,A错;对于反应前后气体不变的反应,容器内的总压强不随时间的变化而改变,无论是否平衡!B不能选择;对于C,D 类型需要了解六个字的“同边异,异边同”原理,对于D,如果反应向左进行,单位时间内,本来就是生成n mol A2的同时,一定生成了n mol的B2;对于C,表示反应向左进行的同时也在向右进行,而且程度相同!所以是正确的。
[答案]C
[方法技巧]“同边异,异边同”原理是一个很实用的原理,在学习中要灵活利用!
考点2化学平衡的影响因素及勒沙特列原理
2. 化学平衡的特征:
(1)化学平衡研究的对象是可逆反应;(逆)
(2)达到平衡时正反应速率等于逆反应速率;(等)
(3)达到平衡时反应混合物中各组分的浓度 ;(定)
(4)由于化学平衡状态时反应仍在进行,故其是一种 ; (动)
(5)条件改变平衡会发生移动.(变)
1. 定义:是指在一定条件下的 里,正反应和逆反应的 相等,反应体系中所有参加反应的物质的质量或浓度可以 的状态。
3.记忆规律:
⊙升高温度天经地义要加快反应速率。
⊙催化剂能 改变(不强调是增大)正逆反应速率。
⊙压强对速率的影响是通过改变浓度而实现的,只适用于 的化学反应。
[例2] (08上海卷)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
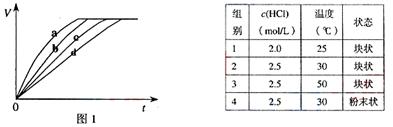
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
[解析] 化学反应速率与温度、浓度和固体物质的表面积的大小有关,实验1的盐酸的浓度最小,反应的温度最低,所以化学反应速率最慢;由于实验3的反应温度比实验2的反应温度高,所以反应速率实验3大于实验2;而实验4和实验3虽然浓度相同,但反应的温度不同,物质的状态也不相同,所以不能比较。
[答案]A、C
[规律总结] 考查了反应速率的影响条件和比较规律和方法。
考点3化学反应速率的有关计算及图象
计算反应速率有三大类型
题型Ⅰ:根据化学计量数之比,计算反应速率(见例3)
题型Ⅱ:以图象形式给出条件,计算反应速率(见能力提高训练18)
题型Ⅲ:根据已知的浓度、温度等条件,比较反应速率的大小(见基础提升训练14)
[特别提醒]:根据系数比规律可以直接用各个物质的反应速率数据除以系数来快速判断化学反应速率的最大和最小。(体会例题3和限时基础训练卷1和5)
[例3] 反应N2O4(g)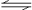 2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
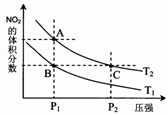 A.A、C两点的反应速率:A>C
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
[解析]AC两点温度相同而压强不同,增压平衡逆向移动NO2的体积分数减小,但增压也即会增大浓度,反应速率:A<C,颜色还是C深(浓度大),由于平衡逆向移动,气体分子数减少,根据M=m/n; 气体的平均相对分子质量A<C;故ABC均错。.
2.条件因素(外因):
|
改变条件 |
单位体积内分子总数·活化分子分数=活化分子数 |
有效碰撞次数 |
化学反应速率 |
||
|
增大浓度 |
增多 |
不变 |
增多 |
增 多 |
加快 |
|
增大压强 |
增多 |
不变 |
增多 |
增 多 |
加快 |
|
升高温度 |
不变 |
增大 |
增多 |
增 多 |
加快 |
|
使用催化剂 |
不变 |
增大 |
增多 |
增 多 |
加快 |
其中催化剂对化学反应速率的影响较大,其次是温度
1. 决定因素(内因): 。
2.系数比规律 在同一反应中,用不同物质来表示的反应速率时,其比值一定等于化学反应方程式中的
。即对于化学反应mA(g)
+ nB(g)  pC(g) + qD(g)
的:v(A)∶v(B)∶v(C)∶v(D) = m∶n∶p∶q
pC(g) + qD(g)
的:v(A)∶v(B)∶v(C)∶v(D) = m∶n∶p∶q
[例1] 已知:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g),若反应速率分别用
4NO(g)+6H2O(g),若反应速率分别用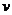 (NH3)、
(NH3)、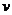 (O2)、
(O2)、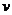 (NO)、
(NO)、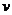 (H2O)[mol/(L·min)]表示则下列关系正确的是( )
(H2O)[mol/(L·min)]表示则下列关系正确的是( )
A.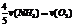 B.
B.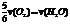 C.
C.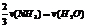 D.
D.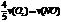
[解析] 系数比规律是指用各个物质所表示的反应速率之比等于反应式中各个物质的系数之比!可以延伸出一些其他比法
[答案] D
[规律总结] 考查了系数比规律的基本定义。
考点2影响化学反应速率的因素:
1.通过计算式: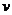 =
来理解其概念:
=
来理解其概念:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com