
3.强酸和强碱混和,先确定过量离子的浓度:
若H+过量 c(H+)=(c(H+)酸V酸-c(OH_)碱V碱)/(V酸+V碱)
若碱过量 c(OH-)=(c(OH-)碱V碱 -c(H+)酸V酸)/(V碱+V酸)
当酸过量时,必须以剩余的氢离子浓度来计算溶液的 PH 值;当碱过量时,必须以剩余的氢氧根离子浓度来计算溶液的POH值,再求pH值。
2.两种强碱溶液混和,先求c(OH-),再通过 求c(H+),最后求pH值.
C(OH-)=
两种强碱溶液等体积混和,且原溶液pH值相差≥2时,把稀溶液(pH值较小的)当作水来处理,混和液的pH=大pH-0.3。
1. 两种强酸溶液混和,先求c(H+),再求pH。
C(H+)=
两种强酸溶液等体积混和,且原溶液pH值相差≥2时,把稀溶液(pH较大的)当作水来处理,混和液的pH值=小pH+0.3。
2. 溶液的pH值:氢离子浓度的负对数。pH= ;同理pOH=
|
[特别提醒]:在标准温度(25℃)和压力下,pH=7的水溶液(如:纯水)为中性,水的离子积常数为1×10-14,且c(H+)和c(OH-)都是1×10-7mol/L。pH愈小,溶液的酸性愈强;pH愈大,溶液的碱性也就愈强。 通常pH是一个介于0和14之间的数,当pH<7的时候,溶液呈酸性,当pH>7的时候,溶液呈碱性,当pH=7的时候,溶液呈中性.但在非水溶液或非标准温度和压力的条件下,pH=7可能并不代表溶液呈中性,这需要通过计算该溶剂在这种条件下的电离常数来决定pH为中性的值。如373K(100℃)的温度下,pH=6为中性溶液。 |
[例2] (1)某温度下,某溶液的pH=7,该溶液一定是中性溶液吗?
(2)某温度下纯水的c(H+)==2.0×10-7mol/L。在此温度下,某溶液中由水电离出的c(H+)为4.0×10-13mol/L,则该溶液的pH值可能是________。
[解析]在该温度下,kw= c(H+)·c(OH-)=2.0×10-7×2.0×10-7=4.0×10-14。
c(H+)=4.0×10-13mol/L,则溶液可能呈酸性或碱性。若酸性溶液,溶液中的c(H+)=4.0×10-14/4.0×10-13=1.0×10-1mol/L。所以溶液的pH值=-lg c(H+)=-lg(1×10-1)=1;若碱性溶液,则溶液的pH值=-lg c(H+)=-lg4.0×10-13=13-lg4=12.4。
[答案](1)不一定 (2)该溶液的pH值可能为1或12.4。
[规律总结](1)在25℃时是中性溶液,低于25℃时是弱酸性溶液,高于25℃时是弱碱性溶液。(2)本题的情境转换成非理想状况,主要考查考生灵活应变的能力。
考点3 pH值计算的基本规律
1. 溶液酸性、中性或碱性的判断依据是:看 和 的相对大小.
在任意温度的溶液中:若c(H+)>c(OH-)
c(H+)=c(OH-)
c(OH-)>c(H+)
3.影响水的电离度大小的因素:
(1)温度的影响规律:升高温度,水的电离度 .
(2)浓度的影响规律:
①加入酸, c(H+)增大,水的电离平衡向 移动,水的电离度 。
②加入碱, c(OH-)增大,水的电离平衡向 移动,水的电离度。
③加入因水解而使溶液呈酸性或呈碱性的盐,使水的电离度 。
④加入因电离而使溶液呈酸性的酸式盐, 如:NaHSO4、NaHSO3和NaH2PO4等,相当于加入酸的作用,使水的电离度 。
|
[特别提醒]:水的离子积不仅适用于纯水,还适用于稀的电解质溶液。 |
[例1]向纯水中加入少量的KHSO4固体(温度不变),则溶液的( ) A、pH值升高 B、[H+]和[OH-]的乘积增大 C、酸性增强 D、OH-离子浓度减小
考点2 溶液的酸碱性和pH值
2.水的电离度
对于水 c(H2O)=(1000g/L)/(18g/mol) = 55.56mol/L(常数).
常温时 α水=10-7/55.6=1.8×10-9=1.8×10-7%
所以水是 的电解质.比水还难电离的物质通常看作是非电解质.
1.水的电离平衡和电离平衡常数
H2O + H2O H3O+ + OH- ΔH>0 或者 H2O
H3O+ + OH- ΔH>0 或者 H2O
 H+ + OH-
ΔH>0
H+ + OH-
ΔH>0
①25℃时:KW= =10-14mol·L-1
②Kw随温度升高而
2.在 下,改变起始时加入物质的物质的量,只要按化学计量数换算成同一半边的物质的物质的量之比与原平衡相同,则达到平衡后与原平衡等效。
[例4](2007 四川13)
向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O (g)
 CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
A.0.5molCO+2molH2O(g)+1molCO2+1molH2
B.1molCO+1molH2O(g)+1molCO2+1molH2 .
C.0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D.0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2
[解析] 题中反应前后气体的体积不变,因此在恒温和恒容条件下是等效平衡的条件是CO和H2O (g)的物质的量之比与起始时加入的CO和H2O (g)的物质的量之比相等即可。因此只要将各个选项中的投料转化为CO和H2O (g)的物质的量,并与原平衡进行对比即可。
对于A选项中的配料相当于CO有1.5mol、H2O (g)有3mol,即二者之比为1︰2,所以此情况下的平衡与原平衡等效,即CO的体积分数仍为x;
对于B选项中的配料相当于CO有2mol、H2O (g)有2mol,相对于原平衡可以认为是在原平衡的基础上又加入了1molCO,相当于平衡向右移动,但是CO的体积分数增大,即大于x;
对于C选项中的配料相当于CO有0.9mol、H2O (g)有1.9mol,此投料相当于在0.9molCO和1.8molH2O (g)的平衡体系中再加入0.1molH2O (g),而0.9molCO和1.8molH2O (g)的平衡与原平衡是等效平衡,再加入0.1molH2O (g)时平衡向右移动,CO的体积分数减小,即小于x;
对于D选项中的配料相当于CO有1mol、H2O (g)有2mol,此平衡与平衡相同,所以CO的体积分数也为x。因此达到平衡时CO的体积分数大于x的只有B选项。
[答案]B
[规律总结]定温、定容时:①、对于一般的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。
②、对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量的比例与原平衡相同,两平衡等效。
考点5 化学平衡计算和化学平衡常数
(1)“起”、“转”、“平”三步骤计算的技巧(一般表示如下:)(例题见[真题1])
mA(g)+nB(g)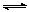 pC(g)+qD(g)
pC(g)+qD(g)
“起”始浓度: a b c d
“转”化浓度: mx nx px qx
“平”衡浓度: a-mx b-nx c+px d+qx
此三种浓度中,只有“转”化浓度之比等于计量数之比,常常要用平衡时候的数据求其他的值:
(1)如求A物质的平衡转化率α(A) α(A)=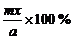
(2) 在恒温、等容的条件下,反应前后的压强比等于物质的量比。
(3) 求B物质平衡时的体积分数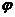 (B),
(B),
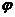 (B)=
(B)=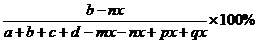
(2)化学平衡常数的计算和判断
一定温度下,对于可逆反应,mA(g)+nB(g) pC(g)+qDg) K=
pC(g)+qDg) K=
了解:●平衡常数K只与 有关;温度一定K一定
●平衡常数K的大小可以表示反应进行的程度;
●平衡常数K表达式中均为物质的量浓度,反应式不同K 。
[例5](08海南卷)X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.65%
[解析]由可知: X+2Y 2Z
2Z
起始: 1 1 0
转化: a 2a 2a
平衡: 1-a 1-2a 2a
根据题意有: = ,a=,Y的转化率最接近65%。
1.在定温(T)、定容(V)条件下的等效平衡
① 在定T、V条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量 ,则两平衡等效。
②在定T、V条件下,对于反应前后气体分子数不改变的可逆反应只改变起始时加入物质的物质的量,只要反应物(或生成物)的物质的量的比值 ,则两平衡等效。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com