
在水溶液中,Ag+和Cl-作用产生白色的AgCl沉淀,但固态的AgCl并非绝对不溶于水,它仍能微量地溶解成为Ag+和Cl-。在一定条件下,当 与 的速率相等时,便达到固体难溶电解质与溶液中离子间的平衡,AgCl沉淀与溶液中的Ag+和Cl-之间的平衡表示为
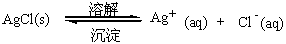
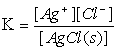
平衡时, 即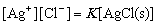
由于[AgCl(s)]是常数,可并入常数项,得Ksp =[Ag+][Cl-]
Ksp称为溶度积常数,简称溶度积。它反映了难溶电解质在水中的
。对于AaBb型的难溶电解质AaBb (s)  aAn+?+ bBm-?
Ksp=[An+]a[Bm-]b
aAn+?+ bBm-?
Ksp=[An+]a[Bm-]b
上式表明:在一定温度下,难溶电解质的饱和溶液中离子 之乘积为一常数。
加入 与溶液中的某些离子生成沉淀,达到分离或除去某些离子的目的。反应中,离子趋向于生成 的物质。 (2)沉淀的溶解 根据平衡移动原理,减少溶解平衡体系中的某种离子,会使平衡向沉淀向 方向移动,沉淀逐渐 。例: Mg(OH)2(s)≒ Mg2+(aq) + OH-(aq)
OH- + H+  H2O
H2O
条件的改变 了原难溶电解质的溶解平衡。
|
[特别提醒]:解决沉淀溶解平衡的一般思路:“看到”粒子--“找到”平衡--“想到”移动 |
[例1]己知碳酸钙和氢氧化钙在水中存在下列溶解平衡Ca(OH)2(固)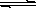 Ca2++2OH-,CaCO3(固)
Ca2++2OH-,CaCO3(固) 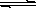 Ca2++CO32-。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2,CO2等,为了除去有害气体SO2变废为宝,常常见粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
Ca2++CO32-。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2,CO2等,为了除去有害气体SO2变废为宝,常常见粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
(1)写山上述两个反应的化学方程式:
①S02与CaCO3悬浊液反应
②S02与Ca(OH)2悬浊液反应
(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由
[答案](1)①2SO2+O2+2CaCO3+4H2O=2(CaSO4·H2O)+2CO2
或 2SO2+O2+2CaCO3+4H2O=2(CaSO4·H2O)+2CO2
②2SO2+O2+2Ca(OH)2+2H2O=2(CaSO4·2H2O)或2SO2+O2+2Ca(OH)2=2CaSO4+2H2O
(2) Ca(OH)2微溶于水,石灰水中Ca(OH)2浓度小,不利于吸收SO2
[规律总结]根据二氧化硫的还原性和其水溶液的酸性强弱,再结合化学平衡和溶解平衡知识,即可解题。
考点2 有关溶度积的计算
(1)等: (2)动:
(3)定:达到平衡时,溶液中
(4)变:当外界条件改变,溶解平衡将
例:NaCl(s) Na+(aq)+Cl-(aq)
AgCl(s)
Na+(aq)+Cl-(aq)
AgCl(s) Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
10.明矾能够用来净水的原理
|
[特别提醒]:盐类水解的应用都是从水解的本质出发的。会解三类习题:(1)比较大小型,例:比较PH值大小;比较离子数目大小等。(2)实验操作型,例:易水解物质的制取;中和滴定中指示剂选定等。(3)反应推理型,例:判断金属与盐溶液的反应产物;判断盐溶液蒸干时的条件;判断离子方程式的正误;判断离子能否共存等。 |
[例3]蒸干FeCl3水溶液后再强热,得到的固体物质主要是 ( )
A. FeCl3 B. FeCl3·6H2O C. Fe(OH)3 D. Fe2O3
[解析] FeCl3水中发生水解:FeCl3+3H2O  Fe(OH)3 + 3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
Fe(OH)3 + 3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
[答案]D
[规律总结] 易挥发性酸所生成的盐在加热蒸干时水解趋于完全不能得到其晶体。例如:AlCl3、FeCl3;
而高沸点酸所生成的盐,加热蒸干时可以得到相应的晶体,例:CuSO4、NaAlO2。
9.用盐溶液来代替酸碱
8.溶液中,某些离子的除杂,需考虑盐的水解。
7.某些试剂的实验室存放,需要考虑盐的水解。
如:Na2CO3、Na2SiO3等水解呈碱性,不能存放在 的试剂瓶中;NH4F不能存放在玻璃瓶中,应NH4F水解应会产生HF,腐蚀玻璃 。
6.化肥的合理使用,有时需考虑盐的水解。
如:铵态氮肥和草木灰不能混合施用;磷酸二氢钙和草木灰不能混合施用。因草木灰(有效成分K2CO3)水解呈 。
5.选择制备盐的途径时,需考虑盐的水解。如制备Al2S3时,因无法在溶液中制取(会完全水解),只能由干法直接反应制取。
加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入 气体,以抑制AlCl3、MgCl2、FeCl3的水解,才能得到其固体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com