
3.物理性质:乙烯是__色__气味的气体;__溶于水;密度较空气__,在标准状况下的密度为1.25g/L。
2.分子结构特点
乙烯的分子式: 结构简式: 结构式: 乙烯的含碳量比甲烷 ,乙烯分子含有 。碳碳双键的键长比单键的键长要 些。分子中所有的原子都在 。
分子中含有碳碳双键的烃类的烃叫烯烃。乙烯是重要的化工原料,也是一种重要的植物生长调节剂。从石油中获得乙烯是生产乙烯的主要途径,乙烯的产量可以用来衡量一个国家的石油化工水平。
1.乙烯的制取
(1)石蜡油分解实验。实验现象:①生成的气体通入酸性高锰酸钾溶液中(和甲烷对比) ; ②生成的气体通入溴的四氯化碳溶液中 ;③用排水集气法收集到一试管气体,点燃后现象是 。研究表明,石蜡油分解的产物主要是 和 的混合物。
(2) 乙醇与浓硫酸共热(170 °C)制乙烯: 。
2.同分异构体的书写方法与判断
化合物具有相同的分子式,但具有不同结构的现象,叫做同分异构现象。如正丁烷和异丁烷。具有同分现象的化合物互称为同分异构体。
(1)同分异构体的种类:①碳架异构(指碳原子之间连接成不同的链状或环状结构而造成的异构);②位置异构(指官能团或取代基在碳架上的位置不同而造成的异构);③类别异构(指有机物分子中的官能团不同或有机物类别不同而造成的异构,也叫官能团异构)。
(2)同分异构体的书写方法:①判 :据有机物的分子组成判定其可能的类别异构(一般用通式判断)。②写 :据有机物的类别异构写出各类异构的可能的碳链异构。一般采用“减链法”,可概括为:写直链,一线串;取代基,挂中间;一边排,不到端;多碳时,整到散。③移 :一般是先写出不带官能团的烃的同分异构体,然后在各条碳链上依次移动官能团的位置,有两个或两个以上的官能团时,先上一个官能团,依次上第二个官能团,依次类推。④氢 :按“碳四键”的原理,碳原子剩余的价键用氢原子去饱和,就可得所有同分异构体的结构简式。
(3)同分异构体的判断依据:①分子式必须 。相对分子质量相同,结构不同的化合物不一定是同分异构体,如C8H18和C7H14O。②结构 。碳链骨架不同,或官能团在碳链上的位置不同,或官能团种类不同。
1.同系物及其判定
(1)同系物的定义:结构相似,在分子组成上相差一个或若干个“CH2”原子团的有机物称为同系物。
(2)判定依据:①分子组成符合同一 ,但彼此有若干个系差(CH2);②主碳链(或碳环)结构 (与环的大小无关);③所含官能团的种类和个数 ;④有机物所属类别 。
(3)同系物通式的归纳和应用:总结一系列具有相似结构的同系物的通式,应采用数学分析法。首先找出不同物质的分子式,确定系差,再根据起始碳数即可确定通式。然后利用通式和数学极限知识即可求同系物中碳的最大含量。
(1)烷烃:碳原子间以单键结合成链状,碳原子剩余价键全部跟氢原子结合的烃称为烷烃(也叫饱和链烃)
(2)烷烃的通式:
(3)烷烃物理通性:①状态:C1-C4的烷烃常温为气态,C5-C11液态,C数>11为固态②熔沸点:C原子数越多,熔沸点越高。C原子数相同时,支键越多,熔沸点越低。③水溶性:不溶于水,易溶于有机溶剂。
(4)烷烃的命名:碳原子数在10个以内,依次用“天干”(甲、乙、丙、丁、戊、已、庚、辛、壬、癸)代表碳原子数,其后加上“烷”字;碳原子数在10个以上,用汉字数字表示(如十二烷)。系统命名法的命名步骤:① --C原子个数数最多;② --支链最多的碳链,离最简单支链最近的一端编号,且支链位次之和最小;③写名称: - - 。
3.甲烷的化学性质
(1)稳定性:一般情况下,性质很稳定,跟强酸、强碱或强氧化剂等不反应。
(2)可燃性:CH4+2O2 CO2+2H2O
CO2+2H2O
(3)取代反应:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应叫取代反应。甲烷与氯气在光照条件下反应,黄绿色逐渐____,瓶壁出现____,说明产生了不溶于水的物质。瓶口有___,使湿石蕊试纸变__,推断有氯化氢生成。四个反应的方程式___________、______________、____________、____________。
2.甲烷的物理性质
甲烷是__色__味__体,比空气__,__溶于水,但溶于CCl4。
1.分子组成与结构
(1)甲烷俗名沼气(存在于池沼中)、坑气(瓦斯,煤矿的坑道中)、天然气(地壳中)。
(2)分子式:CH4;电子式: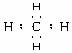 结构式:
结构式: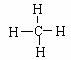 。
。
(3)甲烷空间结构的描述:甲烷是_____结构,碳原子位于_____,顶点都是_____。
2.金属腐蚀的一般规律
(1)在同一电解质溶液中, 引起的腐蚀> 引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。
(2)在不同溶液中,金属在电解质溶液中的腐蚀>金属在非电解质溶液中的腐蚀;金属在强电解质溶液中的腐蚀>金属在弱电解质溶液中的腐蚀。
(3)有保护措施的条件下,无防护条件的腐蚀>有一般防护条件下的腐蚀>牺牲阳极的阴极保护法条件下的腐蚀>外接电源的阴极保护法条件下的腐蚀。
(4)对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
(5)由于金属表面一般不会遇到酸性较强的溶液,故吸氧腐蚀是金属腐蚀的主要形式,只有在金属活动性顺序表中排在氢以前的金属才可能发生析氢腐蚀,而位于氢之后的金属腐蚀时只能是吸氧腐蚀。
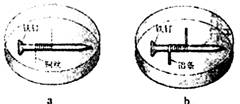 [例2] (08重庆卷)如题图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
[例2] (08重庆卷)如题图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
A.a中铁钉附近呈现红色
B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应
D.b中铝条附近有气泡产生
[解析] 本题主要考查钢铁腐蚀的基本原理a、b均能形成原电池,其中a中Fe作负极:Fe-2e-=Fe2+,发生氧化反应,Cu作正极发生还原反应,铜丝附近呈现红色;B中Al作负极:Al+3e- ===Al3+,发生氧化反应,而Fe作正极:发生还原反应。
[答案]B。
考点3了解金属的防护
金属的防护目的:防止金属被氧化
金属防护的依据:依据金属腐蚀发生的化学原理和腐蚀的类型来确定防护方法
金属腐蚀的防护方法
(1)改变金属 (如把钢中加Cr、Ni制成不锈钢)
(2)在金属表面
以钢铁的防护为例,根据保护层成分的不同,可分为如下几种:
①在钢铁表面涂矿物性油脂、油漆或覆盖搪瓷、塑料等物质;
②用电镀、热镀、喷镀的方法,在钢铁表面镀上一层不易被腐蚀的金属;
③用化学方法使钢铁表面生成一层致密而稳定的氧化膜。(表面钝化)
(3)电化学保护法
① 的阴极保护法(把被保护的设备与外接电源的负极相连)
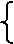 阴极:被保护金属,与电源负极相连
阴极:被保护金属,与电源负极相连
电解装置
阳极:惰性电极,与电源正极相连
② 的阴极保护法(被保护的设备与活泼的金属相连接)
 正极(阴极):被保护金属
正极(阴极):被保护金属
原电池装置
负极(阳极):活泼金属(比被保护金属活泼)
[例3] 下列事实不能用电化学理论解释的是 ( )
A.轮船水线以下的船壳上镶嵌有一定量的锌块
B.镀锌的铁制品比镀锡的铁制品耐用
C.铝片不需要用特殊方法保存
D.锌跟稀硫酸反应时,滴加少量硫酸铜溶液后,反应速率加快
[解析]金属的腐蚀分三种情况,一是直接的化学腐蚀,即金属直接与其他物质反应而腐蚀;二是电化学腐蚀,即能形成原电池的化学腐蚀;三是电解时作阳极的金属的腐蚀。常见的为前二种情况。A项是牺牲锌块保护铁的防腐措施。B项中镀锌铁若镀层破损后,则锌为负极,铁为正极,保护了铁镀锡的铁镀层破损后,铁为负极铁被腐蚀,锡为正极被保护。D项中Zn与CuSO4溶液反应置换出Cu,形成Cu-Zn原电池,比直接的化学反应快。
[答案] C
[方法技巧]:从形成原电池的基本条件去分析。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com