
24、(1) Fe 、 C 、 Al 、 Si
(2)E H2 、F___CO2__
(3) 2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2 、
Si + 2NaOH + H2O = Na2SiO3 + 2H2
(4) AlO2- + H+ + H2O = Al(OH)3 ↓ 、
SiO32- + 2H+ = H2SiO3↓
23、[实验方案]
(1) 盐酸溶液 、 氢氧化钠溶液
(2) Cu2O
(3) N2
[实验结论]
(1) Cu(OH)2既能溶解于强酸,又能溶解于强碱
(2) 高温下,+1价铜比+2价铜稳定 、
酸性溶液中,+2价铜比+1价铜稳定
[问题讨论]
取样,加入稀硫酸,如果得到蓝色溶液和红色固体,说明有A;
如果不溶解,说明无A。
22、(1) B、C、D
(2) (CH3)3Ga + AsH3 ===== GaAs + 3CH4
三角锥 、 sp2
(3) 1s22s22p63s23p63d104s24p1
(4) NH3分子间存在氢键,分子间作用力大于AsH3,熔点高于AsH3
21、 Na 、 Ar 、 HClO4 、 Al(OH)3
Al(OH)3 + 3H+ = Al3+ + 3H2O 、 Al(OH)3 + OH- = AlO2- + H2O
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
B |
C |
A |
B |
D |
C |
D |
D |
B |
A |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
B |
D |
C |
D |
A |
C |
B |
C |
A |
D |
24、合金A由4种单质组成,经过一系列反应分别进入了沉淀或气体中.
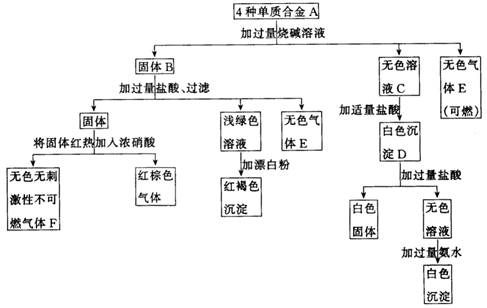
(1)合金A由哪4种元素的单质组成?_________、________、________、_________.
(2)写出E、F的化学式:E_________、F_________.
(3)写出合金A中的有关组成与过量烧碱溶液反应生成无色气体E的化学反应方程式:_______________________、
(4)写出向无色溶液C加适量盐酸生成白色沉淀D有关反应的离子方程式:
____________________________、
长春外国语学校
2010~2011学年第一学期高三第一次月考化学试题答题纸
出题人:周艳杰 审题人:温明洁
(卷面满分100分,答题时间90分钟)
可能用到的相对原子质量:C-12 H-1 O-16 Na-23 Mg-24
Al-27 Fe-56 Cu-64
23、某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物性质。过程如下:
[提出问题]
① 在周期表中,Cu、Al位置接近。Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
② 通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③ CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
[实验方案]
(1)解决问题①需用到的药品有CuSO4溶液、 、 (填试剂名称),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98 g Cu(OH)2固体,加热至
80 ℃-100 ℃时,得到黑色固体粉末,继续加热到1000 ℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,A的化学式为 。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
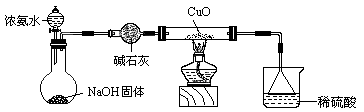
实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染的
气体。该气体的化学式为 。
[实验结论]
(1)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是
。
(2)根据实验方案(2),得出的+1价Cu和+2价Cu稳定性大小的结论是高温时 ;在酸性溶液中 。
(3)CuO能够被NH3还原。
[问题讨论]
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A?
22、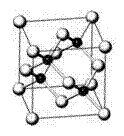 (12分)砷化镓属于第三代半导体,它能直接
(12分)砷化镓属于第三代半导体,它能直接
将电能转变为光能,砷化镓灯泡寿命是普通灯
泡的100倍。已知砷化镓的晶胞结构如右图。
试回答下列问题:
(1)下列说法正确的是 (多选,选填序号)。
A.砷化镓晶胞结构与NaCl相同
B.第一电离能:As>Ga C.电负性:As>Ga
D.半导体GaP、SiC与砷化镓为等电子体
(2)砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到, 该反应在700℃
进行,反应的方程式为: 。AsH3空间形状
为 (CH3)3Ga中镓原子杂化方式为: 。
(3)Ga的核外电子排布式为: 。
(4)AsH3沸点比NH3低,其原因是: 。
21、(12分)在第三周期中,置换氢能力最强的元素的符号为 ,化学性质最稳定的元素的符号是 ,最高价氧化物的水化物酸性最强的化学式为 ,显两性的氢氧化物的化学式为 ,该两性氢氧化物与盐酸和烧碱反应的离子方程式分别为 、 。
20、将22.4g铁粉完全溶解于某浓度的硝酸中,如反应过程中只收集到0.3molNO2和0.2molNO,下列说法正确的是
A、反应后生成的盐只有Fe(NO3)2
B、反应后生成的盐只有Fe(NO3)3
C、反应后生成的盐为Fe(NO3)2和Fe(NO3)3的混合物,且其物质的量的比
为1:3
D、反应后生成的盐为Fe(NO3)2和Fe(NO3)3的混合物,且其物质的量的比
为3:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com