
学生读注释①,了解作者及课文,教师补充。
本文是王安石34岁时在任舒州通判时写的一篇游记,借游生议,说明要成就一番事业,除了要有一定的物质条件外,更需要有坚定的志向和顽强的毅力,并提出治学必须采取“深思而慎取”的态度。
嘉祐六年(1061)上万言书,提出变法主张,要求抑制大官僚地主和豪商的特权,改变积弱贫穷的局面,推行富国强兵政策。
神宗熙宁二年(1069)任参知政事,次年(1070)任宰相。在神宗支持下,制定并推行农田水利、青苗、均输、保甲、免役、市易等新法,使国力有所加强。支持王韶取得熙和等州,改善对西夏的作战形势。王安石拜相,他不顾保守派的反对,积极推行新法。传有“天变不足畏,祖宗不足法,人言不足恤”的观点,这跟本文“尽吾志也而不能至,可以无悔矣”的观点是一致的。因遭到反变法派的猛烈攻击,于熙宁七年(1074)罢相,次年(1075)再为相。熙宁九年(1076)再次辞去相位,退居江宁(现在江苏南京),潜心学术研究和诗文创作(王安石的词教辅《菩萨蛮》)。封舒国公,又改封荆国公,故世称“荆公”。
元祐元年(1086)司马光执政,废尽新法,王安石忧愤去世。卒谥文,故又称“王文公”。
王安石在文学上也是个革新派。他是欧阳修倡导的北宋诗文革新运动的积极参加者,反对北宋初年浮靡的文风,主张文章“务为有补于世”。他的诗文多为揭露时弊,反映社会矛盾之作,体现了他的政治主张和抱负。他的散文雄健峭拔,在唐宋八大家中独树一帜,诗歌遒劲清新,词虽不多而风格高峻。他的作品今存《临川集》、《临川集拾遗》等。
(了解作者的这些生平事迹,更能深刻地理解这篇游记体散文所蕴含的深意)
在初中我们学过用文言文写作的游记有《小石潭记》、《醉翁亭记》等,这些游记共同的侧重点是什么呢?
那就是抓住景物的特点,浓笔重彩、精描细绘,表现山水之美。
我们今天学习王安石的《游褒禅山记》(板书)这篇游记与我们学习过的那些游记不同,它不重在表现山水之美,而是在记游的基础上,用酣畅的笔墨进行大量的议论,记游实际上是个引子,说理才是全文的中心。学习这类游记有助于同学们提高思维的能力。为此我们共同来研究王安石的《游褒禅山记》。
83.化学电池在通讯、交通及日常生活中有着广泛的应用。
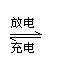 (1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O
2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正
确的是
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为
。
82.在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入 两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
 (1)阳极上的电极反应式为________________________________。
(1)阳极上的电极反应式为________________________________。
(2)阴极上的电极反应式为________________________________。
(3)原上层液体是________________________________________。
(4)原下层液体是________________________________________。
(5)搅拌后两层液体颜色发生变化的原因是__________________。
(6)要检验上层液体中含有的金属离子,其方法是_________________________________,现象是_________________________ 。
81.CX、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:① X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是 。
(2)Z2Y2与X2Y反应的化学方程式是 。
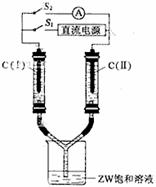 (3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶
液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶
液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。 一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是 (填写正极或负极);
C(II)的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑 可逐渐溶解,该反应的离子方程式是 。
80.B工业上用MnO2和KOH为原料制取高锰酸钾,主要生产过程分两步进行。第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液进行电解,制取KMnO4。试回答以下问题:
(1)制取K2MnO4的MnO2是这一氧化还原反应的_____________剂(填“氧化”或“还原”),连续搅拌的目的是________________________________。
(2)电解K2MnO4的浓溶液时,两极发生的电极反应式为:
阴极是_______________________, 阳极是_________________________,
电解总的反应方程式是_________________________。
79.B100.0g无水氢氧化钾溶于100.0g水。在T温度下电解该溶液,电流强度I=6.00A,电解时间10.00h。电解结束温度重新调至T,分离析出的KOH·2H2O固体后,测得剩余溶液的总质量为164.8g。已知不同温度下每100g氢氧化钾饱和溶液中氢氧化钾的质量为:
|
温度/℃ |
0 |
10 |
20 |
30 |
|
KOH/g |
49.2 |
50.8 |
52.8 |
55.8 |
(已知电子的电量为1.6×10-19c,最后结果要求三位有效数字。)
(1)被电解的水的物质的量为________mol。
(2)计算电解后剩余溶液的质量分数(写出计算过程)。
(3)温度T为________。
78.B某学生试图用电解法根据电极上析出的物质的质量来验证阿佛加德罗常数值,其实验方案的要点为:①用直流电电解氯化铜溶液,所用仪器如图:②在电流强度为I安培,通电时间为t秒种后,精确测得某电极上析出的铜的质量为m克。试回答:

(1)写出B电极上发生反应的离子方程式 G试管中淀粉KI溶液变化的现象为 ;相应的离子方程式是 。
(2)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是 。(选填下列操作步骤的编号)①称量电解前电极质量 ②刮下电解后电极上的铜并清洗 ③用蒸馏水清洗电解后电极 ④低温烘干电极后称量 ⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(3)已知电子的电量为1.6×10-19库仑。试列出阿佛加德罗常数的计算表达式:
NA
77.B按下图装置进行实验,并回答下列问题

⑴判断装置的名称:A池为___________ B池为______________
⑵锌极为__________极,电极反应式为_________________________
铜极为__________极,电极反应式为_________________________
石墨棒C1为______极,电极反应式为________________________
石墨棒C2附近发生的实验现象为_______________________________
⑶当C2极析出224mL气体(标准状态)时,锌的质量变化_________(变大、不变或变小)了_________g,CuSO4溶液的质量_________(增加、不变或减少)_________g。
76.B请你设计出一个装置,在该装置内金属铜能与稀硫酸反应生成氢气和硫酸铜,即:
Cu + H2SO4(稀) = CuSO4 + H2↑
要求:画出示意图,注明有关部件的名称,同时写出相关的反应式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com