
1、关于物体运动的速度和加速度的关系,下列说法正确的是( )
A、速度越大,加速度也越大
B、相同时间内,速度变化越大,加速度一定越大
C、加速度的方向总是和速度方向相同
D、加速度就是增加的速度
22.由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH、Mg2+、Ba2+、CO、SO。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验:
|
实验序号 |
实验内容 |
实验结果 |
|
1 |
加AgNO3溶液 |
有白色沉淀生成 |
|
2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
|
3 |
加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33
g。 |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是________(填“一定存在”“一定不存在”或“不能确定”);根据实验1-3判断原混合物中一定不存在的离子是________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
|
阴离子符号 |
物质的量浓度(mol·L-1) |
|
|
|
|
|
|
(3)试确定K+是否存在?________,判断的理由是______________________________
________________________________________________________________________
________________________________________________________________________。
答案:(1)不能确定 Ba2+、Mg2+
(2)
|
阴离子符号 |
物质的量浓度(mol·L-1) |
|
SO |
0.1 |
|
CO |
0.2 |
(3)存在 溶液中肯定存在的离子是NH、CO和SO。经计算,NH的物质的量为0.0 5 mol,CO、SO的物质的量分别为0.02 mol和0.01
mo
5 mol,CO、SO的物质的量分别为0.02 mol和0.01
mo l,根据电荷守恒,得K+一定存在
l,根据电荷守恒,得K+一定存在
21.有A、B、C、D、E、F六瓶溶液,分别是Na2CO3、BaCl2、Ca(NO3)2、KI、稀H2SO4、AgNO3溶液中的一种,各取少许溶液两两混合,实验记录结果如表。其中“↓”、“↑”、“-”符号分别表示生成沉淀(不包括微溶物)、气体和无明显现象,空格表示该实验没有做。
请回答:
(1)D和E反应生成气体的离子方程式为:_______________________________________。
(2)A、D产生的沉淀中加入稀HNO3,反应的离子方程式为:______________________
________________________________________________________________________。
(3)C、F溶液的溶质化学式分别为C________,F________。
(4)B溶液中溶质的化学式为__________,实验室中其鉴定方法是:________________________________________________________________________
________________________________________________________________________。
解析:由题中所列现象可知,只有D、E反应能产生气体,则D、E分别为Na2CO3和稀H2SO4中的一种,又根据E只能与F产生沉淀,与A、B、C无明显现象,那么E为稀H2SO4,D为Na2CO3,F为BaCl2,F还与C产生沉淀,C为AgNO3,A与D能产生沉淀,A为Ca(NO3)2,余下B为KI,所以A、B、C、D、E、F这六瓶溶液的溶质分别为:Ca(NO3)2、KI、AgNO3、Na2CO3、H2SO4、BaCl2。
答案:(1)CO+2H+===CO2↑+H2O
(2)CaCO3+2H+===Ca2++CO2↑+H2O
(3)AgNO3 BaCl2
(4)KI 焰色反应为紫色,证明含K+;往溶液中加氯水和CCl4溶液,振荡静置后下层显紫红色,证明有I-(或加氯水和淀粉溶液显蓝色)
20.(2009·全国卷Ⅱ)现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO、SO、CO。现将它们分别配成0.1 mol·L-1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是______________________________________________
(2)E溶液是________,判断依据是_____________________________________________
(3)写出下列四种化合物化学式:A________、C________、D________、F________。
解析:据题干信息有:
|
阳离子 |
K+ |
Ag+ |
Ca2+ |
Ba2+ |
 Fe2+ Fe2+ |
Al3+ |
|
阴离子 |
Cl- |
OH- |
CH3COO- |
NO |
S O O |
CO |
由①溶液显碱性,溶液为碱或显碱性的盐,其阴离子只能是OH-、CH3COO-、CO,由于CO与表中的阳离子结合只有K2CO3可溶,结合碱性:A>E>C(浓度均为0.1mol·L-1)推知A为Ba(OH)2[Ca(OH)2微溶],E为K2CO3,C为Ca(CH3COO)2。由②知B为AgNO3,由④知F为FeCl2或FeSO4,结合③:D中不能含SO,确定F为FeSO4,D为AlCl3。
答案:(1)AgNO3+NH3·H2O===AgOH↓+NH4NO3 AgOH+2NH3·H2O===Ag(NH3)2OH+2H2O
(2)碳酸钾 由①中碱性强弱的顺序可知:E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以E是碳酸钾
(3)Ba(OH)2 Ca(CH3COO)2 AlCl3 FeSO4
19.(2009·北京)现有下列8种物质:①Na2CO3、②NaHCO3、③C6H5ONa、④NH4HCO3、⑤C2H5OH、⑥Al、⑦食盐水、⑧CH3COOH。
(1)上述物质中属于强电解质的是________(填序号),既能跟盐酸反应又能跟NaOH溶液反应的是________(填序号)。
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示) __________________________
________________________________________________________________________。
(3)④跟足量的NaOH浓溶液在加热条件下反应的离子方程式是_________________
________________________________________________________________________。
答案:(1)①②③④ ②④⑥
(2)HCO+H2O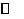 H2CO3+OH-
H2CO3+OH-
(3)NH+HCO+2OH-===CO+NH3↑+2H2O
18.(2009·全国卷Ⅱ)含有a mol FeBr2的溶液中,通入x mol Cl2,下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 ( )
A.x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2===Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
解析:由于还原性Fe2+>Br-,当通入少量Cl2时,Fe2+先被氧 化,即不可能先氧化Br-。
化,即不可能先氧化Br-。
答案:B
17.(2009·辽宁)能正确表示下列反应的离子方程式是 ( )
A.向次氯酸钙溶液通入过量CO2:
Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO
B.向次氯酸钙溶液通入SO2:
Ca2++2ClO-+H2O+SO2===CaSO3↓+2HClO
C.氢氧化钙溶液与碳酸氢镁溶液反应:
Ca2++OH-+HCO===CaCO3↓+H2O
D.在氯化亚铁溶液中加入稀硝酸:
3Fe2++4H++NO===3Fe3++2H2O+NO↑
解析:A项:CO2过量应生成Ca(HCO3)2;B项:CaSO3会被HClO氧化;C项:产物中还有Mg(OH)2沉淀生成。
答案:D
16.(2009·四川)在下列给定条件的溶液中,一定能大量共存的离子组是 ( )
A.无色溶液:Ca2+、H+、Cl-、HSO
B.能使pH试纸呈红色的溶液:Na+、NH、I-、NO
C.FeCl2溶液:K+、Na+、SO、AlO
D.=0.1 mol/L的溶液:Na+、K+、SiO、NO
解析:A中H+和HSO不能共存。B中能使pH试纸呈红色说明该溶液呈酸性,此时NO、I-因在酸性条件下发生氧化还原反应不能共存。C中Fe2+、AlO能发生水解。
答案:D
15.(2009·广东)下列离子方程式正确的是 ( )
A.铁与稀HNO3反应:Fe+2H+===Fe2++H2↑
B.小苏打与氢氧化钠溶液混合:
HCO+OH-===CO2↑+H2O
C.氯化钙与碳酸氢钾溶液混合:
Ca2++C O===CaCO3↓
O===CaCO3↓
D.CuSO4溶液与Ba(OH)2溶液混合:
Cu2++SO+2OH-+Ba2+===BaSO4↓+Cu(OH)2↓
解析:A中HNO3被还原成NO;B中应生成CO;C中反应不能发生。
答案:D
14.(2009·全国卷Ⅰ)下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是 ( )
A.Ba2+、NO、NH、Cl- B.C a2+、HCO、NH、AlO
a2+、HCO、NH、AlO
C.K+、Ba2+、Cl-、HSO D.Mg2+、NH、SO、K+
解析:B项中HCO与AlO因发生反应HCO+AlO+H2O===Al(OH)3↓+CO而不能大量共存( NH,AlO还可发生双水解),加入N
NH,AlO还可发生双水解),加入N aOH溶液并加热后,A项中无沉淀,C项中无气体生成。
aOH溶液并加热后,A项中无沉淀,C项中无气体生成。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com