
3.检查离子方程式书写是否正确的几个原则
⑴必须满足三个守恒原则
①元素守恒:反应前后各元素的原子个数相等。
②电荷守恒:方程式左右两边离子的电荷总数相等。
③电子守恒(价守恒):对于氧化还原反应,反应过程中元素化合价升高总数与降低总数相等。
(2)正确把握与“量”有关的反应原则
①某物质若其阴、阳离子都参加了反应,且都反应完全,则方程式中,该物质阴、阳离子个数比应与化学式中组成一致,如Ba(OH)2与H2SO4溶液反应,离子方程式为:
Ba2++2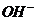 +2H++
+2H++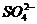 ═BaSO4↓+2H2O
═BaSO4↓+2H2O
注意:在H+、OH-、H2O之前的化学计量数2是不可能省去。
②若反应物之间由于量比不同可发生反应时,必须结合量比书写。如Ca(OH)2与NaHCO3反应,有两种情况:
若Ca(OH)2过量:Ca2++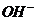 +
+ ═CaCO3↓+H2O
═CaCO3↓+H2O
若NaHCO3过量:Ca2++2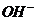 +2
+2 ═CaCO3↓+2H2O+
═CaCO3↓+2H2O+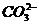
(3)注意反应条件的原则
①溶液酸碱性条件:有些物质在不同条件下存在形态不同,如反应产物有碳酸盐时,则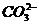 与
与 取决于溶液碱性强弱,强碱溶液中写
取决于溶液碱性强弱,强碱溶液中写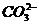 ,弱碱溶液中(如CO2过量时)写
,弱碱溶液中(如CO2过量时)写 。
。
②温度条件:NH4Cl与NaOH溶液反应时,只有在浓溶液且加热条件下,才可写成NH3↑,否则写成NH3·H2O。
③浓度条件:如BaCl2溶液与稀的NaHCO3溶液不发生反应,而BaCl2溶液与浓的NaHCO3反应,生成BaCO3↓,其离子方程式为:
Ba2++2 ═BaCO3↓+H2O+CO2↑
═BaCO3↓+H2O+CO2↑
④注意实验操作条件:如Na2CO3溶液与稀盐酸之间的反应,若将少量的HCl往多量Na2CO3溶液中滴加时:先发生: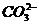 +H+═
+H+═ 后发生:H++
后发生:H++ ═CO2↑+H2O;若将少量Na2CO3往多量HCl中滴加时:
═CO2↑+H2O;若将少量Na2CO3往多量HCl中滴加时: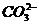 +2H+═CO2↑+H2O。
+2H+═CO2↑+H2O。
(4)必须遵循依据客观实验事实的原则
只有电解质参加的且具备电离条件的反应,才可写出离子方程式。
2.书写离子方程式时应注意的问题
(1)离子反应是在溶液或熔融状态时进行反应的,凡非溶液中进行的反应一般不能写离子反应方程式,亦即没有自由移动离子参加的反应,不能写出离子反应方程式。如NH4Cl固体和Ca(OH)2固体混合加热,虽然也有离子和离子反应,但不能写出离子反应方程式,只能写化学方程式。
(2)单质、氧化物、气体在溶液中的反应一律写化学式;弱电解质如弱酸(HF、H2S、HClO、H2CO3等)、弱碱(如NH3·H2O)和中强酸(如H2SO3、H3PO4)等难电离的物质必须写化学式;难溶于水的物质(如CaCO3、BaSO3、FeS、PbS、BaSO4、Fe(OH)3等)必须写化学式。
(3)多元弱酸的酸式盐的酸根离子在离子方程式中不能拆写。如NaHCO3溶液和稀硫酸反应: +H+═CO2↑+H2O
+H+═CO2↑+H2O
(4)对于微溶物的处理有三种情况:
①在生成物里有微溶物析出时,微溶物用化学式表示。如Na2SO4溶液中加入AgNO3溶液:
2Ag+ + 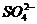 ═ Ag2SO4↓
═ Ag2SO4↓
②当反应物里有微溶物处于溶液状态(稀溶液)时,应写成离子的形式。如CO2气体通入澄清石灰水中:
CO2+Ca2++2OH-═CaCO3↓+H2O
③当反应物里有微溶物处于浊液或固态时,应写化学式。如在石灰乳中加入Na2CO3溶液:
Ca(OH)2+CO32-═CaCO3↓+2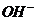
(5)操作顺序或反应物相对量不同时离子方程式不同。如:
①少量烧碱滴入Ca(HCO3)2溶液(此时碳酸氢钙过量)中,有:
Ca2++HCO3-+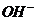 ═CaCO3↓+H2O
═CaCO3↓+H2O
②少量Ca(HCO3)2溶液滴入烧碱溶液(此时氢氧化钠过量)中,有:
Ca2++HCO3-+2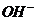 ═CaCO3↓+
═CaCO3↓+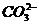 +2H2O
+2H2O
离子反应是指 。
1.离子反应的类型及其发生的条件
(1)复分解反应:这类离子反应又叫离子互换反应,其反应条件是:产生深沉、产生气体或产生难电离的物质如:
BaSO4+H2SO4═BaSO4↓+2H2O
Na2CO3+2HCl═2NaCl+CO2↑+2H2O
NH4Cl+NaOH═NH3·H2O+NaCl
这些反应的共同特点是:反应后溶液中自由移动的离子数目减少,因此离子互换反应一般是朝着溶液离子浓度减少的方向进行。但有少数例外,如:
CaCO3+CO2+H2O═Ca(HCO3)2
此反应能够进行的原因,是因为生成了难电离的H2CO3与CaCO3反应可生成更难电离的HCO3-化合物。
(2)氧化还原反应:这类离子反应发生的条件是:
。
2.强电解质和弱电解质
强电解质是指 。
弱电解质是指 。
 强酸:HCl、H2SO4、HNO3、HBr、HI、HClO4 ……………
强酸:HCl、H2SO4、HNO3、HBr、HI、HClO4 ……………
强电解质 强碱:NaOH、KOH、Ba(OH)2 ………………
大多数盐(含难溶盐):NaCl、CaSO4、KNO3、BaSO4、AgCl …………
 弱酸:HF、HClO、H2SO3、H2CO3、H3PO4、CH3COOH、 ……
弱酸:HF、HClO、H2SO3、H2CO3、H3PO4、CH3COOH、 ……
弱电解质 弱碱:NH3·H2O、Cu(OH)2、Fe(OH)3、………………
少数盐:Pb(CH3COO)2…………
水是一种极弱的电解质。
1.电解质导电的原因及影响因素
根据 ,可以判断是否为电解质。
(1)离子化合物在熔化状态时都能导电,因此都是电解质。有些离子化合物因难溶于水而使其水溶液难导电,如BaSO4、AgCl等。
(2)共价化合物在水溶液中可电离的为电解质,相反为非电解质。如HCl、H2SO4、HNO3等,在液态时虽不导电,但水溶液能导电,是电解质。
(3)有些化合物如SO2、SO3、NH3、PCl3等,其水溶液也可导电,但它们却是非电解质,原因是它们在水溶液中并不能电离出离子,只是与水发生反应产生电解质而引起导电。
(4)氯水、铁、石墨等尽管能导电,但既不是电解质,又不非电解质。
Directions: Write an English composition about 120 words according to the instructions given below in Chinese.
谈谈高考结束之后,你最想做的一件有意义的事情,并且阐明其理由。
6.各个地区采取了措施,使未能回家的人一起过了个快乐年。(so that)
5.对于有关自己学校里的各种事情,大多数同学在网上都参加过讨论。(participate)
4.我们俱乐部决不会对这种事情听之任之的。(have)
3.和你在一起的时候,我很容易有好心情。(It)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com