
8.设函数 的图象关于直线x=1对称,则a的值为
的图象关于直线x=1对称,则a的值为
A.3 B.2 C.1 D.-1
7.设有两个命题①函数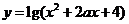 的值域为
的值域为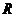 ;②函数
;②函数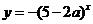 是减函数,若这两个命题有且只有一个是真命题,则实数a的取值范围是
是减函数,若这两个命题有且只有一个是真命题,则实数a的取值范围是
A.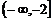 B.
B.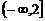 C.
C.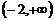 D.
D.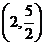
6.若集合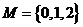 ,
, 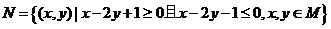 ,则N中元素的个数为
,则N中元素的个数为
A.9 B.6 C.4 D.2
5.函数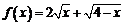 的值域为
的值域为
A.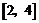 B.
B.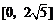 C.
C.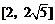 D.
D.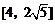
4.“对任意的实数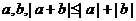 ”的否定是
”的否定是
A.不存在实数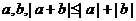 B.存在实数
B.存在实数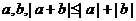
C.存在实数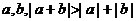 D.对任意实数
D.对任意实数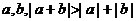
3.“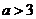 且
且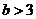 ”是“
”是“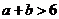 且
且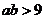 ”的
”的
A.充分非必要条件 B.必要非充分条件
C.充要条件 D.既不充分也不必要条件
2.命题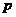 :若
:若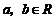 ,则
,则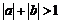 是
是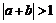 的充分不必要条件;命题
的充分不必要条件;命题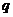 :函数
:函数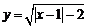 的定义域是
的定义域是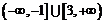 ,则
,则
A.“p或q”为假 B.“p且q”为真 C.p真q假 D.p假q真
1.若集合 ,则
,则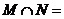
A.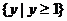 B.
B.  C.
C. 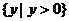 D.
D.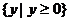
2.附加隐含条件的应用规律
⑴溶液无色透明时,则溶液肯定无有色离子。如Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、 (紫红色)等都有颜色,若无色溶液则说明这些离子不存在。
(紫红色)等都有颜色,若无色溶液则说明这些离子不存在。
⑵强碱性溶液中肯定不存在与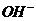 起反应的离子。
起反应的离子。
⑶强酸性溶液中肯定不存在与H+起反应的离子
⑷与水反应的离子,如O2-、N3-、P3-等在水溶液中不存在。
试题枚举
[例1]下列离子方程式正确的是
A.NaHSO3溶液与NaOH溶液反应:HSO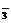 +OH-=SO
+OH-=SO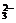 +H2O
+H2O
B.少量二氧化碳通入足量的NaOH溶液:CO2+OH-=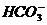
C.Fe与盐酸反应产生H2:2Fe+6H+=2Fe3++3H2↑
D.氨水和醋酸溶液混合NH3·H2O+CH3COOH=NH +CH3COO-+H2O
+CH3COO-+H2O
解析: 判断离子方程式的正误应注意①是否符合客观实际;②应该用化学式表示的(气体、沉淀、水、弱酸、弱碱、氧化物、单质等)是否写对,应该删掉的离子是否删去;③是否配平,电子转移是否合理.
据此检查各选项,A、D正确.B错,因少量的CO2通入足量的NaOH溶液中,应生成CO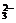 .
.
正确的写法为:CO2+2OH-=CO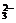 +H2O
+H2O
C错.因不符合客观实际,应生成Fe2+.
正确的写法为:Fe+2H+=Fe2++H2↑
答案: AD
[例2.]下列各组离子中,能在强酸溶液里大量共存,并且溶液呈无色透明的是
A.MnO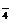 ,K+,Na+,SO
,K+,Na+,SO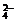 B.Na+,K+,HCO
B.Na+,K+,HCO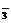 ,Cl-
,Cl-
C.Mg2+,NH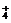 ,Cl-,NO
,Cl-,NO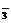 D.Ba2+,K+,S2-,SO
D.Ba2+,K+,S2-,SO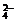
解析:对于离子能否共存问题:必须考虑两个问题,一看同组离子是否发生反应(复分解或氧化还原),二看是否满足题干要求.
有颜色离子:Fe3+,Fe2+,Cu2+,MnO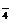 ……
……
强酸性(或强碱性),说明溶液中除离子组内各离子外,还应有H+或(OH-),典型的氧化性离子(如Fe3+,MnO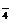 ,Cr2O
,Cr2O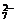 等)和典型的还原性离子(如Fe2+,S2-,I-,SO
等)和典型的还原性离子(如Fe2+,S2-,I-,SO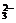 等)在溶液中会发生氧化还原反应.据以上分析得此题正确选项为C.
等)在溶液中会发生氧化还原反应.据以上分析得此题正确选项为C.
答案:C
[例3](1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液中至中性,请写出发生反应的离子方程式: 。
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式 。
解析:题目要求NaHSO4溶液与Ba(OH)2溶液反应呈中性,也即要求写出的离子方程式属于下列反应 2NaHSO4 + Ba(OH)2 = 2H2O + Na2SO4 + BaSO4↓。则离子方程式为:2H+ + SO42- + Ba2+ + 2OH- = BaSO4 ↓ + 2H2O 。若向上述溶液中继续滴加B(OH)2,则有 Ba2+ + SO42- = BaSO4 ↓
答案:2H+ + SO42- + Ba2+ + 2OH- = BaSO4 ↓ + 2H2O
Ba2+ + SO42- = BaSO4 ↓
1.同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子便不能在同一溶液中大量共存.
(1) 生成难溶物或微溶物:如Ba2+与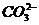 、Ag+与Br-、Ca2+与
、Ag+与Br-、Ca2+与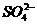 等不能大量共存。
等不能大量共存。
(2)生成气体或挥发性物质:如NH4+与OH-、H+与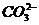 、
、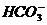 、S2-、
、S2-、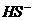 、
、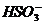 、
、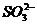 等不能大量共存。
等不能大量共存。
(3) 生成难电离的物质:如H+与CH3COO-、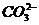 、S2-、
、S2-、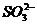 等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱或沉淀;H+与OH-生成水,这些离子不能大量共存。
等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱或沉淀;H+与OH-生成水,这些离子不能大量共存。
(4) 发生氧化还原反应:氧化性离子(如Fe3+、NO3-、ClO-、 等)与还原性离子(如S2-、I-、Fe2+、
等)与还原性离子(如S2-、I-、Fe2+、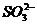 等)因在溶液中(特别是在酸性溶液中)发生氧化还原反应而不能大量共存。
等)因在溶液中(特别是在酸性溶液中)发生氧化还原反应而不能大量共存。
(5)形成配合物:如Fe3+与SCN-反应生成配合物而不能大量共存。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com