
5.下列关于液氯和氯水的叙述中正确的是( )
A.液氯是纯净物,而氯水是混合物
B.液氯无酸性,氯水有酸性
C.液氯较氯水的漂白作用更强
D.液氯无色,氯水呈黄绿色
4.下列物质中,既含有氯分子,又含有氯离子的是( )
A.氯化钠溶液 B.新制氯水
C.漂白粉 D.液氯
3.下列说法中正确的是( )
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用排水集气法便可以收集到纯净的氯气
C.氯气有漂白性
D.自来水常用氯气来杀菌、消毒
2.下列叙述中能证明次氯酸是一种弱酸的是( )
A.次氯酸不稳定,易分解
B.次氯酸是一种强氧化剂
C.次氯酸钙能与碳酸作用生成碳酸钙和次氯酸
D.次氯酸能使染料和有机色质褪色
1.下列气体中,既有颜色又有毒性的是( )
A.N2 B.CO C.Cl2 D.CO2
具有完全相同的组成的原子排列,但互为镜像,在三维空间不能重叠的分子,互称为
。有手性异体的分子叫手性分子。
思考:形成手性异构的条件?
无机含氧酸的酸性:
通常在无机含氧酸中非羟氧的数目 ,酸性越强;对于同一种元素的含氧酸,
该元素的 越高,含氧酸酸性越强。
试题枚举
[例1]下列分子的立体结构,其中属于直线型分子的是 ( )
A.H2O B.CO2 C.C2H2 D. P4
解析:多原子分子若要属于直线型分子,中心原子应采用sp杂化,且无孤对电子
答案:B C。
[例2]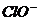 、
、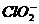 、
、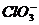 、
、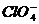 中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构
中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构
|
微粒 |
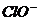 |
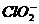 |
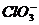 |
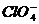 |
|
立体结构 |
|
|
|
|
解析:杂化轨道数相同,但孤对电子数同
答案:直线;V型;三角锥形;正四面体
[例3]下列物质的分子中,键角最小的是
A.H2O B.BF3 C.NH3 D.CH4
解析:BF3中的硼为sp2杂化,无孤对电子,键角120°;H2O、NH3、CH4中中心原子均为sp3杂化,H2O 中有两对孤对电子,对共用电子对“压迫”较大,键角最小
答案:A
[例4]铵根离子中存在的化学键类型按离子键、共价键和配位键分类,应含有
A.离子键和共价键 B.离子键和配位键 C.配位键和共价键 D.离子键
解析:铵根离子中N原子最外层5个电子,采用sp3杂化形成4个杂化轨道,其中一个杂化轨道被孤对电子占据,与H+的空轨道形成配位键;另三个轨道与H形成共价键
答案:C
[例5]根据“相似相溶”规律,你认为下列物质在水中溶解度较大的是( )
A .乙烯 B .二氧化碳 C.二氧化硫 D.氢气
解析:A B D非极性分子。
答案:C
[例6]下列氯元素含氧酸酸性最强的是 ( )
A.HClO B.HClO2 C.HClO3 D.HClO4
解析: D分子中非羟基氧数目大。
答案:D
[例7]在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”。凡有一个手性碳原子的物质一定具有光学活性,物质
 CH3COOCH2-CH-CHO有光学活性,发生下列反应后生成的有机物无光学活性的是
CH3COOCH2-CH-CHO有光学活性,发生下列反应后生成的有机物无光学活性的是
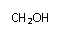
A.与甲酸发生酯化反应 B.与NaOH水溶液共热
C.与银氨溶液作用 D.在催化剂存在下与H2作用
解析: 手性碳原子应连接着四个不同的原子或原子团
答案:B D
正电中心和负电中心不重合的分子叫 分子,分子的极性来自化学键的极性,只含非极性键的分子一定是非极性分子;含有极性键的分子是否具有极性可根据极性键的极性的 是否等于零来判断。
思考:为什么BF3是非极性分子而NH3是极性分子?
非极性溶质一般易溶于 ,极性溶质一般易溶于 ,这一经验规律叫做“相似相溶”,若溶质与溶剂分子能形成氢键,则溶解性好。
某一分子离子提供孤对电子, 提供空轨道形成的特殊一种的 叫配位键,通常把 的化合物称为配位化合物,简称配合物,过渡金属易形成配物。
杂化轨道理论要点:
①只有 原子轨道才能杂化
②原子轨道杂化时,轨道 不变,轨道的形状发生变化
③原子轨道杂化后总能量比原有轨道能量之和降低
④杂化轨道只于形成δ键
⑤sp杂化轨道夹角 ,sp2杂化轨道夹角 ,sp3杂化轨道夹角 。
思考:怎样判断有几个轨道参与了杂化?
价层电子对互斥模型把分子分成两大类:一类是 ,如CO2、CH4等,其立体结构可用 周围的原子数n来预测,如ABn,n=2, 形,n=3, 形,n=4, 形;另一类是 的分子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com