
13.方法一:(1)稀H2SO4、铁屑(2)煮沸(3)避免生成的Fe(OH)2沉淀接触O2
方法二:(1)稀H2SO4、铁屑(2)NaOH溶液(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹(4)试管Ⅰ中反应生成的H2充满了试管I和试管Ⅱ,且外界空气不容易进入
解析:方法一中根据FeSO4具有易被氧化和易水解的特点,在配制其溶液时还需加入稀H2SO4和铁屑;蒸馏水中若溶有O2,则会加速Fe(OH)2氧化,因此可采用煮沸法除去O2。为避免生成的Fe(OH)2沉淀接触O2,可用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液方可达到目的。
方法二的原理是利用稀H2SO4和铁屑产生氢气,先赶净装置中空气。确定赶净空气后再夹紧止水夹,通过H2产生的压强将FeSO4压入NAOH溶液中去,从而使产生的白色Fe(OH)2沉淀在H2的还原性气氛中得以较长时间保持。
点评:这是一道与Fe(OH)2的制备原理有关的题目,采用了创新的实验手法。对此类题目的完美解答,有赖于对基础知识的扎实掌握,对有关实验原理和仪器的熟知程度,并需要大胆的开拓和创新精神。
12.(1)Al 干冰
(2)干冰汽化时排出了罐内空气,当加入NaOH溶液后,CO2被吸收,使罐内气压小于大气压,故易拉罐变瘪CO2+2NaOH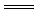 Na2CO3+H2O
Na2CO3+H2O
(3)过量的NaOH溶液与铝制罐反应产生H2,使罐内压强增大到大于大气压,故罐再度鼓起2Al+2NaOH+2H2O=2NaAlO2十3H2↑
11.D 解析:将一小块金属钠投入FeSO4溶液中,会发生如下反应:2Na十2H2O=2NaOH+H2↑;FeSO4+2NaOH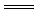 Fe(OH)2↓+Na2SO4。Fe(OH)2沉淀不稳定,容易被氧化:4Fe(OH)2+O2+2H2O
Fe(OH)2↓+Na2SO4。Fe(OH)2沉淀不稳定,容易被氧化:4Fe(OH)2+O2+2H2O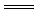 4Fe(OH)3。滤出的Fe(OH)3沉淀再灼烧,发生的反应是:
4Fe(OH)3。滤出的Fe(OH)3沉淀再灼烧,发生的反应是:
2Fe(OH)3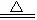 Fe2O3+3H2O。所以,最终所得的固体物质是Fe2O3。
Fe2O3+3H2O。所以,最终所得的固体物质是Fe2O3。
10.B解析:先加KSCN溶液若不变红,则可证明无Fe3+;再滴加氯水立即呈红色,则可证明原溶液中有Fe2+。Fe2+遇SCN-无明显变化,滴加氯水后,Fe2+被氧化生成Fe+,Fe3+与SCN-结合使溶液变红了,故B是正确的实验方法。
9.AB
解析:Fe+H2SO4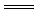 FeSO4+H2↑
FeSO4+H2↑
2FeCl3+Fe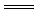 3FeCl2
3FeCl2
Fe+CuSO4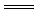 FeSO4+Cu
FeSO4+Cu
FeSO4溶液不能溶解Fe,故答案选A、B。
8.D解析:滴加少许KSCN溶液,无红色出现;再加少许氯水后若立即出现红色,则证明原溶液中一定存在Fe2+。
7.D解析:依题意,最后所得固体为Al2O3,其物质的量为 mol,故原
mol,故原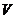 LAl2(SO4)3溶液中含SO
LAl2(SO4)3溶液中含SO 的物质的量为(
的物质的量为( ×3)mol,
×3)mol,
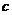 (SO
(SO )=
)=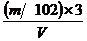 =
= mol.L-1,所以答案选D。
mol.L-1,所以答案选D。
0.3×0.24×0.3×0.2
得2×0.2×0.2+4×0.3×0.2=4× ,即
,即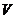 =80Ml。
=80Ml。
0.2×0.22×0.2×0.2
Al3+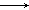 4OH-
4OH-
6.C解析:欲使Mg2+全部转化成沉淀并从溶液中分离出来,应向溶液中加入过量的NaOH溶液,使Mg2+、Al3+全部沉淀后,再使Al(OH)3恰好溶解。设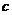 (Al3+)=
(Al3+)=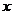 mol·L-1,则根据电荷守恒:
mol·L-1,则根据电荷守恒:
3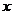 +2
+2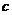 (Mg2+)
(Mg2+)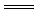
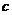 (Cl-),即3
(Cl-),即3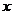 +2×0.2=1.3,
+2×0.2=1.3,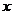 =0.3mol·L-1。
=0.3mol·L-1。
设NaOH溶液的体积为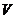 mL,
mL,
则根据关系式:Mg2+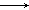 2OH-
2OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com