
1、(广东省中山一中2009届高三第二次统测化学试题)为达到预期的实验目的,下列操作正确的是( B )
A.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
B.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
C.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
2、配平方法:一标二列三求四配五观六查
具体地说,就是标出反应前后元素的化合价、列出化合价的升降情况、求化合价升降的最小公倍数、根据所求的最小公倍数配出化合价发生变化的物质的系数、用观察法配出所含元素化合价未发生变化的物质的系数、用质量守恒和电荷守恒检查所配结果是否正确。
例: KMnO4+ HCl= KCl+ MnCl2+ Cl2↑+ H2O
系数为:2、16、2、2、、5、8
1、依据原则:在氧化还原反应中,元素得电子的总数=元素失去电子的总数
或化合价升高的总数=化合价降低的总数
2、单线桥分析法
要点:①单线桥是从还原剂中失去电子的元素指向氧化剂中得到电子的元素;
②线上标明只标明电子的数目,不必写其它内容。
1、双线桥分析法
要点:①双线桥从左指向右连接不同价态的同种元素;
②线上标明电子得失、化合价升降、被氧化、被还原等内容(注意得失电子守恒)。
在中学化学中,常用作氧化剂的物质有: 、 、 、 、 、
等;常用作还原剂的物质有活泼的金属单质如 、 、 ,以及 、
、 等。(见人教版必修1第36页)
(1)根据元素的化合价
[练 习]下列微粒:H+、Cu2+、Ag+、Fe2+、Fe3+、Cl-、S2-、I-、MnO4-、ClO3-、NO3-、SO32-、S、Cl2、Na、H2;其中只有氧化性的是 ;只有还原性的
是 ,既有氧化性又有还原性的是 ;
[思考]如果物质中某元素具有最高价,该元素只有 性;物质中元素具有最低价,该元素只有 性;物质中元素具有中间价态,该元素既有 又有 性。对于同一种元素,价态越高,则 性越强,价态越低,则 性越强。
(2)根据氧化还原反应方程式
强还原剂(A)+强氧化剂(B)=弱氧化产物(a)+弱还原产物(b)
则氧化性:B>a,还原性:A>b
氧化剂的氧化性越强,则其对应的 产物的还原性则越 ;还原剂的还原性越强,则其对应的 产物的氧化性则越 。
(3)根据金属活动性顺序表
在金属活动性顺序表中,位置越靠前,其还原性就越 ,其阳离子的氧化性就越 。
(4)根据元素周期表
同周期元素,随着核电荷数的递增,氧化性逐渐 ,还原性逐渐 ;同主族元素,随着核电荷数的递增,氧化性逐渐 ,还原性逐渐 。
(5)根据反应的难易程度
氧化还原反应越容易进行(表现为反应所需条件越低),则氧化剂的氧化性和还原剂的还原性就越 。
不同的还原剂(或氧化剂)与同一氧化剂(或还原剂)反应时,条件越易或者氧化剂(或还原剂)被还原(或被氧化)的程度越大,则还原剂(或氧化剂)的还原性(或氧化性)就越 ;
(6)其它条件
一般溶液的酸性越强或温度越高,则氧化剂的氧化性和还原剂的还原性就越 ,反之则越弱。
注意:
1物质的氧化性或还原性的强弱只决定于得到或失去电子的 ,与得失电子的 无关。如:Na、Mg、Al的还原性强弱依次为Na>Mg>Al;浓HNO3、稀HNO3的氧化性强弱依次为:浓HNO3 >稀HNO3;
2同一元素相邻价态间不发生氧化还原反应。
|
概 念 |
得失氧的角度 |
化合价变化的角度 |
电子转移的角度 |
|
氧 化 剂 |
在反应中失去氧的物质 |
所含元素化合价降低的物质 |
在反应过程中得到电子的物质 |
|
还 原 剂 |
|
|
|
|
氧化反应 |
物质得到氧的反应 |
物质所含元素化合价升高的反应 |
物质失去电子的反应 |
|
还原反应 |
|
|
|
|
氧化产物 |
---- |
还原剂中所含元素化合价升高以后的对应产物 |
还原剂中失去电子以后的对应产物 |
|
还原产物 |
---- |
|
|
|
氧 化 性 |
---- |
---- |
氧化剂所具有的得到电子的能力 |
|
还 原 性 |
---- |
---- |
还原剂所具有的失去电子的能力 |
判断氧化反应、还原反应及氧化剂和还原剂、氧化产物和还原产物时可抓住下表中的关系:
|
反应物 |
变化特点 |
生成物 |
|
还原剂 |
失、高、氧---氧化反应 |
氧化产物 |
|
氧化剂 |
得、低、还---还原反应 |
还原产物 |
氧化还原反应的实质是电子的 (包括电子的得失或电子对的偏移),特征是反应前
后 ;判断某反应是否属于氧化还原反应可根据反应前后 是否发生了变化这一特征。
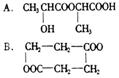
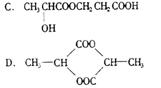
17. 一定质量的某有机物和足量的金属钠反应,可得到气体V1L,等质量的该有机物与适量且足量的纯碱溶液恰好完全反应,可得到气体V2L(气体体积均在同温同压下测定)。若V1>V2,则该有机物可能是 A ( )
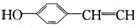
18, 白藜芦醇 广泛存在于食物(例如桑葚、花生,尤其是葡萄)
中,它可能具有抗癌性。能够跟1 mol该化合物起反应的Br2或H2的最大用量分别是
A.1 mol,1 mol B.3.5 mol,7 mol
C.3.5 mol,6 mol D. 6mol,7 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com