
3. 已知等差数列 的公差为2,若
的公差为2,若 成等比数列, 则
成等比数列, 则 =
( )
=
( )
(A) –4 (B) –6 (C) –8 (D) –10
2.在等比数列{an}中,首项a1<0,则{an}是递增数列的充要条件是公比q满足 ( )
A.q>1 B.q<1 C.0<q<1 D.q<0
1.在等差数列 中,若
中,若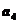 +
+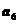 +
+ +
+ +
+ =120,则2
=120,则2 -
- 的值为 ( )
的值为 ( )
A、20 B、22 C、24 D、28
11.(10分)
(1)C15H16O2(1分) (2)D (2分)
(3)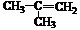 (2分) (4)羟基、羧基;(2分) 消去反应(1分)
(2分) (4)羟基、羧基;(2分) 消去反应(1分)
(5)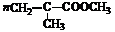

 (2分)
(2分)

11.(10分)双酚-A的二甲基丙烯酸酯是一种能使人及动物的内分泌系统发生紊乱,导致生育及繁殖异常的环境激素,其结构简式为:

它在一定条件下水解可生成双酚-A和羧酸H两种物质。
Ⅰ.(1) 双酚-A的分子式为_____________。
(2) 下列关于双酚-A的叙述中正确的是_________(填写字母)。
A.与苯酚互为同系物 B.可以和Na2CO3溶液反应,放出CO2气体
C.分子中最多有8个碳原子在同一平面上
D.1 mol双酚-A与浓溴水反应,最多可以消耗Br2的物质的量为4 mol
Ⅱ.已知与(CH3)3COH结构相似的醇不能被氧化为醛或酸。羧酸H可以由烯烃C通过以下途径制得(有的反应条件没有标出):

(3) C的结构简式_________________________。
(4) G中所含官能团为_________________(填名称),⑤的反应类型为______________。
(5) 羧酸H与甲醇反应后得到的酯,能形成一种高分子化合物,可用于制造高级光学仪器透镜,请写出该酯在一定条件下生成此高分子化合物的化学反应方程式:____________________________________________________。
10.⑴Na2SO3+H2SO4=Na2SO4+SO2↑+H2O(2分) ⑵由红色变为无色(2分);先由紫色变为红色,后颜色逐渐褪去(2分);颜色又恢复为原来的红色(2分)⑶Br2+SO2+H2O=4H++2Br-+SO42-(3分)⑷平衡分液漏斗和锥形瓶内压强,使液体能够顺利流下(3分);防止烧杯内液体倒流入左侧试剂瓶内 (2分)⑸不能(2分)。
10.(18分)某同学设计了如下装置用于制取SO2和验证SO2的性质。分流漏斗内装75%的浓硫酸,锥形瓶内装固体Na2SO3。试回答以下问题:

⑴锥形瓶内发生的反应的化学方程式为: 。
⑵实验过程中,品红试液的颜色变为: ;石蕊试液的颜色变化为: 。实验后加热烧瓶,品红试液的颜色变化为: 。
⑶溴水与SO2反应的离子方程式为: 。
⑷导管①的作用是: ;倒置漏斗的作用是 。
⑸方框内装置能否换成启普发生器? (回答“能”或“不能”)。
9.本题共15分
(1)NO2、SO2(2分); 0.3(2分); 3(2a+b)/80(2分)
(2)SO2+Ca(OH)2=CaSO3↓+H2O(2分)、2CaSO3+O2+4H2O=2CaSO4·2H2O(2分)
(3)①释放(2分) ②32(L/mol/)(3分,没有单位也可)
9.(15分)二氧化硫和氮氧化物是常用的化工原料,但也会给大气带来污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、CO2、NO2、SO2等气体,其中 能导致酸雨的形成。目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。如:
CO(g)+NO2(g)=NO(g)+CO2(g),△H=-a kJ/mol(a>0);
2CO(g)+2NO(g)=N2(g)+2CO2(g),△H=-b kJ/mol(b>0)。
据此回答:若用标准状况下3.36 L CO还原NO2至N2(CO完全反应),整个过程中,转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
(2)火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏(CaSO4·2H2O)。写出有关反应的化学反应方程式 。

 (3)在硫酸工业中,需要将SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),△H=-196 kJ/mol。右图为某温度下,5 mol SO2和7 mol O2在密闭容器中反应达到平衡时,SO2的体积分数与体系的总压强的关系。根据此图回答下列问题:
(3)在硫酸工业中,需要将SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),△H=-196 kJ/mol。右图为某温度下,5 mol SO2和7 mol O2在密闭容器中反应达到平衡时,SO2的体积分数与体系的总压强的关系。根据此图回答下列问题:
①平衡状态由A变到B时,反应体系 (填“吸收”或“释放”)能量。
②若上述反应在10 L的密闭容器中进行,当反应达到平衡时,体系的总压强为0.1 MPa,则该反应在该温度下的平衡常数为 。
8.(1)(2分) 镁(Mg)(2分)
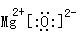
(2)(2分)
(3)4×6.02×1023(3分)
(4)2Al3++6H2O+6Cl- 2Al(OH)3↓+3H2↑+3Cl2↑(3分)
2Al(OH)3↓+3H2↑+3Cl2↑(3分)
(5)向饱和硫化钠溶液或硫化氢溶液中通入氯气。(3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com