
21.(13分)Ⅰ.把氯化亚铁水溶液中的Fe2+氧化为Fe3+,而不引进金属离子或其它原溶液中
不含有的阴离子,所用的三种方法的离子方程式分别为:
① ___________________ ______________________
② __________________ _______________________
③ ______________________ ___________________
Ⅱ.在装有固体A的试管中加入无色溶液B(足量),此时A未溶解.但加入一定量的水,
A即逐渐溶解.并有气体生成,溶液变为浅绿色.将空气通入该试管的溶液中,溶液颜色
很快加深.请填写下列空白:
(1)B的化学式是
(2)A加水后才溶解,其理由是
20.在一定温度下,向某饱和硫酸钠溶液中加入a g无水Na2SO4粉末,搅拌、静置后,析出bg Na2SO4·10H2O晶体。下列量中,可以根据已知条件计算的
①该温度下硫酸钠的溶解度 ②原饱和溶液减少的水的质量
③原饱和溶液减少的溶质的质量 ④析出晶体中含Na2SO4的质量
A.②④ B.②③④ C.①②④ D.①②③④
第Ⅱ卷
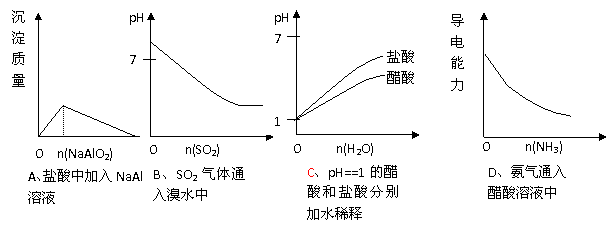
19、下列实验过程中产生的现象与对应的图形正确的是
18. 某稀硝酸能与4.8 gCu恰好完全反应,等量的此稀硝酸在和Fe反应同样生成NO时,最多消耗Fe为
A. 2.8 g B. 4.2 g C. 4.8 g D. 5.6 g
17、将a g CuO和Fe2O3的混合物分成两等份,向其中一份中加入b mL c mol/L的稀盐酸正好完全反应;另一份在加热的条件下用H2还原,反应完全时用去H2 d L(折算成标准状况)。则d等于
A、22.4(3a-4bc)×10-3 B、22.4bc×10-3
C、22.4(3a-4bc×10-3) D、、11.2bc×10-3
16、将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是
A、反应过程中得到6.72L(标准状况)的气体 B、最终得到7.8g的沉淀
C、最终得到的溶液中c(NaCl)=2mol/L D、最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
15. 有Fe2+、NO3-、NH4+、H+、Fe3+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是
A.若有1molNO3-参加还原反应,则转移8mole-
B.还原产物为NH4+
C.氧化剂与还原剂的物质的量之比为8:1
D.若把该反应设计为原电池,则负极反应为Fe2+-e-= Fe3+
14. 以下各组均有三种溶液,这三种溶液中所含溶质的物质的量均相等,将它们充分混合后,不会产生沉淀的是
A.AlCl3、Ba(OH)2、HCl B.MgCl2、Na2CO3、HCl
C.MgCl2、Ca(OH)2、HNO3 D.NaAlO2、NaOH、H2SO4
13.NA表示阿伏加德罗常数,下列叙述中正确的是:
A.9.6g铜与浓硝酸反应,生成NO2分子数一定为0.3NA
B.pH=1的甲酸溶液中,HCOO-和OH-数目之和为0.1NA
C.0.2g D2O中所含中子数为0.1NA
D.常温下,1.12L氮气所含原子数为0.1NA
12. 下列叙述正确的是
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通人SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com