
6.(2008·广东理基,68)1949年美国发起成立了北大西洋公约组织,其目的是 ( )
A.拉拢东欧国家 B.压制殖民地独立运动
C.军事上遏制苏联 D.与华沙条约组织对抗
解析:二战后,美国妄图称霸世界,积极推行霸权主义政策,而由于意识形态和国
家利益的冲突,美苏矛盾尖锐,于是美国对苏联等社会主义国家推行了“冷战”的
策略,遏制共产主义。
答案:C
5.(广东广州毕业班测试)有人说:“对美国来说,马歇尔计划达到了一箭几雕的目的。”
这里的“几雕”是指 ( )
①稳定了西欧经济
②加强了美国在国际金融领域的支配地位
③有助于美国商品的输出
④把受援国纳入了美国全球称霸的战略轨道
A.①②③ B.①③④ C.②③④ D.①②③④
解析:加强了美国在国际金融领域的支配地位的是布雷顿森林体系的形成。
答案:B
4.(2010·广东深圳模拟,19)1961年,东德政府修建柏林墙,阻隔东、西柏林之间的往来。柏林墙的正式名称是反法西斯防卫墙,其“反法西斯”的含义应指 ( )
A.抵制西方势力的渗透
B.阻止欧洲一体化进程
C.防止法西斯残余势力的进攻
D.反对美苏“冷战”对峙
解析:柏林墙的修建是美苏“冷战”的结果,是苏联和东德政府为了防止西方势力
的渗透而修建的,所谓的“法西斯势力”,实际是指西方势力。
答案:A
3.“我无须对诸位说:世界局势很是严重……我们的政策不是反对任何国家、任何主
义,而是反对全人类共同的敌人--饥饿、贫穷、绝望和混乱……美国政府能够尽
力缓和局势,协助欧洲走上复兴道路。”与材料直接相关的是 ( )
A.杜鲁门主义 B.马歇尔计划
C.北约成立 D.华约成立
解析:注意抓住材料中的关键信息“美国协助欧洲走上复兴道路”可以判断为马歇
尔计划。
答案:B
2.(2010·德州模拟)美国总统杜鲁门(1945年)说:“美国在世界上处于领导地位。……
恺撒、成吉思汗、路易十四、拿破仑或其他任何一个伟大的领袖所担负的责任,都
不能同美国总统今天所担负的责任相比拟。”这说明 ( )
①美国的世界霸权政策昭然若揭 ②美国要领导西方国家对抗苏联 ③美苏同盟关
系公开破裂 ④美国要同苏联进行合作
A.①② B.①③ C.③④ D.①④
解析:结合材料分析二战后随着美国经济实力的增强,开始推行世界霸权政策,在
世界范围内与苏联对抗。
答案:A
1.(2010·试题研究)在德国入侵苏联之后,丘吉尔曾说:“俄国的困难就是英
国的困难”,表示将尽全力援助苏联;但二战结束后,他又公开发表“铁
幕”演说,鼓吹对苏联的冷战。这说明他 ( )
A.出尔反尔,典型的政客
B.骨子里一直仇视苏联
C.根据自身利益调整政策
D.唯美国马首是瞻
解析:本题主要考查二战中及二战后英国对苏联态度变化的实质。二战中,德国法
西斯是最主要的敌人,援助苏联是为了战胜法西斯,维护自身利益。二战后,德国
投降,英国与苏联等的利益冲突日益明显,因此鼓吹冷战。C项符合要求。
答案:C
25.(8分)将一块金属钠投入到100 mL MgCl2和AlCl3的混合溶液中,发现沉淀先多后少。反应完毕后收集到13.44 L气体(标准状况下),同时得到21.4 g白色沉淀,将此沉淀溶于过量的NaOH溶液中,充分反应后沉淀质量减轻了15.6 g。求原溶液中Mg2+、Al3+的物质的量浓度。
2009-2010学年度下学期开原高中高二第三次月考考试
24.(13分) 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
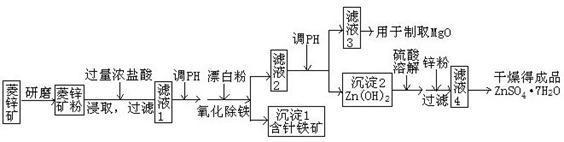
(1)将菱锌矿研磨成粉的目的是_____。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____=□Fe(OH)3 +□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为_____ _。
|
|
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
|
开始沉淀的pH |
10.4 |
6.4 |
- |
- |
|
沉淀完全的pH |
12.4 |
8.0 |
- |
- |
|
开始溶解的pH |
- |
10.5 |
- |
- |
|
Ksp |
5.6×10-12 |
- |
6.8×10-6 |
2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
23、(10分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。
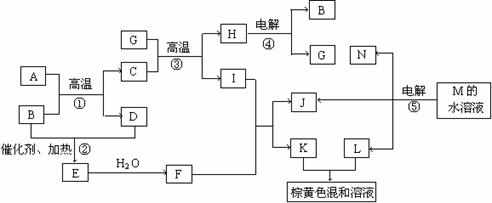
(1)写出A、B的化学式A B
(2)写出下列化学反应方程式:
反应②的化学方程式 ;
反应③的化学方程式 ;
反应⑤的离子方程式 。
22.(6分)已知下列变化过程中,0.2
mol 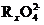 参加反应时共转移 0.4 mol 电子。
参加反应时共转移 0.4 mol 电子。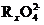 +
+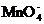 +H+
+H+ RO2+Mn2++H2O
RO2+Mn2++H2O
(1)x的值为 。
(2)配平上述氧化还原反应(用具体数字)。
⑶用单线桥标出电子转移方向和数目。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com