
[物理变化]物质的外形或状态发生改变而没有新物质生成的变化。物质发生物理变化时,仅改变了其物理性质(如聚集状态、密度、溶解度、电导率等),而不改变其化学组成和化学性质。例如水的蒸发和凝固、蔗糖溶解等。物质发生物理变化后,可以通过物理方法使它恢复到原来状态,例如液态水降低到0℃以下时变为冰,再将温度升高到0℃以上时冰又熔化成水。
[化学变化]又称化学反应。是指在原子核组成不变的情况下生成新物质的变化。这是由于核外电子运动状态的改变而引起的物质组成的质变。例如碳的燃烧、铁生锈、石灰石受热分解等。化学变化以质变为其特征,同时还伴随有能量的变化,表现为反应过程常有放热、吸热等现象。有时反应结果出现变色、放出气体、生成沉淀等,这些现象有助于人们判断化学变化的发生。化学变化一般分为化合反应、分解反应、置换反应和复分解反应等。
[化学反应]见化学变化条。
[物理性质]物质本身的一种属性,不需要发生化学变化就表现出来的性质。例如状态、颜色、气味、密度、硬度、熔点、沸点、蒸气压、导热性、导电率、延性、展性等。这些性质都没改变物质的化学组成。
[化学性质]物质本身所具有的、只有在化学变化中才能表现出来的性质。例如酸性、碱性、氧化性、还原性、化学稳定性等。物质的化学性质主要决定于物质的组成和结构。例如,Na、Mg、Al的还原性依次减弱,是由于它们的最外层电子数目依次增多,原子半径依次减小,核电荷数依次增多,造成了它们在化学反应中失电子能力依次减弱。Na、Mg、Al的还原性只有在化学反应中才能表现出来。
[分解反应]化学反应的基本类型之一。是一种物质生成两种或两种以上物质的反应。例如:
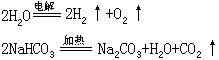
在分解反应中,如果反应前后各元素的化合价保持不变,就属于非氧化-还原反应,如NaHCO3受热分解;如果有些元素的化合价发生改变,就属于氧化-还原反应,如电解水的反应。
[化合反应]化学反应的基本类型之一,是两种或两种以上的物质生成另一种物质的反应。例如:
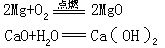
在化合反应中,如果反应前后各元素的化合价保持不变,就属于非氧化-还原反应,如氧化钙与水化合;如果元素的化合价发生改变,就属于氧化-还原反应,如镁条在空气中燃烧。在化合反应中,反应物越活泼,生成物就越稳定,反应就越容易进行。
[置换反应]化学反应的基本类型之一,是一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应。例如:
2Na+2H2O=2NaOH+H2↑
Fe+CuSO4=FeSO4+Cu
Cl2+2KI=2KCl+I2
在置换反应中,反应前后某些元素的化合价必定改变,因此置换反应都属于氧化-还原反应。置换反应中,按化学活动性顺序,较活动的金属能跟酸或盐反应,置换出较不活动的金属和氢气;较活动的非金属能与盐反应,置换出较不活动的非金属。
[复分解反应]化学反应的基本类型之一。是两种化合物互相交换成分生成另外两种化合物的反应。例如:
HCl+NaOH=NaCl+H2O
FeS+2HCl=FeCl2+H2S↑
AgNO3+NaCl=AgCl↓+NaNO3
在复分解反应中,反应前后元素化合价必定不变,因此复分解反应都属于非氧化-还原反应。从复分解反应的产物中有无气体、沉淀、弱电解质(如水)的生成,来判断反应是否能发生,只要生成物有气体、沉淀、弱电解质三者之一的,复分解反应就可以趋于完成。
[中和反应]酸和碱相互作用生成盐和水的反应。例如盐酸和氢氧化钠反应。
HCl+NaOH=NaCl+H2O
强酸和强碱的反应,实质上是酸中的氢离子与碱中氢氧根离子相互结合生成难电离的水分子的反应
H++OH-=H2O
[水合反应]又称水化反应。物质跟水发生的化合反应。一般指分子或离子与水结合成水合物或水合离子的过程。例如,
CuSO4+5H2O=CuSO4·5H2O
H++H2O=H3O+
在有机化学中也指有机物分子中不饱和键(双键或三键)在催化剂作用下和水分子化合的反应。
[水化反应]见水合反应条。
[离子反应]电解质在溶液里所发生的离子间的反应。有两类情况:
(1)电解质在溶液里发生的离子互换反应,属于非氧化-还原反应,反应发生的条件是生成物之一是难溶物质,易挥发性物质或极难电离的物质,这类离子反应的特征一般是朝着减小离子浓度的方向进行。例如:
Ag++Cl-=AgCl↓
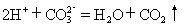
(2)属于氧化-还原反应的离子反应,例如:
Zn+2H+=Zn2++H2↑
Cl2+2I-=2Cl-+I2

这类离子反应的发生条件遵循氧化-还原反应规律。
[氧化反应]简称氧化。物质(分子、原子或离子)失去电子或电子偏离的反应。在氧化反应中物质所含的元素化合价(或氧化数)升高,这是判断氧化反应的依据。氧化反应和还原反应相伴而生。例如:

[还原反应]简称还原。物质(分子、原子或离子)得到电子或电子对偏近的反应。在还原反应中物质所含的元素化合价(或氧化数)降低,这是判断还原反应的依据。还原反应和氧化反应相伴而生。参见氧化反应。
[氧化-还原反应]物质发生电子转移(或电子对偏移)的反应。在氧化-还原反应里,一种物质失去电子(或电子对偏离),必然同时有另外的物质得到电子(或电子对偏近),而且得失电子的总数相等。在氧化-还原反应里氧化和还原总是同时发生的。反应前后元素的化合价(或氧化数)发生变化是氧化-还原反应的特征。例如:
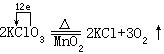
[氧化剂]在氧化-还原反应中得到电子(或电子对偏近)的反应物。在反应中氧化剂中元素的化合价(或氧化数)降低。氧化剂能氧化其它物质而自身被还原,例如:
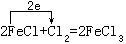
Cl2是氧化剂,在反应中获得电子,化合价(或氧化数)降低,将FeCl2氧化成FeCl3而Cl2自身被还原成Cl-。氧化剂通常是指容易获得电子的物质,常见的有:(1)活泼的非金属单质、如氧、氯、溴等。(2)具有高化合价(氧化数)的金属离子,如Fe3+、Sn4+等。(3)含有高化合价(氧化数)元素的含氧化合物,如KMnO4、K2Cr2O7、MnO2、KClO3、HNO3、H2SO4(浓)、PbO2等。(4)过氧化物,如H2O2、Na2O2、BaO2等。根据氧化剂获得电子的难易程度,可分为弱氧化剂和强氧化剂,定量地判断氧化剂氧化能力的大小,应依据氧化剂及其还原产物所构成的氧化还原电对的标准电极电位E0值来确定,E0值越正,表明氧化剂的氧化能力就越强。
[还原剂]在氧化-还原反应中失去电子(或电子对偏离)的反应物。在反应中还原剂中元素的化合价(或氧化数)升高。还原剂能还原其它物质而自身在反应中被氧化。还原剂通常是指容易失去电子的物质,常见的有:(1)活泼金属,如钠、钾、镁、铝、铁等。(2)具有低化合价(氧化数)的金属离子,如Fe2+、Sn2+等。(3)非金属离子,如I-、S2-等。(4)含有低化合价(氧化数)元素的含氧化合物,如CO、SO2、Na2SO3、Na2S2O3、NaNO2等。根据还原剂失去电子的难易程度,可分为弱还原剂和强还原剂,定量地判断还原剂还原能力的大小,应根据该还原剂及其氧化产物所组成的氧化还原电对的标准电极电位E0值来确定,E0值越负,表明该还原剂的还原能力越强。
[氧化性酸]一般指中心原子获得电子显示氧化性的酸。如浓硫酸、硝酸、氯酸、高氯酸、高锰酸、重铬酸等,其中心原子在氧化-还原反应中容易获得电子而显示氧化性,可用作氧化剂。任何酸的水溶液中都不同程度地电离出H+,H+在一定条件下可获得电子而形成H2,这也是酸的氧化性的表现,实质上是H+的一种性质。应该与酸的中心原子获得电子所呈现的氧化性区别开来。通常把盐酸、稀硫酸等称作为非氧化性酸。
[歧化反应]也称自身氧化-还原反应。是氧化-还原反应的一种类型。在歧化反应中,同一种元素的一部分原子(或离子)被氧化,另一部分原子(或离子)被还原。这是由于该元素具有高低不同的氧化态,在适宜的条件下向较高和较低的氧化态转化的缘故。例如:
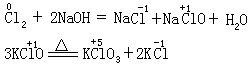
[自身氧化-还原反应]见歧化反应条。
[非氧化-还原反应]反应过程中,反应物的原子或离子不发生氧化数变化的反应,例如复分解反应和络合反应等(参见氧化-还原反应条)。
[燃烧]伴有发光放热现象的剧烈氧化反应。燃烧可分为完全燃烧和不完全燃烧两种,燃料不完全燃烧的产物往往会造成对大气的污染,还会降低热能的利用率,因此要设法使燃料燃烧完全。一般将固体燃料粉碎,液体燃料喷成雾状来增加和空气的接触机会,同时采取通风等措施,以提高燃料的利用率。
[着火点]又称燃点。物质开始着火时的温度。物质燃烧前,必须加热到着火点,物质开始燃烧后,释放出热量,就不需要再从外界获得热量。固体燃料的着火点不是固定不变的,一般颗粒越细,表面积越大,着火点就会降低,如炭粉与炭块的着火点是不同的;液体燃料的着火点与燃料雾化程度有关。纯气体燃料在常压下的着火点是一定的,如一氧化碳的着火点为650℃、氢气的着火点为585℃、甲烷的着火点为537℃等。
[燃点]见着火点条。
[闪点]又称内燃点。表示可燃性液体性质的指标之一。是液体表面的蒸气和空气的混和物与火接触初次发生蓝色火焰闪光时的温度。用标准仪器测定闪点,仪器有开杯式和闭杯式两种,一般前者用于测定高闪点液体的闪点,后者用于测定低闪点液体的闪点。闪点比着火点的温度低些。可燃性液体的闪点和着火点表示其发生爆炸或火灾的可能性大小,这对可燃性液体的运输、储存和使用的安全等有极大的关系。
[闪燃点]见闪点条。
[缓慢氧化]是氧化反应的一种形式。反应过程比较缓慢,不象燃烧那样剧烈地放热发光。例如铁生锈、呼吸作用、食物的腐败等,都是缓慢氧化的实例。
[自燃]由缓慢氧化而引起的自发燃烧。可燃物在缓慢氧化过程里也产生热量,在某种情况下热量不易散失,以致越积越多,温度逐渐升高,达到那种可燃物的着火点时不经点火就会自发地燃烧起来。例如稻草、麦杆、煤屑、沾有油的布等大量堆积在不通风的地方都有可能自燃。
[爆炸]物质发生的变化不断急剧增速并在极短时间内放出大量能量的现象。爆炸主要由化学反应或核反应所引起。爆炸发生时,温度和压力突然升高,产生爆破作用或推动作用。爆炸广泛应用于开矿、筑路、推动发动机等。某些可燃物在有限空间里发生急速燃烧的时候,常会发生爆炸。所以油库附近和面粉工厂都严禁烟火。
[爆炸极限]指一种可燃气体、蒸气或粉末和空气的混和物能发生爆炸的浓度范围。例如空气中混有氢气、汽油蒸气、面粉等时,在一定浓度范围内,遇到火花就会使火焰蔓延而发生爆炸。其最低浓度称为下限(或低限),最高浓度称为上限(或高限),浓度低于或高于这一范围,都不会发生爆炸。爆炸极限通常用可燃性物质在爆炸混和物中体积百分比表示,例如氢气的爆炸极限为4.1-74.2%,4.1%为下限,74.2%为上限。有时也用每立方米混和物中所含可燃性物质的质量(克)来表示,这种表示方法,大多用于可燃性粉尘的爆炸极限,例如铝粉的爆炸极限为40克/米3,这是铝粉的爆炸下限,一般不计可燃性粉尘的爆炸上限。
[火焰]可燃性气体燃烧时所发生的现象。是燃烧的一种特殊情况,火焰是指气态可燃物在燃烧时形成的一个发光、放热的区域。液态或固态可燃物在燃烧时,如能先变成气体,燃烧时也会有火焰生成。火焰可分为三个部分:(1)内层,带蓝色,因供氧不足,燃烧不完全,温度低,有还原作用,称为内焰或还原焰;(2)中层,明亮,温度较内层高;(3)外层,无色,因供氧充足,燃烧完全,温度最高,有氧化作用,称为外焰或氧化焰。对有灯芯的火焰,如蜡烛和酒精灯火焰则可分为:(1)焰心,中心黑暗部分,由能燃烧但还未燃烧的气体(蒸气)所组成;(2)内焰,包围焰心的最明亮部分,是气体未完全燃烧的部分,含有碳粒子(或其它固体粒子),被灼热发出强光,并有还原作用,也称还原焰;(3)外焰,最外面几乎无光的部分,是气体完全燃烧的部分,含有过量而强热的空气,有氧化作用,也称氧化焰。
[氧化焰]见火焰条。
[还原焰]见火焰条。
[吸附]固体或液体表面对气体或溶质的吸着现象。由于分子间作用力相互作用而产生的吸附为物理吸附,如活性炭对气体的吸附。物理吸附一般在常温下发生,吸附速度快,吸附热小,吸附无选择性。由于化学键的作用而产生的吸附为化学吸附,如镍催化剂吸附氢气,化学吸附有化学键的破坏与生成,放出的吸附热较大,所需的活化能也较大,化学吸附需在高温下进行,并有选择性。
[物理吸附]见吸附条。
[化学吸附]见吸附条。
[吸附质]被吸附剂所吸附的物质。例如,在制糖工业中,常利用活性炭的吸附作用来脱色,被吸附的有色物质即为吸附质。
[吸附剂]通常指对气体或溶液中的微粒具有吸附作用的固体物质。一般要求具有较大的吸附表面和选择性吸附的能力。如活性炭、硅胶、活性氧化铝、硅藻土等都是常用的吸附剂。明矾水解生成的氢氧化铝胶体,也可看作是吸附剂。
[解吸]是与气体的吸附或吸收相反的过程。如用活性炭吸附二氧化氮后,当加热或降低压力时可使二氧化氮逸出。
[风化]在室温和比较干燥的空气里,结晶水合物失去一部分或全部结晶水,使原有结晶形状转变或破坏的一种现象。例如,在室温时,碳酸钠晶体(Na2CO3·10H2O)放在干燥空气里,会逐渐失去结晶水变成粉末。
[潮解]某些晶体自发地吸收空气里的水蒸气,在其表而逐渐形成饱和溶液的现象。例如无水氯化钙、氯化镁和固体氢氧化钠在空气中潮解。潮解是由于该化合物饱和溶液的蒸气压低于同温下空气中的水蒸气的分压。因而不断吸收水分而潮解。
[结晶水]许多物质从水溶液中形成晶体析出时,晶体里常结合一定数目的水分子。这样的水分子叫做结晶水。如胆矾(CuSO4·5H2O)中就含有结晶水。
[结晶水合物]含有结晶水的物质叫做结晶水合物。又称水合物、水化物。如绿矾(FeSO4·7H2O)、二水合硫酸(H2SO4·2H2O)、六水合氯化铁(FeCl3·6H2O)等。除水合离子外,结晶水合物大多是晶态物质。结晶水合物在受热时会失去结晶水,并有显著的吸热效应。
[重结晶]又称再结晶。将晶体溶解或熔化,然后又重新从溶液或熔体中结晶出来的过程。重结晶可减少或除去晶体中的可溶性杂质,是提纯物质的一种重要方法。重结晶还可以细化晶粒,是改变某些金属和合金的晶体结构以改善其性能的一种方法。
[再结晶]见重结晶条。
[沉淀]由于化学反应而生成溶解度较小的物质从溶液中析出的过程。也指沉淀过程中析出的固体物质。在化学实验和生产实践中广泛地应用沉淀方法进行物质的分离。例如沉淀法是定量分析中的一种重要的分离方法。
[陈化]沉淀析出以后,让初生的沉淀与原溶液在一起继续放置一段时间的过程。经过陈化作用,可以使微小的晶体溶解,而较大的晶体长得更大,使沉淀颗粒变大,易于过滤,而且变得较为纯净,但是,当溶液中有混晶共沉或伴随有后沉淀时,则不一定能提高沉淀的纯度。
[过滤]一种分离含有不溶性固体的液体或气体混和物的操作。一般用普通玻璃漏斗、布氏漏斗、热过滤漏斗做为过滤器,用滤纸、滤布、砂层做为过滤介质,将混和物进行过滤,得到的澄清液体称滤液,留在过滤介质上面的固体颗粒叫滤渣。有常压过滤、减压过滤和热过滤等方法。过滤在科研与生产中有广泛的应用。
[蒸馏]利用液体混和物中各组分的沸点不同,以分离各个组分、纯化物质的一种操作。将混和物加热至沸腾,使其中某种组分气化,然后将其蒸气冷凝为液体。蒸馏可使原混和物中各组分得到部分或完全分离。蒸馏的方法很多,有简单蒸馏、真空蒸馏、精馏、恒沸蒸馏等。主要用于物质的精制和混和物的分离。例如清除天然水中的杂质制取蒸馏水等。
[蒸发]在液体表面发生的气化现象。在任何温度下都能进行蒸发。蒸发时,液体必须从其周围吸收热量,所以温度愈高,蒸发愈快。各种液体的挥发度不同,因而在相同条件下,各种液体的蒸发速度不同,例如乙醇的蒸发速度比水快,海水中水的蒸发速度比淡水慢。在生产中,蒸发是指在对溶液加热过程中,一部分溶剂气化,使溶液浓缩或使溶质析出晶体的过程。蒸发的必需条件是不断地供给热能和不断地排除气化了的蒸气。为了加快蒸发的速度,可采用沸腾蒸发、减压蒸发等。
[分馏]又称精馏,是蒸馏方法的一种。在一个设备内同时进行多次部分气化和部分冷凝,以分离液体混和物的组分。适合于沸点相差很小的互溶的两种或两种以上的液体组分所组成的混和物的分离,例如石油的分馏。操作时,使液体混和物在蒸馏釜中加热蒸发,蒸气进入分馏塔,部分冷凝回流,使与从蒸馏釜连续上升的蒸气密切接触,可得到与重复简单蒸馏若干次相当的效果,从而提高了各组分的分离程度。分馏可同时得到几种馏出液。
[干馏]固体燃料的热化学加工方法之一。如煤、木材、油页岩等在隔绝空气下加热,使之分解生成固态的焦炭、液态的焦油和气态的煤气等产物。根据加热的最终温度,一般可分为高温干馏(约900-1100℃)、中温干馏(约660-750℃)和低温干馏(约500-580℃)。
[稀释]加溶剂于溶液中以降低溶液浓度的过程。稀释时常有放热或吸热现象发生,称为稀释热。
[浓缩]减少溶液中溶剂的量以提高溶液浓度的过程。浓缩是常用的脱水作业之一。有时,在浓缩过程中,液体中的溶质析出发生沉淀,以利于进一步的脱水(过滤或干燥)。
[脱水]从物质中除去水分的过程。一般有三种不同的方式:(1)除去或降低物料中的不定量的水分,例如食物的脱水。(2)除去结晶水合物中的结晶水,例如胆矾加热得到无水硫酸铜和水。(3)在脱水剂或催化剂存在下,使化合物分子中(或分子间)的羟基和氢原子以水的形式脱去,例如乙醇在浓硫酸作用下,加热到140℃生成乙醚和水,加热到160℃以上生成乙烯和水。
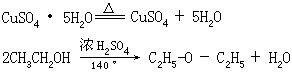

[脱水性]能使有机化合物分子中的羟基与氢原子以水分子形式脱去的性质。例如浓硫酸与甲酸混和加热时,甲酸脱水生成一氧化碳和水,因此浓硫酸有脱水性。
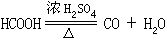
[吸水性]能除去或减少物质中所含不定量的湿存水的性能。例如浓硫酸、碱石灰能吸收空气中的水分,因此浓硫酸具有吸水性。
[干燥]指除去附在固体、气体或混在液体内的游离水(或溶剂)的过程。可采用干燥剂、加热、减压等方式来干燥。
[干燥剂]能吸收潮湿物质中不定量的湿存水的物质。通常有两类:(1)化学干燥剂,吸收水分时伴随有化学反应发生,如无水氯化钙、浓硫酸、碱石灰等。(2)物理干燥剂,吸收水分而无化学反应发生,如硅胶吸收空气中的水分。不同干燥剂的干燥能力不同,测定办法是:先把被水蒸气饱和的空气在25℃时以1-3升/小时的速度通过定量的干燥剂,然后再测定被干燥的空气中剩余水分的含量,剩余的水分越少,说明干燥剂的吸水性越好。
[萃取]利用不同的物质在选定的溶剂中溶解度的不同,分离混和物中的组分的方法。习惯上指用溶剂分离液体混和物中的组分,即液-液萃取(又叫溶剂萃取);也可用溶剂分离固体混和物中的组分,即固-液萃取(又叫浸取)。液-液萃取是定量分析中分离方法的一种,主要用于元素的分离和富集。
[萃取剂]萃取所用的溶剂。必须具备对液体或固体混和物中的组分具有选择性溶解的能力。同时应具有较好的热稳定性和化学稳定性,以及较小的腐蚀性和毒性。例如,碘的水溶液用四氯化碳萃取,极大部分的碘进入四氯化碳层而与其它物质分离。四氯化碳为萃取剂。
[分配定律]溶质同时分别溶解在两种互不相溶或几乎互不相溶的混和液体中,它在两种液体中的浓度比等于它在两种液体中的溶解度之比。利用这个规律可以用一种溶剂把另一种溶液中的溶质萃取出来。如用跟水不相溶的四氯化碳作溶剂,可以从碘水中把碘萃取出来。
[凝华]气态物质不经过液态而直接凝结为固态的过程。如水蒸气能直接凝结于物体表面成为霜,硫蒸气遇冷直接生成硫华。凝华时有热量放出。
[升华]固体不经过液态直接转变成为气态的过程。在三相点以下的任何温度,当外界压力低于该物质平衡蒸气压时,固体就会升华。例如,在气温低于0℃时(水的三相点为0.01℃),空气中水蒸气的分压低于其平衡蒸气压,冰或雪就会因为升华而消失。又如,碘的三相点为115℃,三相点的蒸气压为12kPa,故碘很容易升华,将碘晶体放在试管中微热,即可看到紫色碘蒸气生成。但如加热温度高于115℃(碘的三相点)时,固体碘就会熔化。
[钝化]某些金属经化学方法(如跟强氧化剂反应)或电化学方法(如阳极氧化)处理,由活泼态变为不活泼态(即钝态)的过程。由于钝化后,金属表面形成致密的氧化物保护薄膜,因而不易腐蚀。例如,铁能溶于稀硝酸,但铁在浓硝酸中浸过后,因铁钝化不再溶于稀硝酸。
[化学腐蚀]由于金属跟它周围的物质直接起化学反应,从而造成金属被腐蚀的过程。在化学腐蚀中,跟金属起化学反应的多是氧气、硫化氢、二氧化硫等气体,生成相应的氧化物和硫化物等。有些金属,由于化学腐蚀的结果常在表面上形成一层致密的薄膜,从而保护了金属不再继续被腐蚀。如铝在空气中很快被氧化,表面形成一层致密Al2O3薄膜,起到了保护金属的作用。
[气焊]使乙炔(或其它可燃气体)在氧气不足的情况下燃烧:
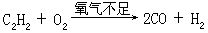
产生具有还原性的一氧化碳和氢气,它们继续与氧化合产生二氧化碳与水,伴随着产生高温,使金属焊条熔化填满缝隙而使金属焊接起来。火焰的还原性对焊接金属极为有利,防止在焊接时金属被氧化,使焊缝被氧化物沾污而造成焊接不牢的现象发生。
[气割]利用氧炔焰加热时使用过量的氧气,让熔化的金属进而被氧化,在工作物上形成一条割缝,从而将金属割断。过量的氧气是从附加的另外一个氧气吹管里吹出的。
[固氮]使空气中游离的氮气转变为含氮化合物的过程。如工业上在高温、高压和催化剂作用下,将氮气和氢气合成氨;土壤中的固氮菌在常况下,靠固氮酶的作用,将空气中的氮还原为氨;自然界的雷电作用使氮气转化为一氧化氮,并进一步氧化为二氧化氮等。科学上关于模拟生物固氮的研究,将为人工固氮开辟新途径。
[漂白]除去纤维纺织材料和纸浆等中所含有色物质的过程。通常是氧化作用,有时是还原等其它作用。漂白棉、麻、人造纤维和纸浆时,一般用漂白粉、漂白精、次氯酸钠、亚氯酸钠和过氧化氢等。漂白蚕丝和羊毛,可用过氧化氢,有时也用二氧化硫,但漂得的白色物质不够稳定,容易发黄。对油脂的漂白通常采用漂白土,其实质是吸附脱色作用,也称为漂白。
[光化反应]见光化作用条。
[光化作用]又称光化反应。物质由于光(一般为可见光或紫外线)的作用而引起的化学反应。例如,碳水化合物的合成,染料在空气中褪色,胶体的感光作用等,范围很广泛,可能是化合、分解、氧化-还原等化学反应,主要分光合作用和光解作用两类。
[光合作用]光化作用的一种。一般指二氧化碳和水,在日光照射下,借植物叶绿素的帮助,吸收光能合成碳水化合物的过程。可以表示如下:
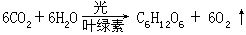
有时也包括在光的作用下,合成蛋白质、脂肪等有机物的过程。
[光解作用]光化作用的一种。物质由于光的作用而分解的过程。例如碘化氢在紫外线的照射下,吸收光能分解成碘和氢气,卤化银、浓硝酸见光分解等。
[蜕变]原子核自发地放射出一个α或β粒子、同时自身转变为另一种原子核的过程。常称为α衰变或β衰变。
[核反应]某种微观粒子与原子核相互作用时,使核的结构发生变化形成新原子核,并放出一个或几个粒子的过程。重核可以发生裂变。历史上第一个人工核反应是由卢瑟福在1919年实现的,他用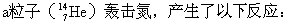
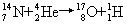
现在利用各种加速器和原子反应堆,已经实现了上万种核反应,由此获得千余种放射性同位素和各种分子、超子、反质子、反中子等基本粒子。任何核反应都遵从能量、动量、质量和电荷等守恒定律。这方面的研究对于了解原子核的结构,基本粒子间的相互作用,以及探索新的能源等方面都有重大意义。
[裂变]质量较大的重核分裂为两个质量相近的中等质量核的同时,还可能放出中子的过程。因重核的核子平均结合能比中等核的核子结合能小,所以上述过程将释放出一部分结合能。裂变有自发和人工两种。前者是重核不稳定的表现,但由于半衰期长,释放功率小。例如铀238的半衰期为1016年,故其释放的能尚无实用价值。人工裂变的反应速度可以控制,所释放的原子能可以利用。原子反应堆即为一种能源设施。
[聚变]质量较小的核聚合成质量较大的核,同时放出光子的过程。因为轻核的核子平均结合能比质量较重核的核子平均结合能大,所以上述过程将释放出一部分结合能。聚变有自发和人工两种。由于参与发生聚变反应的轻核必须相互接近到核力作用范围以内,在自然条件下,如太阳等恒星内部的温度极高,轻核具有足够大的动能以克服库仑斥力使聚变得以持续进行。在人工条件下,聚变可在爆炸或高能粒子碰撞中实现。人工控制的核聚变过程尚处在研究阶段。
[热核反应]在极高温度下进行的核聚变反应。当聚变材料达到极高温度时,聚变反应可自动进行,从而得到可以利用的能量,太阳和其它恒星中进行着热核反应。氢弹爆炸是人工热核反应。受控热核反应正在研究阶段。
[元素]又称化学元素。具有相同核电荷数(即相同质子数)的同一类原子的总称。现在已经发现108种元素,其中包括22种非金属元素和86种金属元素,金属元素与非金属元素的区分是相对的,一些非金属元素也具有类金属(半金属)的性质。元素的最小单位是原子。大多数元素都有同位素,这是由于原子核内的中子数不同引起的,如氢由质量数为1、2和3的三种同位素组成。在1940年以前,元素周期表中铀以后的元素(超铀元素)是不存在的,都是以后由人工合成的放射性元素。在自然界里元素以游离态和化合态两种形式存在,但大部分是以化合态存在的。
[化合态]元素以化合物存在的形态。如水中氢元素和氧元素都是化合态的。
[游离态]元素以单质存在的形态。如氧气中的氧元素是游离态存在的。
[纯净物]由一种单质或一种化合物组成的物质。纯净物具有固定的组成、结构和性质,例如纯净的水无色透明、无味。密度是1克/厘米3,熔点0℃,沸点100℃。自然界里纯净物极少,根据生产和科学实验的要求,可按物质不同性质进行提纯。实际上绝对纯的物质是不存在的,凡含杂质的量不至于在生产和科学实验过程中发生有害影响的物质,就当作纯净物,如作半导体材料的高纯硅,其纯度为99.999999999%,也不是完全纯净的。因此,纯净物一般是指含杂质很少具有一定纯度的物质。
[混和物]由几种不同的单质或化合物通过机械混和而成的物质。混和物没有固定的组成,混和物中各成分仍保持各自原有的性质,可以利用混和物中所含各成分的不同物理性质进行分离,例如空气中所含的氮气、氧气、惰性气体等可利用它们的沸点不同而分离开来。
[单质]由同种元素组成的纯净物。单质不可能再分解成两种或两种以上的不同物质。例如氧气(O2)、磷(P4)、铁(Fe)、银(Ag)等。单质和元素是两个不同的概念,元素是具有相同核电荷数的同一类原子的总称,元素以游离态存在时为单质,有些元素可以形成多种单质,例如碳元素可以形成金刚石、石墨和无定形碳等多种单质。根据单质的不同性质,一般单质可分为金属和非金属两大类。
[同素异形体]见同素异性体条。
[同素异性体]同一种元素组成的不同性质的单质互称同素异性体。形成同素异性体原因有三类:组成分子的原子数目不同形成的同素异性体,如O2和O3;晶体中原子的排列方式不同形成的同素异性体,如金刚石和石墨;晶体中分子的排列方式不同形成的同素异性体,如斜方硫和单斜硫。其中晶体的同素异性体也称同素异形体。
[化合物]由不同种元素组成的纯净物。化合物具有固定的组成并具有一定的性质。化合物从成分上可分为有机物和无机物两大类,从构成化合物的化学键又可分为离子化合物和共价化合物两大类。
[无机物]是无机化合物的简称,通常指不含碳元素的化合物。但少数含碳的化合物,如一氧化碳、二氧化碳、碳酸盐、氰化物等也属无机物。无机物大致可以分为氧化物、碱、酸和盐四大类。
[有机物]是有机化合物的简称。指含碳元素的化合物。组成有机物的元素除碳以外,通常还含有氢、氧、氮、硫、磷、卤素等。以前,把动植物等有机体中取得的糖类、蛋白质、油脂等物质叫有机物,到19世纪20年代,科学家先后从非生物体内取得的物质合成了许多有机物,如尿素、醋酸等,从而打破了有机物只能从有机体中取得的概念,但习惯上一直沿用有机物这个名称。有机物一般难溶于水而易溶于有机溶剂;熔点低;绝大多数有机物受热容易分解,而且容易燃烧;有机物的化学反应比较慢,并常伴有副反应发生。有机物一般可以分为烃和烃的衍生物两大类,因此有机物也就是烃和烃的衍生物的总称。
[金属]由金属元素组成的单质。具有金属光泽、不透明、有延性和展性、有良好的传热性和导电性的一类物质。在金属晶体中有中性原子、阳离子和自由电子,金属具有上述性质,都与晶体中存在自由电子有关。常温下除汞外,都以固态形式存在。化学性质一般表现较强的还原性,由于金属元素原子的价电子较少,原子半径较大,在反应中容易失去价电子成为阳离子的缘故。工业上通常把金属分为黑色金属和有色金属两大类。有色金属又可分成轻金属、重金属、贵金属和稀有金属等。
[非金属]由非金属元素组成的单质。非金属一般没有金属光泽,不是电和热的良导体,没有延性和展性。在通常情况下,非金属有的是固体,有的是气体,只有溴是液体。非金属固体大多数是分子晶体,硬变小,熔点、沸点较低,但有的非金属固体属原子晶体,如金刚石、晶体硅等,它们的硬度大,熔点、沸点较高。非金属元素的原子价电子较多,原子半径较小,在化学反应中倾向于得到电子。大多数非金属既具有氧化性,又具有还原性。金属与非金属没有严格界限,位于周期表P区左上到右下对角线附近的元素,如硼、硅、锗、砷、锑、碲等既具有非金属的性质,又具有金属的性质,可把这些元素的单质称为准金属或半金属。
[惰性气体]又称稀有气体,系周期系中零族元素,包括氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)和放射性元素氡(Rn)等六种元素。无色、无臭、无味,微溶于水,溶解度随分子量增大而增加。均为单原子分子。通常在化学性质上表现出惰性,至今已制出氙的稳定化合物,如XeF2、XeF4等,氪也可能形成类似氙的化合物,如KrF2,但不很稳定,它仅能在-30℃时存在。其它稀有气体的化合物尚未制出。这些气体存在于大气之中,约为空气的1%(体积),主要是氩,其它的很少。可以从液态空气分馏时制得。氡是放射性元素镭(Ra)蜕变时的产物,也叫镭射气。
[黑色金属]通常是指铁、铬、锰和铁的合金(主要指钢铁)。在各种金属中,铁在地壳中分布较集中,储量较丰富,开采和冶炼较多,价格也较廉。铸铁和钢的品种和规格很多,它们是工业上最广泛应用的金属材料,在国民经济中占有极重要的地位。铬与锰主要应用于制合金钢。铁、铬、锰及其合金都不是黑色的,而钢铁表面经常覆盖着一层黑色的四氧化三铁。这样分类,主要是从钢铁在国民经济中的重要地位出发的。
[有色金属]通常是指除铁、铬、锰和铁的合金以外的其它金属。可分为四类:(1)重金属,如铜、锌、铅、镍等。(2)轻金属,如钠、钙、镁、铝等。(3)贵金属,如金、银、铂、铱等。(4)稀有金属,如锗、铍、镧、铀等。
[重金属]一般是指密度在4.5克/厘米3以上的金属。例如铜、锌、钴、镍、钨、钼、锑、铋、铅、锡、汞等,过渡元素大都属于重金属。也有把密度在5克/厘米3以上的金属称为重金属的。
[轻金属]一般是指密度在4.5克/厘米3以下的金属。例如钠、钾、镁、钙、铝等。周期系中第一、二主族均为轻金属。也有把密度在5克/厘米3以下的金属称为轻金属的。
[贵金属]通常是指金、银和铂族金属(包括钌、铑、钯、锇、铱、铂)。这些金属在地壳中含量较少,不易开采,价格较贵,所以叫贵金属。这些金属对氧和其它试剂较稳定,金和银常用来制造装饰品和硬币。
[稀有金属]通常是指自然界中含量较少,比较分散的金属。它们难于从原料中提取,在工业上制备及应用较晚。稀有金属和普通金属没有严格界限,某些稀有金属比铜、汞、镉等金属还多。稀有金属在现代工业中具有重要的意义,往往把黑色金属、有色金属和稀有金属并列为三大类。稀有金属根据其在地壳中的分布状况及冶炼方法,可分为六类:(1)稀有轻金属,如锂、铷、铯、铍、钛等。(2)稀有难熔金属,如钨、钼、铌、钽、铪、钒等。(3)稀有分散金属(或称稀散金属),如镓、铟、铊、锗等。(4)稀土金属,包括钪、钇和镧系元素。(5)稀有贵金属,指铂族元素。(6)稀有放射性金属:包括钋、钫、镭、锕、钍、镤、铀以及从1940年以来陆续发现的十多种人造放射性元素。
[合金]由一种金属跟另一种或几种金属或非金属所组成的具有金属特性的物质叫合金。一般由各组分熔合成均匀的液体,再经冷凝而制得。按组成合金的元素数目的多少,有二元合金,三元合金和多元合金之分;按其结构的差异,又可分为共熔混和物、固溶体和金属互化物三类。一般说来,合金的熔点都低于组成它任何一种成分金属的熔点,例如用作电源保险丝的武德合金(由锡、铋、镉、铅四种金属按1∶4∶1∶2的质量比组成),熔点只有67℃,比组成它的四种金属的熔点都低。合金的硬度一般比组成的的各成分金属的硬度大,例如青铜的硬度比组成它的铜和锡的硬度都大。“齐”也是合金的意思,把含汞的合金常叫汞齐,例如钠和汞组成的合金叫钠汞齐。
[共熔混合物]合金的一种,当由金属组成的共熔的混和物凝固时,各组分分别结晶而形成的合金,例如铋镉合金与焊锡等。
[固溶体]由几种不同的化学组分所组成的均匀晶体。通常以一种物质为溶剂,在固态下溶有其它物质(溶质)的原子或分子而形成的晶体。在合金和硅酸盐系统中较多见。主要有两种类型,一是间隙固溶体,即由溶质原子溶于溶剂晶格中原子之间的间隙中而形成的,如碳溶于铁水形成的固溶体;另一是置换固溶体,即由溶质原子代替溶剂晶体中的原子而形成的,如铜溶于镍中形成的固溶体。以金属为主体形成的固溶体是合金的一种。
[金属互化物]是金属间化合物的简称。在一定条件下,金属之间相互化合而成的化合物。例如Cu3Al、CuZn3、Cu3Sn、Ag3Al、FeZn7等,金属互化物的组成并不固定,可以在一定范围内变动。例如Cu5Zn8中的锌的含量可在59-67%之间变动。大多数金属互化物是以金属键相结合,故组成元素的化合价无法确定。它是合金的一种,这类合金的传热和导电性能比组分金属低,有的具有很高电阻,通常硬而脆。
[半金属]又称准金属。介于金属与非金属之间的单质。如硼、硅、锗、砷、锑、硒、碲等。组成这些单质的元素在元素周期表中P区左上到右下的对角线附近。半金属一般为半导体。它们的导电性与金属不同,一般随温度的升高而增强。半金属在电气、冶金等方面有广泛的应用。
[准金属]见半金属条。
[氢化物]氢跟其它元素组成的二元化合物。例如氢化钠、硫化氢、硼烷等。按其结构大致可分成三种类型:(1)离子型氢化物(又称盐型氢化物),碱金属及碱土金属钙、锶、钡能跟氢气在高温下直接反应生成如NaH、CaH2等。在反应过程中氢夺取金属原子的价电子形成带1个单位负电荷的离子H-。这类氢化物都是离子晶体,具有较高的熔点,在熔融状态下能够导电,跟氯化钠相似。(2)共价型氢化物(又称分子型氢化物),如HCl、H2S、NH3、CH4等都属于分子晶体,熔点、沸点较低。这类氢化物中有些具有酸性,如HCl、H2S,少数具有碱性,如NH3,另一些为中性,如CH4。(3)金属型氢化物(又称间充氢化物),如氢化钯是金属钯晶格中间充入体积很小的氢原子而成的,无固定组成,金属吸氢后仍保持金属的特性,具有类似合金的结构,所以也称合金型氢化物。
[氧化物]氧元素跟其它元素形成的二元化合物。如氧化钙、二氧化硫、一氧化氮等。氧化物可分为不成盐氧化物(如一氧化碳、一氧化氮等)和成盐氧化物两类,后者又分为碱性氧化物(如氧化钙)、两性氧化物(如氧化铝)和酸性氧化物(如二氧化碳)。此外还有过氧化物、超氧化物、臭氧化物等。同一种元素往往有几种不同价态的氧化物,如SO2和SO3;FeO、Fe2O3和Fe3O4等。有时氧化物的含义更广泛,不限于含氧元素的二元化合物,如多元氧化物(如NiFe2O4)和有机氧化物(如氧化乙烯C2H4O2,即环氧乙烷)等。
[不成盐氧化物]又称惰性氧化物或中性氧化物。是既不能跟酸起反应,又不能跟碱起反应的氧化物,如CO和NO等。
[惰性氧化物]见不成盐氧化物条。
[中性氧化物]见不成盐氧化物条。
[碱性氧化物]能跟酸起反应,生成盐和水的氧化物。金属氧化物大多数是碱性氧化物,如氧化钙、氧化铜等。碱性氧化物对应的水化物是碱,例如CaO对应的水化物是Ca(OH)2,CuO对应的水化物是Cu(OH)2等,多数碱性氧化物不能直接跟水化合,有些碱性氧化物如CaO能跟水化合生成碱。
CaO+H2O=Ca(OH)2
碱性氧化物一般由金属直接氧化或难溶性碱、含氧酸盐受热分解制得。
[两性氧化物]既能跟酸起反应生成盐和水,又能跟碱起反应生成盐和水的氧化物。例如氧化铝、氧化锌等,某些过渡元素的中间价态的氧化物,如Cr2O3和Mn2O3等也是两性氧化物。两性氧化物对应的水化物是两性氢氧化物。
[酸性氧化物]能跟碱起反应,生成盐和水的氧化物。非金属氧化物多数是酸性氧化物,某些过渡元素的高价氧化物(如CrO3、Mn2O7等)也是酸性氧化物。酸性氧化物也叫酸酐,例如SO3叫硫酐,CO2叫碳酐。酸性氧化物对应的水化物是含氧酸,如SO3对应的水化物是H2SO4,CO2对应的水化物是H2CO3,SiO2对应的水化物是H2SiO3等。酸性氧化物多数能跟水直接化合生成含氧酸,少数酸性氧化物(如SiO2)不能直接跟水反应。酸性氧化物一般由非金属直接氧化或含氧酸、含氧酸盐受热分解制得。
[酸酐]简称酐。通常把由酸缩水而成的化合物称作酸酐。例如三氧化硫SO3为硫酐,可看作H2SO4分子缩去一个分子水而成;五氧化二磷(P2O5)为磷酐,可看作两个H3PO4分子缩去三个水分子而成;醋(酸)酐(CH3CO)2O,可以看作由两个醋酸CH3COOH分子缩去一个分子水而成。酸性氧化物也叫酸酐,但酸酐不一定是氧化物,例如醋酐。
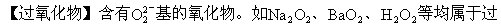
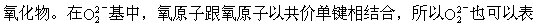
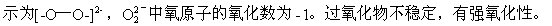 过氧化物能跟酸反应制取过氧化氢。
过氧化物能跟酸反应制取过氧化氢。
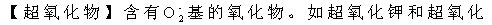
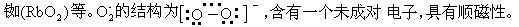
 适用于高空飞行或其它需要携带氧气的地方。
适用于高空飞行或其它需要携带氧气的地方。
 等,只有碱金属元素能形成臭氧化物。性质极不稳定,在常温下能自动分解,是一种极强的氧化剂。
等,只有碱金属元素能形成臭氧化物。性质极不稳定,在常温下能自动分解,是一种极强的氧化剂。
[酸]电解质电离时所生成的阳离子全部是氢离子(H+)的化合物。它能和碱或碱性氧化物反应生成盐和水,能与某些金属反应生成盐和氢气,水溶液有酸味并能使指示剂变色,如紫色石蕊变红。根据酸分子中可被金属原子置换的氢原子数目,可分为一元酸(如HCl)、二元酸(如H2SO4)、多元酸(如H3PO4)等。根据酸在水溶液中产生氢离子程度的大小(即电离度的大小),可分为强酸(如HCl、H2SO4、HNO3、HClO4等)和弱酸(如H2CO3、H2S等)。根据酸根的组成成分又可分为含氧酸(如H2SO4)和无氧酸(如HCl)。此外,根据酸碱的质子理论和电子理论,还有质子酸和路易斯酸等,因而使得“酸”这个概念包括的范围极为广泛,而且又赋予它新的含义。
[酸根]酸分子里,除去在水溶液中能够电离生成的氢离子,余下的部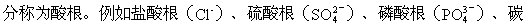
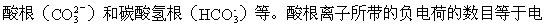 离时产生氢离子的数目。
离时产生氢离子的数目。
[一元酸]见酸条。
[二元酸]见酸条。
[多元酸]见酸条。
[含氧酸]见酸条。
[无氧酸]见酸条。
[多酸]亦称聚多酸或缩多酸。两个以上的酸分子缩去水分子而成的酸,也可以看作是含有两个或多个酸酐的酸。含有相同的酸酐时称为同多酸(如焦硫酸H2S2O7),对应的盐称为同多酸盐(如焦硫酸钠Na2S2O7)。元素周期表中的ⅤB和ⅥB族元素是以最容易形成多酸为其特征的。含有不同的酸酐时称为杂多酸,如12-钨磷酸H3[P(W12O40)]·xH2O,对应的盐称为杂多酸盐,如12-钨磷酸钠Na3[P(W12O40)]。
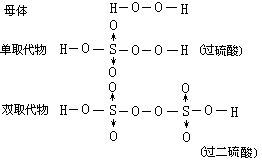
[过氧酸]简称过酸。分子中含有过氧基(-O-O-)的酸。例如过硫酸H2SO5和过二硫酸H2S2O8等。过氧酸可以看成是H2O2中的氢原子被酸根取代的产物,有如下的衍生关系。
[碱]电解质电离时所生成的阴离子全部是氢氧根离子(OH-)的化合物。例如NaOH、Ca(OH)2、NH3·H2O等。能跟酸性氧化物或酸反应生成盐和水,碱的水溶液有涩味,可使紫色石蕊试液变蓝。根据碱的电离程度,可以分为强碱(如NaOH、Ca(OH)2)和弱碱(如NH3·H2O)。根据碱电离时产生的氢氧根离子的数目可分为一元碱(如NaOH)、二元碱(如Ca(OH)2)、多元碱(如Fe(OH)3)等。此外,根据酸碱的质子理论和电子理论,还有质子碱和路易斯碱,因而使得“碱”这个概念包括的范围极为广泛,而且又赋予它新的含义。
[一元碱]见碱条。
[二元碱]见碱条。
[多元碱]见碱条。
[苛性碱]碱金属氢氧化物的总称。一般指的是苛性钠(NaOH)和苛性钾(KOH)。由于它们对皮肤、羊毛、纸张、木材等具有强烈的腐蚀性而得名。
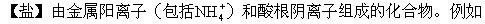 NaCl、(NH4)2SO4、Cu2(OH)2CO3、KHCO3等。在常温时,盐一般为晶体。它们在水中的溶解性各不相同,钾盐、钠盐、硝酸盐和铵盐很容易溶解;有些盐很难溶解,如AgCl和BaSO4等。铵盐和碳酸盐、硝酸盐、亚硝酸盐、重铬酸盐、高锰酸盐等含氧酸的盐稳定性较差,受热时可以分解。大多数盐是强电解质,其水溶液或熔液能够导电。但有些盐(如HgCl2)的水溶液几乎不导电,它在水溶液中主要以分子状态存在。根据组成的不同,盐可以分为无氧酸盐、含氧酸盐、正盐、酸式盐、碱式盐、复盐、络盐等。
NaCl、(NH4)2SO4、Cu2(OH)2CO3、KHCO3等。在常温时,盐一般为晶体。它们在水中的溶解性各不相同,钾盐、钠盐、硝酸盐和铵盐很容易溶解;有些盐很难溶解,如AgCl和BaSO4等。铵盐和碳酸盐、硝酸盐、亚硝酸盐、重铬酸盐、高锰酸盐等含氧酸的盐稳定性较差,受热时可以分解。大多数盐是强电解质,其水溶液或熔液能够导电。但有些盐(如HgCl2)的水溶液几乎不导电,它在水溶液中主要以分子状态存在。根据组成的不同,盐可以分为无氧酸盐、含氧酸盐、正盐、酸式盐、碱式盐、复盐、络盐等。
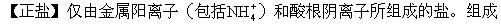 中既不含可以电离的氢原子,又不含氢氧根离子。正盐可以看作酸与碱完全中和的产物。但正盐的水溶液不一定都是中性的,如果该盐可以水解,溶液一般不显中性,例如Na2CO3溶液呈碱性,(NH4)2SO4溶液呈酸性。
中既不含可以电离的氢原子,又不含氢氧根离子。正盐可以看作酸与碱完全中和的产物。但正盐的水溶液不一定都是中性的,如果该盐可以水解,溶液一般不显中性,例如Na2CO3溶液呈碱性,(NH4)2SO4溶液呈酸性。
[酸式盐]由金属阳离子和含有可以电离的氢原子的酸根阴离子所组成的盐。例如NaHCO3、NaH2PO4等。酸式盐可以看作是多元酸中能电离的氢原子部分被中和的产物。酸式盐一般可由多元酸跟适量的碱或盐反应而得到,例如:
NaOH+H2S=NaHS+H2O
NaCl+H2SO4(浓)=NaHSO4+HCl↑
某些盐水解也可以生成酸式盐,例如:

酸式盐的水溶液不一定显酸性,如NaHCO3、Na2HPO4的水溶液呈碱性。
[碱式盐]除金属阳离子和酸根阴离子外,还含有一个或几个氢氧根的盐。例如Cu2(OH)2CO3、Mg(OH)Cl等。碱式盐可看作是多元碱中的氢氧根部分被中和的产物。有些碱式盐脱水后的产物也可称为碱式盐,如碱式氯化铋(BiO)Cl、碱式碳酸铋(BiO)2CO3等。碱式盐可以由多元碱跟适量酸反应来制取,例如,
Ba(OH)2+HCl=Ba(OH)Cl+H2O
某些盐水解也可以产生碱式盐,例如,
SnCl2+H2O=Sn(OH)Cl↓+HCl
[复盐]又称重盐。两种或两种以上的不同的盐类所组成的晶形化合物。例如,明矾[KAl(SO4)2·12H2O]、硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]等。复盐溶于水电离出的离子跟组成它简单盐所电离出的离子相同。例如:
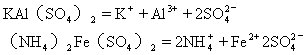
[重盐]见复盐条。
[氢氧化物]元素跟氢氧根形成的无机物叫氢氧化物。也可以看作是碱性氧化物、两性氧化物和酸性氧化物所对应的水化物。化学通式是M(OH)n。通常系指金属氢氧化物。碱性氧化物对应的氢氧化物是碱,如NaOH、Cu(OH)2等,酸性氧化物对应的氢氧化物是酸,如H2SO4、H2CO3等,两性氧化物对应的氢氧化物是两性氢氧化物,如Al(OH)3、Zn(OH)2等。当元素M的化合价(+n)较高时,氧化物的水化物易脱去一部分水而变成含水较少的化合物,例如硫酸不是H6SO6而是脱去两个水分子后的H2SO4。M(OH)n型化合物在水溶液中有酸式电离和碱式电离两种电离形式,一般金属元素的氢氧化物进行碱式电离呈碱性;非金属元素的氢氧化物进行酸式电离呈酸性。还有一些元素的氢氧化物既可以进行酸式电离,又可以进行碱式电离,这类氢氧化物称为两性氢氧化物,例如Al(OH)3、Zn(OH)2等。它们遇强酸时发生碱式电离呈碱性,遇强碱时进行酸式电离呈酸性,Al(OH)3的两种电离形式如下:

[两性氢氧化物]见氢氧化物条。
[元素符号]国际上统一采用的表示元素的化学符号,一般用元素拉丁文名称的第一个字母(大写)来表示,如:氢H、氧O。有些元素的拉丁文名称第一个字母相同,则在第一个字母后加上另一个字母(小写字)以示区别,例如:钙Ca、铜Cu、氯Cl。自人工合成104、105号元素后,由于元素的命名未取得国际上的公认,为统一起见,有关国际会议建议104号以后的新元素按原子序数的拉丁文数字命名,104、105、106、107号元素分别以Unq、Unp、Unh、Uns表示。元素符号除表示元素外,还有量的含义,即表示该元素的一个原子、表示该元素的原子量,例如O,表示氧元素,也表示氧元素的一个原子,又表示它的原子量为15.9994。
[化学式]用元素符号表示纯净物质组成的式子。化学式不仅表示该物质由哪些元素组成,还表示其中各元素原子数目的相对比数,利用化学式还可以计算出式量。化学式有实验式(最简式)、分子式、结构式、示性式、电子式等。
[实验式]又称最简式,是化学式的一种。用元素符号表示化合物分子中元素的种类和各元素原子个数的最简整数比的式子。在有机化合物中经常会出现不同的化合物具有相同的实验式,例如乙炔(C2H2)和苯(C6H6)的实验式都是CH,甲醛(CH2O)和乙酸(C2H4O2)的实验式都是CH2O等。已知化合物的最简式和分子量,就可以求出它的分子式。有些物质的实验式就是它的分子式,如甲醛CH2O和水H2O等。离子化合物晶体通常不是以分子状态存在,在实际应用上就用实验式来表示这类物质中各元素原子数目的比例关系,如NaCl表示氯化钠晶体中钠离子与氧离子数之比是1∶1。
[最简式]见实验式条。
[分子式]化学式的一种,用元素符号表示单质或化合物分子组成的式子。例如分子式H2O表示水是由氢元素和氧元素组成,表示水的一个分子,表示水分子中含有二个氢原子和一个氧原子,也表示水的分子量为18.015。分子式是通过实验测定物质的组成和分子量后求得的,一种物质只有一个分子式。不以分子形式存在的离子化合物,只表示该化合物的组成,而不是分子式。例如氯化钠晶体中只有钠离子和氯离子,不存在氯化钠分子,所以NaCl只表示氯化钠的组成,是氯化钠的化学式,而不是分子式。分子式可以和实验式相同,也可以是实验式的整数倍,例如过氧化氢的分子式是H2O2,而实验式是HO。
[结构式]化学式的一种。用元素符号通过价键相互连接表示物质分子中原子的排列顺序和结合方式的式子。例如甲烷(CH4)和乙酸(C2H4O2)的结构式分别是:
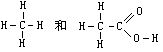
其中一条短线表示一个共价键,结构式是表示物质分子的化学结构的式子,并不表示分子的空间结构,例如甲烷分子的空间结构是正四面体。有机化合物中,同分异构现象比较普遍,例如分子式同为C2H4O2的乙酸和甲酸甲酯,它们的性质迥然不同,这是由于它们结构不同的缘故,用分子式不能区别分子组成相同,而结构相异的物质,因此,在这种情况下,使用结构式更显得重要。

[示性式]化学式的一种,表示含有官能团的化合物分子的一种简化结构式。例如乙醇的结构式是: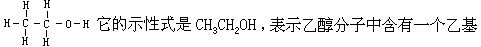
CH3CH2-和一个羟基-OH。示性式能够明确而简便地表述同分异构体。例如乙醇和二甲醚的分子式都是C2H6O,它们的示性式分别为CH3CH2OH和CH3OCH3。
有些书籍中把CH3CH2OH叫乙醇的结构简式,而把除官能团外的其它各原子都分别合在一起写的式子叫示性式,如C2H5OH叫乙醇的示性式。结构简式和示性式都是简化的结构式,简化之后仍保持结构的特点,因此,一般书籍中把结构简式和示性式统称为示性式,不提结构简式。
[电子式]用元素符号表示原子核和内层电子,并在元素符号的周围用小黑点“·”或“×”表示原子或离子最外层电子数的图式叫电子式。例如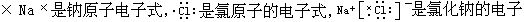
 “+”或“-”表示,阴离子并加上方括号,阳离子失去外层电子后只标明电荷数即可。用电子式可以比较简便和形象地表示离子化合物和共价化合物的形成过程。例如,
“+”或“-”表示,阴离子并加上方括号,阳离子失去外层电子后只标明电荷数即可。用电子式可以比较简便和形象地表示离子化合物和共价化合物的形成过程。例如,
MgCl2的形成过程是
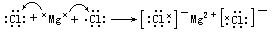
HBr的形成过程是
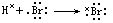
电子式只适用于某些在形成共价分子或离子化合物时,其最外电子层能达到惰性元素原子的电子层结构的原子。
[原子结构示意图]又叫原子结构简图。用以表示原子的核电荷数和核外电子在各电子层上的排布的图式。例如,
钠的原子结构示意图是
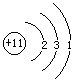
圆圈及其中数字表示钠原子核及核内有11个质子,弧线表示电子层(钠有3个电子层),弧线上的数字表示该电子层的电子数(钠原子K层有2个电子,L层有8个电子,M层有1个电子)。原子结构示意图比较直观,易为初学者接受。但不能把弧线看作原子核外电子运行的固定轨道。
[原子结构简图]见原子结构示意图条。
[组成]化合物或混和物中各个组分的相对含量称为组成。常用质量比或质量百分数(百分组成)表示。例如水中氢和氧的质量比是1∶8,百分组成是含氢11%,含氧89%。
[定组成定律]又称定比定律。任何纯净的化合物中各元素的质量比是固定的,或者说,它们具有固定的组成。例如水,不管它是从什么地方取得的,或是用什么方法制取的,只要是纯水,水中氢元素和氧元素的质量比一定是1∶8。定组成定律是由法国化学家普鲁斯特在18世纪末根据对多种化合物的定量测定而确立的,是近代化学发展的基础。这个定律对绝大多数化合物是适用的,也有一些例外情况,如金属互化物的组成在某一定范围以内是可以改变的。
[定比定律]见定组成定律条。
[倍比定律]当甲乙两种元素互相化合形成两种或两种以上的化合物时,则在这些化合物中,与一定质量的甲元素相化合的乙元素的质量,必互成简单的整数比。例如H2O和H2O2这两种化合物都是由氢元素和氧元素组成的,H2O中氢和氧的质量比是1∶8,H2O2中氢和氧的质量比是1∶16。在这两种化合物中跟等质量的氢化合的氧的质量比为1∶2,是一个简单的整数比。这个定律是英国化学家道尔顿于1803年提出的。
[质量守恒定律]又叫物质不灭定律。参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和。也就是在化学反应中,反应物的总质量等于生成物的总质量。由于化学反应是化学键的破裂与重建的过程,反应前后的原子的种类与数量都没有改变,所以化学反应前后各物质的质量总和应是相等的。这个定律是俄国科学家罗蒙诺索夫于1765年首先提出的,但是这一发现在当时并没有引起科学家的注意,直到1777年法国化学家拉瓦锡用多次实验进一步加以证实后,这一定律才获得公认。物质在发生化学反应的同时,必定伴随着能量的吸收或释放,1905年美国物理学家爱因斯坦提出质量和能量的联系公式:E=mc2,式中E为能量,m为质量,c为真空中的光速。根据这一公式可知,当一种物质的能量发生变化时,它的质量也相应地发生变化,因而质量守恒定律得到了新的发展。由于c2是一个很大的数值,只要损耗很小的质量就能释放极大的能量,在化学反应中所释放的能量不太大,很难觉察到质量的亏损,所以在化学反应中可以不加考虑。而对释放能量特别大的核反应中,就会感到质量的亏损。
[物质不灭定律]见质量守恒定律条。
[化学方程式]又称化学反应式。用化学式表示化学反应的式子。反应物写在式子的左边,生成物写在式子的右边,中间用等号连接,在特定的条件下进行的反应,可把条件写在等号处,生成物是气体或沉淀的可用“↑”或“↓”表示,例如碳酸氢钠加热时分解生成碳酸钠、水和二氧化碳,可写作
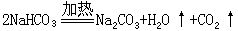
书写化学方程式必须遵循质量守恒定律,因此要在化学式前面配上适当的系数,使等号左右各种原子的总数都相等,也就是书写化学方程式时必须配平。化学方程式不仅表示参加反应的反应物和生成物的种类,而且表示反应物和生成物之间质量、物质的量的关系,对于气体物质,还能表示它们在同温同压下的体积关系,例如
N2+3H2=2NH3
物质的量之比1∶3∶2
质量比28∶6∶34
体积比1∶3∶2
在工农业生产和科学实验上,根据化学方程式可以进行各种计算。
[化学反应式]见化学方程式条。
[热化学方程式]标出热效应的化学方程式。把反应热写在生成物的右边,放出的热量用正值,吸收的热量用负值表示。在写热化学方程式时:(1)要注明反应时的温度和压力,如不注明,即表示通常状况;(2)必须在化学式的右下侧注明物质的聚集状态,可分别用小写的s、l、g三个英文字母表示固、液、气态;(3)化学式前的系数只表示物质的量(摩尔),不表示分子数,因此必要时可以用分数。例如,在25℃和101325帕斯卡
的热化学方程式分别是:
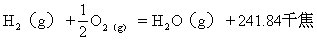
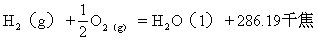
因物质的聚集态不同,因此反应热也不同。
[离子方程式]用实际参加反应的离子符号来表示离子反应的式子。例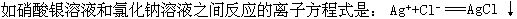 它可表示所有的可溶性银盐和盐酸或可溶性氯化物之间的反应。离子方程式可表示同一类型的离子反应,揭示了反应的实质。在离子方程式中,反应物
它可表示所有的可溶性银盐和盐酸或可溶性氯化物之间的反应。离子方程式可表示同一类型的离子反应,揭示了反应的实质。在离子方程式中,反应物
和生成物中若为可溶性强电解质溶液,均写成离子符号;若为弱电解质(包括水)、难溶物质或气态物质时,一律写成分子式(化学式)。非溶液中的离子反应一般不用离子方程式表示。
[电离方程式]表示电解质在溶液中或受热熔化时电离成自由移动离子的式子。强电解质在溶液中完全电离,用“=”表示,弱电解质在溶液中只是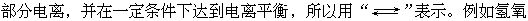 化钠和醋酸在溶液中电离方程式分别是:
化钠和醋酸在溶液中电离方程式分别是:
NaOH=Na++OH-
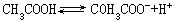
硫酸是强电解质,一级电离比较完全,二级电离就不完全(K2=1.2×10-2),所以硫酸的电离方程式一般表示为:
H2SO4=H++HSO-4
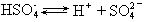
[电极反应式]表示原电池或电解池中电极上发生的氧化或还原反应的式子。例如,铜锌原电池中的电极反应式是
负极 Zn-2e=Zn2+
正极 Cu2++2e=Cu
氯化铜溶液在电解池中的电极反应式是:
阳极 2Cl--2e=Cl2↑
阴极 Cu2++2e=Cu
由于氧化-还原反应是同时进行的,所以电极上进行的反应又称为半反应。
[原子量]元素的原子量是一种相对质量。一种元素的原子量是该元素 种以上的同位素,因而各元素的原子量为其同位素原子质量的平均值的1摩
种以上的同位素,因而各元素的原子量为其同位素原子质量的平均值的1摩 为原子量的标准。
为原子量的标准。
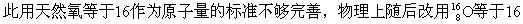 由于标准不同,容易引起混乱。1961年8月国际上正式
由于标准不同,容易引起混乱。1961年8月国际上正式 跟原化学原子量相差很小,例如氧的原子量从16.0000改为15.9994,相差不到十万分之四。
跟原化学原子量相差很小,例如氧的原子量从16.0000改为15.9994,相差不到十万分之四。
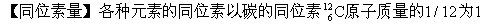 个原子质量单位(μ)做标准的相对质量叫做同位素量。例如元素氛的三种
个原子质量单位(μ)做标准的相对质量叫做同位素量。例如元素氛的三种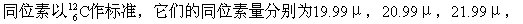 元素按其所含的各种同位素的百分组成可以算出平均同位素量,上述三种同位素的百分组成分别为 90.92%,0.25%,8.83%,则氖的平均同位素量=19.99μ×90.92%+20.99μ×0.25%+21.99μ×8.83%=20.16μ。
元素按其所含的各种同位素的百分组成可以算出平均同位素量,上述三种同位素的百分组成分别为 90.92%,0.25%,8.83%,则氖的平均同位素量=19.99μ×90.92%+20.99μ×0.25%+21.99μ×8.83%=20.16μ。
[丰度]元素在地壳中含量的百分数,称为元素丰度,常简称丰度或克拉克值。丰度有两种表示方法,分别是质量百分数(Cw)和原子百分数(CA)。例如丰度最大的氧元素Cw为49.13%,CA为53.59%。丰度的概念有时也用来表示某元素的各种同位素的相对百分数,例如氖的三种同位素20Ne、21Ne、22Ne的丰度分别为90.92%、0.25%、8.83%,表示元素的同位素相对丰度时指的是原子百分数(CA)。
[质量数]原子核内质子数和中子数的总和。质量数是接近同位素量的整数。例如氯的两种同位素质量分别是34.969μ和36.966μ,35和37分别是这两种同位素的质量数。
[分子量]单质或化合物分子的相对质量,等于分子中各原子的原子量的总和。例如氧气(O2)的分子量为15.9994×2=31.9988,水(H2O)的分子量为1.0079×2+15.9994=18.0152。离子晶体、原子晶体和金属晶体所构成的物质,它们一般不存在单个的分子,所以也无所谓分子量。但可以用它们的化学式来计算它们的式量,例如二氧化硅(SiO2)的式量是28.0855+15.9994×2=60.0843。
[式量]物质的实验式中各原子的原子量总和。若实验式等于分子式,则式量等于分子量,例如硫酸的实验式与分子式相同,都是H2SO4,它的式量(98)就等于其分子量;若实验式与分子式不一致,则式量不等于分子量,例如葡萄糖的实验式是CH2O,分子式是C6H12O6,则式量为30,而分子量是180。
[国际单位制]简称SI制,是1960年第十一届国际计量大会建议采用的一种单位制。从1969-1975年国际标准化组织和国际计量大会经过修订、补充,正式推荐使用。国际单位制是以米、公斤、秒、安培、开尔文、摩尔、坎德拉为基本单位,其它单位均由这七个单位导出,各基本单位规定如下:(1)米等于氪-86原子的2p6和5d5能级之间跃迁所对应的辐射在真空中的1650763.73个波长的长度;(2)千克(公斤)是质量单位,等于国际千克原器的质量;(3)秒是铯-133原子基态的两个超精细能级之间跃迁所对应的辐射的9192631770个周期的持续时间;(4)安培是一恒定电流,若保持在处于真空中相距1米的两个无限长而截面可忽略的平行直导线内,则此两导线之间产生的力在每米长度上等于2×10-7牛顿,则此恒定电流的强度为1安培;(5)开尔文是热力学温度单位,是水的三相点热力学温度的1/273.16;(6)摩尔是一种系统的物质的量,该系统中所含的基本单元数与0.012千克碳-12中的原子数相等。在使用摩尔时,基本单元应予指明,基本单元可以是原子、分子、离子、电子及其它粒子,或者是这些粒子的特定组合;(7)坎德拉是在101325牛顿每平方米的压强下,处于铂凝固温度的黑体的1/600000平方米表面垂直方向上的光强度。
[物质的量]是国际单位制规定的七个物理量之一,物质的量是指一定量的物质中所含微粒的多少,它的单位是摩尔。使用时要注意物质的量与摩尔数的区别,摩尔数只有数的意义,没有单位;物质的量既有数的意义又有单位。例如5摩尔水,其中5摩尔是物质的量,5是摩尔数。
[摩尔]1971年在第十四届国际计量大会上通过,把它作为国际单位制(SI)七个基本单位之一。是表示物质的量的单位。它是一种系统的物质的量,该系统中所含的基本单元数与0.012千克碳-12中的原子数相等。0.012千克碳-12中含有阿佛加德罗常数(6.02×1023)个碳原子,称为1摩尔。在使用摩尔时,应指明它所指的基本单元是原子、分子、离子、电子及其它粒子,或者是这些粒子的特定组合。
[摩尔质量]1摩尔任何物质的质量。它的单位是克/摩尔。原子的摩尔质量等于用克/摩尔表示的在数值上和该元素的原子量相等的质量;某种分子的摩尔质量等于用克/摩尔表示的在数值上和该物质的分子量相等的质量。因此摩尔质量表示1摩尔的任何物质(原子、分子、离子、电子以及其它粒子或是这些粒子的特定组合)以克/摩尔为单位的质量。
[摩尔分数]混和物或溶液中的一种物质的摩尔数与各组分的总摩尔数之比,即为该组分的摩尔分数。可以指混和物中某一组分的摩尔数与混和物总摩尔数之比;也可以指溶液中溶质的摩尔数与溶质溶剂总摩尔数之比;经常用于气体混和物中某气体的摩尔数与混和气体中各组分的总摩尔数之比。
[摩尔百分数]用百分数表示的摩尔分数。例如,混和气中某气体的摩尔数占混和气体总摩尔数的1/5,摩尔分数为1/5,摩尔百分数为20%。
[气体摩尔体积]1摩尔的任何气体在标准状况下所占的体积大约都是22.4升。这个体积称为气体摩尔体积。22.4升是一个近似数,“理想气体”的摩尔体积是22.4升,多数气体1摩尔在标准状况下所占的体积约为22.4升。
[平均分子量]22.4升气态混和物在标准状况下质量的克数,称作该混和气体的平均分子量。例如,22.4升空气在标准状况下的质量约为29克,则空气的平均分子量为29。在标准状况下22.4升的任何气态物质中所含的分子数都是阿佛加德罗常数(6.02×1023)个,因此 1摩尔混和气体的摩尔质量数,即为该混和气的平均分子量。
[阿佛加德罗定律]在同一温度和同一压强条件下,相同体积的任何气体中都含有相同数目的分子。这个结论是意大利化学家阿佛加德罗于1811年首先提出,后来为许多实验所证实的。它用于某些计算,例如气态物质的分子量计算等。根据阿佛加德罗定律,从某些气态物质在反应中体积的变化,可以推算出气态单质分子中的原子数。
[阿佛加德罗常数]1摩尔微粒(可以是分子、原子、离子、电子及其它微粒等)数经实验测得比较精确的数值是6.022045×1023个/摩尔。测定阿佛加德罗常数的方法很多,例如:由含Ag+的溶液中析出1摩尔银,需通过96484.56库仑的电量,已知每个电子的电量是1.602189×10-19库仑,因此可以得出阿佛加德罗数是
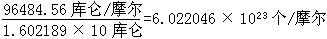
[当量]物质相互反应时,彼此所需相当的量。元素的当量是元素在化学反应中跟1.008份质量的氢或8.000份质量的氧相当的量。酸、碱、盐、氧化剂和还原剂的当量分别为:


一种物质在不同的反应中,往往有不同的当量。例如,H2SO4跟NaOH反应,生成Na2SO4时,H2SO4的当量为49,如果生成NaHSO4时,H2SO4的当量为98。
[克当量]是衡量物质质量的一种化学单位,一定量元素或化合物,用克做单位,在数值上等于当量时,这一定量物质称为一克当量。例如,氢的克当量是1.008克,氧的克当量是8.000克,盐酸的克当量是36.5克。在化学反应中,一克当量的任何物质都彼此相当。
[克当量数]表示物质克当量的数量。
例如,80克氢氧化钠的克当量数为2,32克氧气的克当量数是4。
[当量定律]在任何化学反应中,反应物之间完全反应时,它们的克当量数一定相等。例如,在H2和O2化合成H2O的反应中,氢的当量为1.008,氧的当量为8.000,因此,H2与O2化合时的质量比为1.008∶8。根据当量定律,可以计算物质在化学反应中的质量关系。当量定律是德国科学家里希特尔于1791年提出的。
[氧化数]又称氧化值或氧化态。某元素一个原子的荷电数,这种荷电数由假设把每个键中的电子指定给电负性较大的原子而求得。在离子化合物中,元素原子的氧化数就等于该原子的离子电荷数,如氯化钙,钙原子的氧化数为+2,氯原子为-1。在共价化合物中,把属于两原子的共用电子对指定给两原子中电负性较大的一个以后,在两原子留下的电荷数就是它们的氧化数。如五氧化二磷,磷原子氧化数为+5,氧原子为-2。在单质中,元素的氧化数为零。元素的氧化数的变化是区别氧化-还原反应和非氧化-还原反应的主要标志。
[化合价]又称原子价。一定数目的一种元素的原子跟一定数目的其它元素原子化合的性质。它表示各种元素的原子相互化合的数目。通常以氢的化合价等于1为标准。其它元素的化合价就是与该元素的1个原子相化合的或被该元素1个原子所置换的氢原子数。化合价有电价与共价之分。
[电价]元素在离子化合物里的化合价。电价数就是这种元素的一个原子得失电子的数目,失去电子的为正价,得到电子的为负价。例如在硫化钠中,钠为+1,硫为-2。
[共价]元素在共价化合物里的化合价。共价数就是这种元素的一个原子跟其它元素的原子形成的共用电子对的数目,所以共价没有正负之分。共价不容易从分子式推断,而要从结构分析。但是不少物质的结构尚不清楚,这就难以确定共价数。现行中学化学教材里用氧化数的概念,引用到共价化合物中元素的化合价上去。根据成键原子吸引电子对能力的差别,把共价也分成正负价,实质上是元素的氧化数。
[德谟克利特](Demokritos约前460-前370)古希腊哲学家,唯物论者。他认为宇宙由真空(“虚空”)和原子组成。认为原子有无限的数目,原子是最微小、坚固不可入和不可分的物质粒子;原子不但有不同的大小,并有不同的质量。他认为原子在性质上相同,但外观不同;原子在不停地运动着,是永远不变不灭的。世界万物是由原子不断运动和碰撞所致。这种“原子论”直到19世纪初才被近代的科学的原子论所代替。
[亚里士多德](Aristotle约前384-前322)古希腊哲学家和思想家。他是柏拉图的学生,是一位知识渊博的学者,留下了很多关于自然科学与哲学,特别是关于逻辑和辩证法的著作。他提出万物由四种元素--土、水、气、火所组成,这四种元素是永恒的,不能从无到有、也不能从有到无。他还认为四元素都具有能被人感觉的两两对立的性质:水包括冷和湿的性质、火包括干和热的性质、气包括热和湿的性质、土包括湿和干的性质。从而推论世界万物的多样性全由这四种性质(冷、热、干、湿)以不同比例结合而产生,元素就是由这些原始性质成对地配合而成的。他的元素-性质学说成了炼金术的指导思想。他在历史上的影响最大。
[波义耳](Robert Boyle,1627-1691)英国化学家、物理学家。1659年用实验阐明气压升降原理,并发现著名的气体定律,他在化学方面将当时习用的定性试验归纳为一个系统,初次引入化学分析的名称,开始了分析化学的研究。1661年写了《怀疑派化学家》一书,批判了点金术士的唯心主义“元素”观,将元素的定义为未能分解的物质,使化学开始在科学的基础上进行研究,对破除迷信和提倡科学精神起了很大的作用。恩格斯指出“波义耳把化学确立为科学”。
[罗蒙诺索夫](МихаилВасилъевичЛомоносов,1711-1765)俄国自然科学家和哲学家,唯物主义者。他提出了物质和运动守恒的概念,还做了在化学反应中质量守恒的实验。他反对当时的燃素说。1748年创建了俄国的第一个化学实验室,1755年创办莫斯科大学。他对发展俄国的文化教育事业有很大贡献。在认识论上,他反对把分析和综合、感性认识和理性认识对立起来,并在一定程度上看到了实践在认识中的作用。他成功地制出了具有高度艺术水平的彩色玻璃和用这玻璃做的镶嵌画。著有《论固体和液体》、《论化学的效应》、《真实物理化学概论》、《论地层》、《关于冷和热的原因探讨》等书。
[卡文迪许](Henry Cavendish,1731-1810)英国化学家和物理学家。1731年生于法国的尼斯,是英国贵族的后裔。1749-1753年在英国剑桥大学学习,他生活朴素,不喜社交,性格孤独,终身未婚。1798年用扭秤验证了万有引力定律,还确定了引力常数和地球的平均密度。他在化学方面的主要成就有:研究氢气的制取和性质;研究空气的组成并发现其中有约1/130的不知名的不活动气体(即以后发现的惰性气体);用氢氧通电化合成水,发现水的组成;水银集气法也是从他开始使用的。
[普利斯特里](Joseph Priestley,1733-1804)英国化学家、唯物主义的哲学家。他酷爱实验,1766年偶遇美国科学家富兰克林,并受其启发,立志于科学事业。他用水槽、汞槽收集气体,并研究它们的性质,陆续发现氨、氯化氢、一氧化碳、二氧化碳、一氧化二氮、一氧化氮等气体。1774年他还独立地发现了氧气,是化学上的一项重要贡献,但他坚持燃素说,把氧称为“脱燃素的空气”。在哲学上,认为大脑是“思维的部位”,人和自然界都服从于必然的客观规律,但并不因而否认人的主观努力作用。他的唯物主义具有自然神论的色彩。晚年因同情和赞助法国资产阶级革命受到迫害而移居北美。主要著作有《电史学》、《各种气体的实验与观察》、《从水中产生气体的实验》等。
[柏格曼](Torbern Bergman,1735-1784)瑞典分析化学家和矿物学家。他预言过钨、钼元素的存在,并试图提取锰,还作了有关碲的实验。在他所著的《理化大纲》等书中系统地总结了当时的化学分析知识。他与舍勒是密友。他善于引导学生,如佐罕·甘英发现了锰、埃尔姆发现了钼、得鲁雅尔兄弟发现钨都曾受过他的启示。
[舍勒](Karl Wilhelm Scheele,1742-1786)瑞典化学家。他具有惊人的记忆力,知识渊博。舍勒独立发现了氯气、氧气、氨、氯化氢等气体,还研究和记述了锰和钡的性质。他也发现了砷酸、氢氟酸、钼酸等,并对普鲁士蓝、硫化氢、砷化氢、氢氰酸、亚砷酸铜等进行过研究。银盐的感光性也是他发现的。他首创的分离甘油和乳酸、草酸等有机酸的方法至今还沿用着。著有《论空气与火》等书。
[拉瓦锡](Antoine Laurent Laroisier,1743-1794)法国化学家。1772年开始研究硫、磷及金属的燃烧问题,证明物质燃烧和动物呼吸都属于空气中氧所参与的氧化作用,他证明氧气是一种新元素,提出了燃烧的氧化学说,给错误的燃素说以致命的打击,从而使化学变化的研究工作建立在科学的基础上,极大地推动了化学的发展。1783年他写成《对于燃素之回顾》,确立了质量守恒原理,建立了初步的反应方程式,天平从此在化学研究中广泛应用,他还开始了有机定量分析。1787年,在他领导下同另外三位法国化学家拟订了化合物的第一个合理命名法,1789年写成的《化学基本教程》中提出了第一个元素分类表,但书中仍认为无机元素中包括“热素”和“光素”。法国大革命时期,因他曾任封建王朝的包税官,参与封建王朝的横征暴敛,并为之出谋划策,1794年5月8日被处死刑。他的著作有《理化大纲》、《化学纪录》等。
[道尔顿](John Daltion,1766-1844)英国化学家、物理学家。1766年生于昆布兰的织布工人家庭里,他长期任小学教师。他对气象颇感兴趣,自1787年起每天都纪录气象资料,由于对气象的喜好,引导他去研究气体的性质,于1801年发表了“气体分压定律”,又导出混和气体中某气体的溶解度与它的分压成正比的规律。1803年他又发现了“倍比定律”,并引入元素相对原子量的新概念,编制了有十四种元素的原子量表,他选定氢是最轻的元素作为原子质量的标准。他还编了元素符号,并将符号结合起来代表化合物,他是使用元素符号的创始人。1808年发表的《化学哲学的新系统》中,提出了原子的科学假说“原子论”。恩格斯称他为“近代化学之父”,并指出“化学中的新时代是随着原子论开始的”。道尔顿曾任曼彻斯特学院的数学和自然哲学教师,后由牛津大学授予博士学位。
[亨利](Willian Henry,1755-1836)英国化学家。他著有许多有关化学的书籍。他曾发现了气体被液体(包括溶液)吸收时,其溶解的量与气体的压强成正比,这就是“亨利定律”。
[阿佛加德罗](Amedeo Avogadro,1776-1856)意大利物理学家和化学家。1776年8月9日生于都灵市。出身于律师家庭,他20岁时获法学博士,以后致力于数学、物理学研究,1820年被聘为都灵大学物理教授。他提出分子的概念,以及原子与分子区别的概念。1811年在《物理杂志》上发表了“阿佛加德罗假说”。他还根据气体的密度测定了分子的相对质量。由于他的论点不易理解,以致这些假说在当时没有得到大家的赞同,后来经过康尼查罗的实验论证,直到1860年才获得普遍的公认。阿佛加德罗“假说”发展成“阿佛加德罗定律”。
[盖吕萨克](Joseph Louis Gay-Lussac,1778-1850)法国化学家。1778年12月6日生于利摩日附近的圣·雷奥纳尔,19岁时入高级工艺专门学校学习。曾任法国高级工艺专门学校和植物园的化学教授。他曾和泰那尔合作,不利用电解而制出金属钾(用铁在高温下还原苛性钾),还用钾跟硼酸反应制得硼。他还制得纯净的氢氟酸、无水氢氰酸、氰等。1808年6月在宣读他用钾处理硼酸的论文时,当场表演实验,因爆炸而受伤,但他仍坚持不懈地工作。于1809年宣布发现了气体化合的体积定律。另外他认为酸有氢酸和氧酸两种。他著有《物理化学之研究》等书,并撰写有148篇论文。
[戴维](Sir Humphry Davy,1778-1829)英国化学家。他性格活泼、富于感情、喜欢社交活动。他在15岁时脱离学校生活。致力于自学,在当医药学徒时,自学化学,并用酒杯、烟斗等代替化学仪器做化学实验。20岁时任气学研究所监督,不久发现笑气的麻醉性,他测定了N2O、NO、NO2的质量组成。他在1801年受聘为英国皇家化学学院担任化学助教和实验指导等职,开始了电化学的研究,是电化学创始人之一。曾用电解法制取元素钾、钠、钙、锶、钡、镁等,考察了碱金属和碱土金属的性质。还独立地发现元素硼。氯是舍勒发现的,但把他当成化合物,戴维通过实验确定氯为一种元素。按照拉瓦锡的观点,酸中必须含氧元素,他通过大量实验证明酸的主要成分是氢而不是氧。此外,他还发明了矿工所用的安全灯。1829年在日内瓦病故、终年51岁。
[贝采里乌斯](J ns Jakob
Berzelias,1779-1848)瑞典化学家。1779年8月20日生于瑞典韦斐松答村,22岁获乌布萨拉大学医学博士学位,任斯德哥尔摩医学院教授。他发展了原子论,并以氧原子为标准测定了四十多种元素的相对原子量,他还提出现代元素符号并排出原子量表(1811-1826年)。他发现硒、钍、硅、铈、锆等许多元素。开始引用了“有机化学”概念以区别“无机化学”。但错误地用“生命力”解释有机物的生成。他提出“二元论的电化基团学说”(1812年)和“同分异构”现象(1830年)。著有《化学教程》、《动物的化学》、《化学总论》、《矿物学新系统》等书,从1821-1848年编辑出版《物理化学进展年报》等。
ns Jakob
Berzelias,1779-1848)瑞典化学家。1779年8月20日生于瑞典韦斐松答村,22岁获乌布萨拉大学医学博士学位,任斯德哥尔摩医学院教授。他发展了原子论,并以氧原子为标准测定了四十多种元素的相对原子量,他还提出现代元素符号并排出原子量表(1811-1826年)。他发现硒、钍、硅、铈、锆等许多元素。开始引用了“有机化学”概念以区别“无机化学”。但错误地用“生命力”解释有机物的生成。他提出“二元论的电化基团学说”(1812年)和“同分异构”现象(1830年)。著有《化学教程》、《动物的化学》、《化学总论》、《矿物学新系统》等书,从1821-1848年编辑出版《物理化学进展年报》等。
[法拉第](Michael Faraday,1791-1867)英国物理学家和化学家。生于铁匠之家,少年时期在一家图书装订店当学徒。他通过实验在许多方面都有所贡献。1831年发现“电磁感应”现象,从而确定了电磁感应的基本定律,这是现代电工学的基础。他还发现,当时认为是各种不同形态的电,在本质上都是相同的。1833-1834年发现电解定律(也称法拉第电解定律),这是电荷不连续性最早的有力证据。他曾著文论述能量的转换,指出能的统一性和多样性。他在研究电场和磁场时,发现了磁致旋光效应(称法拉第效应)。在化学方面,他研究了氯,制得了液态氯,发现了四氯乙烷和六氯乙烷,特别在1825年发现了苯,对有机化学的发展起了较大的作用。他用实验方法研究气体的扩散和若干气体的液化,并研究合金钢的性质,创制出多种光学玻璃的新品种。
[维勒](Friedrich W hler,1800-1882)德国化学家。1800年7月31日生于法兰克福附近的埃歇海姆村。少年起就爱好收集矿物、钱币,喜爱油画、刻蚀、化学实验等,曾获数学奖金。1823年获外科和产科博士学位。其后专攻化学,曾受业于贝采里乌斯和格美林。他在事业上卓有成就,还热心于社会福利事业。他在1827年发现铝,1828年发现铍,他分离过硼、硅、钇。1824年合成出草酸,还发现过硅烷。1828年由无机物氰酸铵合成尿素,从而打破了生命力学说的束缚,指明了有机化学的合成方向。他死于1882年10月9日,按其遗嘱,丧事从简,只在墓上放一石碑记其姓名。他的重要著作有《无机化学的基础》、《有机化学的基础》和《化学分析中的实际练习》等。
hler,1800-1882)德国化学家。1800年7月31日生于法兰克福附近的埃歇海姆村。少年起就爱好收集矿物、钱币,喜爱油画、刻蚀、化学实验等,曾获数学奖金。1823年获外科和产科博士学位。其后专攻化学,曾受业于贝采里乌斯和格美林。他在事业上卓有成就,还热心于社会福利事业。他在1827年发现铝,1828年发现铍,他分离过硼、硅、钇。1824年合成出草酸,还发现过硅烷。1828年由无机物氰酸铵合成尿素,从而打破了生命力学说的束缚,指明了有机化学的合成方向。他死于1882年10月9日,按其遗嘱,丧事从简,只在墓上放一石碑记其姓名。他的重要著作有《无机化学的基础》、《有机化学的基础》和《化学分析中的实际练习》等。
[杜马](Jean Baptiste Andre Dumas,1800-1884)法国化学家。曾任法国的阿西尼姆和索尔本大学教授。他创造了蒸气密度的测定法、氮的燃烧定量分析法。他的主要贡献是在有机化学的理论发展上,例如1834年他研究石蜡氯化之后提出了“取代”的概念;他从煤焦油中分离出蒽,他还证明乙醇中有乙基,有助于“基团理论”的建立;他又发现乙酸中的氢被氯取代后,基本性质未变,这样就导致了1839年化学类型学说的建立;他在研究脂肪醇后,又发展了同系列的概念。
[巴拉尔德](Antoine Jé me
Balard,1802-1876)法国化学家和药学家。1802年9月30日生于蒙特培利埃,家境贫穷,曾在药学专业学校当实验室助手。1824年他发现了溴元素,因而被巴黎大学和法兰西大学聘为教授。他还发现并鉴定了次氯酸,改进了从海水中提取各种盐类的工艺方法。
me
Balard,1802-1876)法国化学家和药学家。1802年9月30日生于蒙特培利埃,家境贫穷,曾在药学专业学校当实验室助手。1824年他发现了溴元素,因而被巴黎大学和法兰西大学聘为教授。他还发现并鉴定了次氯酸,改进了从海水中提取各种盐类的工艺方法。
[李比希](Justus Von Liebig,1803-1873)德国化学家。1826年起先后长期担任吉森和明兴两大学教授,最先建立高等学校化学实验室。他在无机化学、有机化学、生物化学等方面都做出了重大贡献,是当时的有机化学和农业化学权威,享有很高的威望。他发现了氰酸银和雷酸银的异构现象;改进有机物中碳、氢元素的定量分析法;创制三氯乙醛和氯仿;研究了发酵和腐败的化学原理;他把化学应用到农业生产上,提出植物的矿质营养学说,成为农业化学的奠基人之一。他还证实食物在体内氧化产生热和能。他的论文多达318篇,专著有《有机化学对农业及生理学上的应用》、《食物化学》等。他主编的德国《化学学报》是影响最大的刊物之一。
[格雷阿姆](Thomas Graham,1805-1869)英国化学家。发现了气体扩散定律,即不同气体的扩散速度与气体密度的平方根成反比。他还研究胶体溶液与真溶液的区别,对胶体化学的发展作出了一定的贡献。他在《水是盐的成分》一文中指出,硫酸铜含的五个分子结晶水中,其中有一个分子结晶水不象其余四个水分子那样容易失去。他的著作有《化学大纲》、《关于气体扩散的定律》、《关于气体分子的移动》等。
[本生](Robert Wilnelm Bunsen,1811-1899)德国化学家。1811年生于戈丁根。他在19岁时获哲学博士学位。他曾以步行为主,用了三年时间,远游各地进行地质、矿山、工厂、学校的科学考察。他从事化学研究和化学教学达55年之久,直到78岁才从海得尔堡大学退休。他是基团学说的拥护者。研究范围涉及电化学、物理化学、分析化学等方面,在光化学领域内贡献较大。利用他和基尔霍夫所创立的光谱化学分析法,在矿泉中发现铯(1860年)和铷(1861年)两元素。他还是碘定量分析的创始人,并对光化学作用、冰岛的喷泉、二甲胂基等进行研究。他研制和改进的仪器设备有:本生灯(煤气灯)、本生电池、油斑光度计、各种量热器、节温器、定高水浴、过滤泵等。他在实验中,敢于接触极毒和易于爆炸的物质,发现新鲜的氢氧化铁可以解砷毒。本生为人谦逊,性格开朗,他毕生致力于科学事业,以“总是没有功夫”为由终身未娶。1899年8月16日逝世,终年88岁。
[热拉尔](Charles Gerhardt,1816-1856)法国化学家。1843年建议改革原子量系统,并提出把分子量定为该物质在气态时与2克氢气同体积时的质量。他在进行有机物分类时,认识到“同系物”的存在。1853年他在取代反应的基础上,提出了“类型论”,把当时已知的有机化合物分别纳入水、氯化氢、氨、氢四种基本类型。这四种母体化合物中的氢被各种基取代,可得到各种有机化合物。
[武尔兹](Charles Adolphe Wurtz,1817-1884)法国有机化学家。曾任巴黎大学教授。他在长期从事研究工作中,先后发现次磷酸、三氯氧磷、胺类、烃类、乙二醇、环氧乙烷,以及醛还原成醇和醇醛缩合等反应。1855年发现将卤代烷和金属纳作用制备烃类的合成方法(武尔兹反应)。他的重要著作有《纯粹和应用化学辞典》、《化学哲学讲义》和《原子学说》等。
[霍夫曼](August Wilhelm Hofmann,1818-1892)德国有机化学家。他是李比希的学生。1845年起任英国皇家化学学院教授二十年。1864年返回德国,任波恩大学和柏林大学教授。他在1868年创建了德国化学会。他还是德国染料化学的创始人之一。他研究的题材广泛,自甲醛和异腈类化合物,到苯胺和它的衍生物均有所涉及,他还从煤焦油中制出许多染料中间体或染料的苯胺衍生物,如碱性品红和苯胺盐等。他在化学理论上也有所建树,如提出有机物分类里的“氨类型”;在络合物方面提出了“霍夫曼铵盐理论”。他的著作有《近世普通化学》等。
[基尔霍夫](Gustav Robert Kirchhoff,1824-1887)德国物理化学家。曾任柏林大学和海得尔贝格大学教授。他在1859年根据热平衡原理导出物体对电磁辐射的发射本领与吸收系数成正比的定律(基尔霍夫定律)。他还解释了太阳光谱里的暗线(夫劳和费线)出现的原因,他与本生共同发明了分光镜,并用它发现了铯和铷,共同创立了光谱分析化学。1858年他提出了计算同一反应在不同温度下的焓变的基尔霍夫定律。
[康尼查罗](Stanislao Cannizzaro,1826-1910)意大利化学家。他在有机化学和无机化学上都有一定的贡献。在有机化学方面,他发现芳香醛跟碱反应而转变成相应的醇和酸(康尼查罗反应)。在无机化学上,他应用了阿佛加德罗假说和杜隆-珀蒂定律来测定分子量和原子量。1860年他在《化学哲学课程大纲》里,把原子-分子的理论整理成一个协调的系统,并和有关的实验方法相贯通,他提出的有关原子量和分子量的正确概念,深得化学家们的赞许和承认,从而结束了长期存在的原子量、分子量等概念上的混乱局面,为化学的进一步发展扫除了许多障碍。
[布特列洛夫](Aπekcaндp Mиxaйπoвиц Ъyтлepoв,1828-1886)俄国化学家。1828年生于喀山省的契斯托波尔市。曾在喀山大学学习,并留校任教。1861年他在“德国自然科学家和医生代表大会”上做了《论物质的化学结构》的报告,强调了化学结构的概念,他指出有机化合物的化学性质与它的化学结构之间有一定的依赖关系,因此可以由其结构推测性质;也可依据其性质和反应来推测结构。是他首先提出了有关有机物的结构理论。在此理论基础上他合成了叔丁醇、异丁烯、乌洛托品和某些糖类化合物,并发现了异丁烯的聚合反应。他的理论与实践对有机化学的发展起着很大的推动作用。1864年写了《有机化学通论导言》,书中根据有机物的分子结构对有机物进行了分类。
[凯库勒](Friedrich August Kekule,1829-1896)德国有机化学家,1857年他提出“原子数”(即原子价)的概念,指出化合物分子是由不同原子结合而成,与某一个原子相化合的其它元素的原子或基的数目,取决于各成分的亲合力值(即原子价)。他还提到了氢、钾、氯、溴是一价的;氧、硫是二价的;氮、磷、砷是三价的;碳是四价的。1865年他提出苯分子为环状结构的论说。这些对有机化学的研究和发展都起了巨大的推动作用。他的著作有《有机化学教程》等。
[迈尔](Julius Lothar Meyer,1830-1895)德国化学家。1830年8月19日生于奥顿堡大公国的瓦勒尔。1854年在武兹堡大学获医学博士。由于他对科学的兴趣大于行医,所以他又向本生和基尔霍夫学习理化。1858年在布雷斯劳大学教物理和化学。1876年任图宾根大学化学教授,曾兼任校长。他在1864年写的《近代化学理论》一书中论及元素的性质跟原子量的关系,在书中刊出一个《六元素表》。1869年他把当时已知的56种元素按原子量递增的顺序排列,表明原子量跟原子体系的关系,并把这些元素分为族和副族。他还绘出原子量与原子体积的关系曲线;元素的熔点、挥发性、属性、脆性和电化性等的周期性,提出了原子量和元素的物理性质间的周期性关系的论述。迈尔提出的周期律偏重于原子量和物理性质之间的关系,而同年门捷列夫提出的周期律则比较全面、细致。此外他还发现了血红蛋白对氧的亲和力,并研究了呼吸生理学。迈尔死于1895年4月11日。著作主要有《近代化学理论》、《元素的自然系统》、《血液中的气体》等。
[诺贝尔](Alfred Nobel,1833-1896)瑞典的化学家和发明家。1833年10月21日生于斯德哥尔摩。他父亲是机械制造商、地雷发明家,这对诺贝尔的早期成长有很大影响。他在少年时就帮助其父搞水雷,17岁到美国留学,专攻化学。1863年回到斯德哥尔摩,开始从事改进硝化甘油的试验,几经失败,1867年9月3日在进行炸药实验时发生大爆炸,致使其父被炸残,其弟奥斯加被炸死。他冒着生命的危险,终于在1867年发明了安全的烈性炸药。1868年瑞典科学会奖给他父子“雷特斯泰特”奖。1875年他还发明了用硝化甘油和火药棉制成的强大威力的胶状炸药,1888年他又发明了混和无烟炸药,除了炸药和火器技术外,他在化学等领域还有许多发明,他在各国取得300多项发明专利权。诺贝尔一生勤奋,有着无穷的创造力,他把自己的全部精力献给了科学事业,终生独身,他在临终前留下遗嘱,将其遗产的一部分共920万美金作为基金,以其利息作为奖金(设物理、化学、生理与医学、文学、和平五种奖金)褒奖那些“曾赋予人类最大利益的人。”从1901年开始,每年在诺贝尔逝世日(12月10日),颁发各项诺贝尔奖金。
[门捷列夫](АлександрМихайовицЬутлеров,1834-1907)俄国化学家。1834年2月7日生于西伯利亚的托波尔斯克。1857年毕业于彼得堡师范学院,并获得金质奖章。曾在敖得隆中学任教,1859年获硕士学位,1859年到1861年到国外搞科学研究,1861年回国获博士学位,并应聘任彼得堡工业学院化学教授,后任彼得堡大学教授。他的主要贡献是比较全面和细致地发现和表述了元素的周期律,并预言一些当时尚未发现的元素及其主要性质。另外他还提出了溶液的水化理论,他的研究为建立溶液理论奠定了基础。1860年他发现了气体的临界温度。他在发现元素周期律方面获得的伟大成就,受到全世界的普遍尊敬,当选为英国皇家学会等十多个外国科学学会的会员,以及剑桥大学等许多国家高等学府的名誉博士称号。他的著作有《化学原理》等。
[纽兰兹](John Aloxander Beiua Newlands,1837-1898)英国化学家。1837年生于色棱克。19岁在英国皇家化学学院学习,是霍夫曼的学生。曾任女子医学校校长和伦敦学院的化学教授。1864年他发现把元素按原子量递增顺序排列时,每隔八元素就有物理性质和化学性质重复出现的现象,即所称的“八音律”,但当时未被人们承认还受到嘲笑。后来周期律被门捷列夫和迈尔发现了,这时才引起英国对纽兰兹的重视,1887年奖给他戴维奖章以表彰他的功绩。
[马可尼可夫](ВладимирВасилъевицМарков-ников,1888-1904)俄国有机化学家。1861年毕业于喀山大学。他受布特列洛夫化学结构理论的影响,1869年发表了“分子中原子的相互影响”的论文,1875年他从大量实验事实中总结出有机化学加成反应的定位法则:在烯烃和含氢的化合物发生加成反应时,氢原子总是加到双键两端含氢较多的碳原子上。
[帕金](William Henry Perkin,1838-1907)英国有机化学家。1853年他在皇家化学学院受业于霍夫曼,并任其实验助手。1856年他发现了苯胺紫染料,并很快投入工业化生产,成为合成染料工业的开端。1868年他由水杨醛合成香豆素,成为人工合成天然香料的开端。1869年他还研究出从蒽制茜素的方法,并从事茜素的工业生产。除在化学工业上的贡献外,他还发现芳香酮和脂肪酸酐在碱性环境下缩合成为α、β不饱和酸的反应(即帕金反应)。
[范特荷夫](Jacobus Hendricus Van't Hoff,1852-1911)荷兰物理化学家。1874年9月他与法国化学家勒贝尔(Joseph Achille Lebel,1847-1930)各自独立地提出碳原子的正四面体理论,他还描述了马来酸和延胡索酸的几何异构现象,提出这些物质中有不对称的碳原子,为立体化学打下了基础。以后他又发现了溶液中的化学动力学法则和渗透压法则。他还与德国的奥斯特瓦尔德(Ostwald,1853-1932)一起合办《物理化学杂志》并发表过许多文章。“物理化学”一词即由此开始的。他的成就为近代物理化学的发展,做出了重大的贡献。他的著作有《论原子在空间的构造》、《化学的动力学的研究》、《化学平衡的定律》等。
[拉姆塞](Willian Ramsay,1852-1916)英国化学家。1852年10月2日生于苏格兰的格拉斯哥。1870年毕业于格拉斯哥大学,后又在德国海德尔堡大学、戈丁根大学留学,受到良好的指导和严格的训练。1872年获哲学博士学位。他先研究有机化学,以后又致力于物理化学,曾在布里斯托尔大学和伦敦大学任教授。1894年至1898年他与瑞利(Ray-leigh 1842-1919)等人合作,先后发现了氩、氖、氦、氪等惰性气体。其中氦气原来以为只存在于太阳中,但他在1894年从钇铀矿物蜕变出的气体中发现了氦,说明地球上也有氦的存在。他还确定了这些惰性气体应排在周期表的零族。1904年因发现惰性元素获诺贝尔化学奖。他的主要著作有《近代理论与系统化学》、《大气中的气体》、《传记与化学论文集》等。
[莫瓦桑](Henri Moissan,1852-1907)法国化学家。1852年9月28日生于巴黎。12岁在密城公立专门学校学习,18岁因家贫辍学,后到药店学徒,在药店期间他曾用学到的化学知识救活了一服毒自尽者。20岁他转到博物馆学习。1886年他电解氟氢化钾(KHF2)成功地制出氟气。他还创用电炉冶炼出当时不常见的金属钨、铀、钒等。1906年获诺贝尔奖金。他曾任高等药学专门学院教授,但因平时他常在氟、一氧化碳等毒气环境中工作,致使健康受到影响,在1907年2月20日去世,终年55岁。他的遗产20万法郎由学校设为“莫瓦桑化学和药学奖金”。
[贝克勒尔](Antoine Henri Becquerel,1852-1908)法国物理学家。1895年起一直研究磷光现象,1896年他发现铀酰磷酸钾能使相片底片感光,也能使金箔验电器上的静电放电,从而发现了铀的放射性。他是研究放射性的先驱,他还研究过旋转磁偏极、红外光谱等。
[费歇尔](Emil Fischer,1852-1919)德国有机化学家。在生物化学及多肽和糖类的有机合成工作上有重要贡献。他确定过葡萄糖的结构式,以及咖啡碱和可可碱的化学结构,从而使人们对嘌呤的衍生物有进一步的认识。早在1899年他就开始蛋白质的化学研究。曾改进和发展了许多分析方法,确定了几种蛋白质的组成。他还用氨基酸合成多肽,使生化合成前进了一大步。此外他还阐明血红素的结构和有关鞣酸的研究。他在1902年获得诺贝尔奖金。
[奥斯特瓦尔德](Friedrich Wilhelm Ostwald,1853-1932)德国物理化学家。他在电化学、化学平衡、催化作用等方面的研究都做出了重要贡献。1894年他解释了酸碱指示剂变色的机理;1895年他提出对催化剂和催化作用的解释,指出催化剂只能加速平衡的到达,而不能改变平衡常数。他还根据阿累尼乌斯的电离理论对有机酸的电离平衡作了研究,发现了弱电解质的“稀释定律”公式。1907年他对胶体的形成和本质做出解释。他曾与荷兰的范特荷甫合办《物理化学杂志》,是物理化学创始人之一。但他也曾提出过错误的“唯能论”,给当时的科学工作带来一些不利的影响。他的著作有《普通化学教科书》、《普通化学大纲》、《理化测量实用书》、《分析化学的科学上的基础》、《电化学》等。
[阿累尼乌斯](Svante August Arrhenius,1859-1927)瑞典物理化学家。1859年2月19日生于瑞典乌普萨拉。1895年任斯德哥尔摩大学教授,1897年任该校校长。1887年他提出电解质在水溶液中会部分解离成自由离子的理论--阿累尼乌斯电离学说,这是物理化学初期的重要发现,1903年因建立电离学说荣获诺贝尔化学奖。他还在1889年首先注意到温度对反应速度的强烈影响,得到了阿累尼乌斯公式,用它可以求出均相或多相体系中的反应速度:对于计算活化能值有理论上和实际上的意义,对化学动力学理论的发展有十分重要的影响。他在晚年还研究了宇宙物理学和免疫性。阿累尼乌斯和奥斯瓦尔德、范特荷甫一起成为物理化学的奠基人。
[塔曼](Gustav Tammann,1861-1938)德国化学家、金属物理学家。在无机化学、物理化学和金属学等方面都有成就。首先他提出玻璃为过冷液体的原理。对晶核生成和晶体的生成方面曾发表过系统的论述,并确定晶核数目和晶核生长速度以及与过冷度之间的关系。此外他对合金的相平衡及溶液的蒸气压等方面也作了深入的研究。
[豪尔](Charles Martirr Hall,1863-1914)美国化学家、发明家和冶金专家。他在学生时代就曾下决心要制出廉价的铝,当时铝的价格十分昂贵。1886年,年仅23岁的豪尔在设备不全的实验室里,用自制的蓄电池制出了铝,从而发明了铝的商业制法,使铝成为廉价的有实用意义的金属。豪尔在1911年获得帕金奖金。
[埃罗](Paul Louis Toussaint Héroult,1863-1914)法国冶金学家。1863年生于图利·哈耳科特。1885年他电解了各种铝的化合物,当他发现电解冰晶石时,铁阴极不到铁的熔点时即熔化;电解氯化铝钠时电极也被腐蚀,通过不断的观察和研究发明了电解法制铝。他与美国的豪尔同时独立地发明了廉价的制铝方法。此外,他还发明电炉,这对炼钢有重大贡献。
[能斯特](Walther Hermann Nernst,1864-1941)德国物理化学家。1889年他提出溶解压理论,从热力学理论导出了电极电位公式,即“能斯特公式”。同年还提出溶度积理论以解释沉淀反应。1906年创立了热力学第三定律,即“能斯特热定理。”他在物理化学上作出了重要的贡献,此外他还曾研究过氮与氧直接化合成氮的氧化物的工业生产问题。1920年获诺贝尔化学奖。
[维尔纳](Alfred Werner,1866-1919)瑞士化学家。苏黎世大学教授,1890年提出络合物的立体化学理论,并初次提出“配位数”的概念,他研究了非碳的旋光性物质。他的理论成为络合物化学的重要理论,这些理论给无机化学的发展和化合价的电子学说开辟了新的途径。1913年获诺贝尔化学奖。
[居里夫人](Marie Shlodowska Curie,1867-1934)法国物理学家、化学家。原籍波兰,1891年去巴黎大学学习,1895年与法国物理学家比埃尔·居里结婚。他们共同对贝克勒尔发现的放射现象进行研究,经过反复试验,从沥青铀矿中发现了钋。1902年又从数吨沥青铀矿中提炼出微量的氯化镭,并测出了镭的原子量是225。由于这一发现,获得了诺贝尔奖金。1906年比埃尔逝世后,她继续研究放射性并取得巨大成就,建立了放射化学。她不要发现镭的专利权,而把镭的知识公布于众。其女伊兰·居里和其婿约里奥·居里也都是著名的核物理学家。居里夫人的主要著作有《放射性通论》、《放射性物质的研究》等。她是法国的第一位女教授,也是法国科学院的第一位女院士。她于1911年再次获得诺贝尔化学奖金。
[哈柏](Fritz Haber,1868-1934)德国化学家。1906-1911年任德国卡尔斯鲁厄工业大学教授,1911年任威廉物理化学及电化学研究所所长兼任柏林大学教授。1933年因不满德国的纳粹政权而到英国讲学。他的最大成就是在卡尔斯鲁厄任教期间完成的氨的合成法,前人曾用一百多年时间,试图由氮氢直接合成氨,但未成功。哈柏经多次实验后,终于在1901年用锇催化剂使合成氨的产率达到6%,这样的产率具有工业生产的价值。1909年他又使未反应的氮气和氢气循环使用,解决了合成氨的生产中的关键问题。这一方法经波许(Bosch)推广到工业化生产中,世称“哈柏-波许法”。1913年德国的巴登苯胺纯碱公司建成了世界上第一个合成氨厂,日产60吨。他毕生研究气体反应和化学平衡。主要著作有《工业气体反应热力学》等。1918年获诺贝尔化学奖金。
[格林尼亚](Victor Grignard,1871-1935)法国有机化学家。他于1901年发现了“格林尼亚”反应,用卤代烷和金属镁在无水乙醚中反应,生成烷基卤化镁(RMgX)称为格氏试剂,可与含有活泼氢的化合物(如H2O、ROH、RNH2、RCOOH等)及醛、酮等化合物反应,或与金属卤化物、非金属卤化物等分别反应而得到相应的化合物。它是有机化学里的重要反应,因此1912年获诺贝尔化学奖金。此外,他还提出过利用有机镁进行合成等方面的论文。
[卢瑟福](Ernest Rutherford,1871-1937)英国物理学家。1871年8月20日生于新西兰的纳尔逊。他长期在英国工作。1898年任加拿大的马克居耳大学物理教授,以后又任英国曼彻斯特大学、剑桥大学教授和卡文迪许研究所所长。他的主要贡献在放射学方面,1899年他发现放射性辐射中有α射线和β射线两种成分的存在,接着又发现新的放射元素“钍”。1902年他与英国化学家索迪(FredericSoddy,1877-1956)共同提出原子的自然蜕变理论。1911年根据α粒子的散射实验,最初发现了原子核的存在,并提出关于原子结构的行星式模型。1919年用α粒子轰击氮原子而获得氧的同位素,第一次实现了元素的人工蜕变。1908年获诺贝尔化学奖。
[茨维特](M.C.Цвeт,1872-1919)俄国植物学家。他创立了色层分析法。他对一百多种吸附剂如氧化镁、菊根粉、碳酸钙等吸附植物色素的情况进行研究,并对多种淋洗液的性能进行探讨。他成功地把植物中的不同色素在吸附柱上展开,用不同的溶剂淋洗而提纯了许多色素。他还提纯过卵磷脂。但当时色层吸附法没有被化学家重视,直到1931年德国化学家库恩(Richard Knhn,1900-1967)等人用这种方法将当时人们误认为是单一晶体的胡萝卜素分为α与β两种同分异构体,色层吸附法才很快被人们所重视,并很快地发展起来。
[维尔斯太特](Richard Willstātter,1872-1942)德国化学家。他主要研究生物碱和酶化学。在1894年他阐明了莨菪碱(阿托品)的化学结构,发现了阿托品和古柯碱等成分里的主要部分。他还深入和系统地研究酶化学,并得到许多较纯的酶。他经过长期的研究,阐明绿叶细胞中以3∶1的量存在的叶绿素a和叶绿素b都是镁的络合物,并阐明了它们的结构。此外,在研究纤维素和淀粉的结构组成与水解产物方面他也有所贡献。
[路易斯](Gilbert Newton Lewis,1875-1946)美国物理化学家。美国加利福尼亚大学和马萨诸塞理工学院教授。1901年和1907年他在《美国科学技术学会会志》上发表了有关“逸度”和“活度”的文章,他首先提出了“逸度”的概念。在1916年提出了共价键的电子理论,解释了共价键的饱和性。1932年他与兰得尔(Merle Randall)合著的《热力学及化学物质的自由能》里讨论了有关化学平衡问题,给予自由能、活度等概念以新的意义。1937年以后他集中研究酸碱理论,提出了“路易斯酸碱理论”。他的主要著作有《原子价与原子分子结构》等书。
[兰茂尔](Irving Laugmuir,1881-1957)美国物理化学家。首先发现氢气吸收大量热而离解为原子的现象,其结果被应用于氢原子焰焊接法。在表面吸附方面,提出了单分子吸附层的理论和著名的“兰茂尔吸附公式”。1917年设计了“表面天平”,用它可以测出液面上的不溶物表层的表面积,并由此计算出这些物质的截面积,建立了表面分子定向说,并论述了单分子表面膜和有关固体表面吸附性质和行为的理论。在原子结构问题上,他发展了电子价键的近代理论。他还首次实现了人工降雨。
[施陶丁格](Hermann Standinger,1881-1965)德国化学家。他主要研究高分子化合物。1920年提出乙烯的聚合可能是链式反应。他还提出由小分子聚集而成的亲液胶体物质是数以万计的原子通过一般化学键所组成的高聚物,由于大小悬殊故有不同于低分子量化合物的性质。还确立了高聚物溶液的粘度与分子量之间的关系。这些理论对塑料等高分子工业的发展有很大的促进作用。
[玻尔](Niels Henrik David Bohr,1885-1962)丹麦物理学家。他在1913年综合了普朗克(Max Plank,1858-1947)的量子理论、爱因斯坦的光子理论、卢瑟福的行星型原子结构模型的有关论点,提出了氢原子光谱和氢原子结构的初步理论。他还提出量子论的对应原理。玻尔的原子结构理论是原子结构学说上的一个重大发展,用它能解释和计算出符合实验的正确结论。此外,他在原子核反应理论和解释重核裂变现象等方面也有重要贡献。但以他为首的哥本哈根学派,对量子力学作出的基本解释,却反映了唯心主义的哲学观点。
[阿斯顿](F.W.Aston,1877-1945)英国物理学家。对同位素和质谱仪进行了深入研究。1919年他首次制成聚焦性能较高的质谱仪,准确度是千分之一;以后又加以改进,1925年制成第二型质谱仪,准确度达到万分之一;1937年制成第三型质谱仪,准确度为十万分之一。利用质谱仪可以直接测定:一种元素所含核素的种数;每种核素的质量及核素的丰度。根据测定核素的质量与丰度,便可计算出平均原子量。由于这一贡献,他在1922年获诺贝尔化学奖。
[哈沃思](W.N.Haworth,1883-1950)英国有机化学家。他主要从事糖类研究。他与希尔斯特(Hirst)共同研究了糖类的分子结构,特别是单糖的环状结构。他所设计的“端基”法是测定多糖重复单位特性的方法。他还对维生素进行研究,阐明了维生素的结构,并于1937年合成了维生素C。由于他在糖类和维生素研究上的重大贡献,1937年获诺贝尔化学奖。他的主要著作有《糖的构成》等。
[德拜](P.J.W.Debye,1884-1966)美籍荷兰物理学和物理化学家。主要研究固体量子理论,1912年发现了“德拜”定律,奠定了电解质偶极理论。1910年制定了观察X射线干涉的理论和方法,研究过溶液中分子的偶极矩,偶极矩单位“德拜”即是以他的名字命名的。1923年和休格尔(Hückel)一起制定了强电解质理论,对强电解质稀溶液依数性偏差提出了理论的解释。他还研究过聚合物的结构。由于他对偶极矩的研究和用X射线衍射法测定分子结构上的贡献,于1936年获诺贝尔化学奖。
[赫维西](George de Hevesy,1885-1966)匈牙利化学家。他于1913年证明RaD是铅的同位素,这一发现为后来的大量放射分析法奠定了基础。他与荷兰物理学家科斯特(Coster)合作,发现了第72号元素铪。1934年他利用人工放射同位素作示踪原子研究动物的生理机能,并获得重大的成就。他于1943年获得诺贝尔化学奖。
[莫斯莱](Henry Gwyn Jefferys Moseley,1887-1915)英国物理学家,毕业于牛津大学,随卢瑟福研究放射现象。1913年他用不同材料制成X射线管的对阴极(即阳极靶),测得五十多个元素的X射线光谱,发现光谱特征线的频率和元素原子序数成比例。原子序数就是原子核的正电荷数,是决定元素性质的主要因素。按这个序数排列的元素周期表就要比按原子量排列的更正确,几个元素的位置与原子量大小不一致的地方都获得了解释。他的这一项贡献对周期律、光谱分析法以及原子结构理论的发展都起了重大作用。他有惊人的实验技巧和渊博的知识,不幸在第一次世界大战中阵亡。
[海洛夫斯基](Haroslav Heyrovsk,1890-1967)捷克斯洛伐克化学家。早年留学英国,后回国任布拉格大学教授。他主要研究电化学,他用水银小滴电极测量电压增加时通过溶液的电流情况,绘制出曲线,建立了极谱分析法。使用这种方法可以测出溶液的微量物质。1925年他与日本的志方益三共同创造出世界第一台自动照像记录极谱仪,用它记录了铅、锌、镉、汞、硝基苯的极谱图。他的主要著作有《分析化学物理方法》等。1959年获诺贝尔化学奖。
[尤里](H.C.Urey,1893-1981)美国化学家,1931年他用光谱法发现重氢(氘),这是本世纪三十年代初世界科学界的一件大事,因此他荣获1934年诺贝尔化学奖。他在同位素化学方面有重大贡献,经过他的研究,使同位素的分离开始有了化学方法。在第二次世界大战期间,他领导了使重水和铀同位素的大规模分离工作,使第一批原子弹生产成为可能。他对同位素的热力学性质以及用化学过程来探讨太阳系的演化等方面的研究都作出了卓越的贡献。
[库恩](Richard Kuhn,1900-1967)德国有机化学家及生物化学家。1933年先后发表了许多有关胡萝卜素结构方面的研究成果,1936年他合成核黄素(维生素B2);确定了抗皮炎素(维生素B6)的结构,还合成了约300种植物性颜料。他发表的论文有700篇左右,内容涉及维生素、生物化学、辅酶等方面的研究。1938年被授予诺贝尔化学奖。
[泡利](Wolfgang Pauli,1900-1958)物理学家,生于奥地利。他主要成就是在量子力学、量子场论和基本粒子理论方面。他创立的“泡利不相容原理”对原子结构的研究有重大贡献。另外,他提出β衰变中的中微子学说,对理论物理学的发展有一定贡献。
[鲍林](Linus Pauling,1901-)美国化学家和物理学家。1901年2月28日生于俄勒冈州波特兰市。1922年在加利福尼亚理工学院获博士学位,1931年任该院化学教授,现任里纳斯·鲍林科学和医学研究所的研究教授。他在化学键理论上卓有成就,他用量子理论探讨原子里电子的行为而发展了“价键法”。他创立的计算元素电负性方法是几种电负性计算法里重要的一种。他曾从量子理论原理提出氙可能生成氟化物,后来加拿大化学家巴特莱 (N.Bartlett)在1962年制得红色固体XePtF6。1931年鲍林和斯莱特(J.C.Slater)共同提出“杂化轨道”理论,他们利用电子具有波动性,而且波可以叠加的观点,提出碳原子在成键时s轨道和p轨道能够叠加混杂而形成杂化轨道,对价键理论作出了重大贡献。1950年他提出在分子内部肽键要最大限度地满足氢键的原理,指出多肽可能形成螺旋体结构,这对蛋白质的结构研究起了重要推动作用。鲍林是把量子力学应用于研究化学结构的先驱者之一,他还是共振论的主要创立者。1954年荣获诺贝尔化学奖。他还致力于把物理学和化学结构理论的知识应用于生物学和医学研究,他在血清系统的性质以及抗体及抗原的蛋白质结构、普通麻醉剂的分子基础,异常酶和精神病关系以及确定镰形细胞贫血的致病原因等方面都做过开创性的工作。鲍林科学和医学研究所的目标是在分子的水平上对病菌或病毒引起的疾病直接进攻。他的工作成就卓著,发表的科学论文400篇以上,出版的著作有14种,最有代表性的著作是《化学键的本质》。他还是一位国际上知名的社会活动家,曾获得1962年诺贝尔和平奖。
[伍德瓦德](Rober Burns Woodward,1917-1979)美国有机化学家。1937年获麻省理工学院博士。1938年起到哈佛大学执教。1952年他首先提出二茂铁的夹心式结构,这在当时是很难想象的。他参加测定过青霉素、马钱子碱、土霉素和金霉素等有机化合物的结构,并合成了奎宁、胆甾醇、皮质酮、马钱子碱、利血平、叶绿素、四环素、维生素B12等,这些合成工作代表了当今有机合成的最高水平,特别是维生素B12的合成是有划时代意义的。在有机化学理论方面,1965年他和量子化学家霍夫曼合作发表分子轨道对称守恒原理。这是近年来化学理论方面的最大成就,对有机合成有重要的指导作用。1965年因在有机合成上的重大贡献,荣获诺贝尔化学奖。他毕生致力于有机化学的教学与研究,他工作作风严谨,是个不知疲倦的科学探索者。他在哈佛大学执教四十余年,共培养研究生和进修生500多人,其中许多已成为世界闻名的化学家。
[西博格](Glenn T.Seaborg,1912-)美国化学家。1934年获加利福尼亚大学化学学士学位。1937年在核子化学研究中获博士学位。第二次世界大战期间,他在芝加哥大学的金属研究所主持用化学萃取法制取钚的工作。1946年后任辐射研究所主管,同时兼任加利福尼亚大学名誉教授。1961年任美国原子能委员会主任委员。1951年获诺贝尔化学奖。他和同事一起发现放射性钚-239和铀-233,还发现了放射性的铁-59与碘-131。他提出锕系元素的概念与它们的电子排布,他还发现了超铀元素镅和锔。他对中学教育也很热心,担任过美国的国家科学基金会的化学教材研究会和高中教材改进研究会主任委员。
[魏伯阳](约100-170年)中国东汉时期的炼丹家。名翱,号伯阳,后人称他“云牙子”。会稽上虞(今属浙江)人。著有《周易参同契》,是世界上现存的最早一部炼丹著作,记录了我国古代炼丹的理论与实践。他认为“易经”理论、道家哲学和炼丹术三者是统一的。该书记录的有关化学知识和观察到的化学事实主要有:(1)水银容易挥发,也容易跟硫黄相化合,(2)氧化铅能被炭还原成铅,(3)几种不同金属可以组成合金,(4)从汞矿石可以制得红色硫化汞,(5)黄金不容易氧化,(6)物质起化学反应时的比例很重要等等。鉴于炼丹术和道教相结合,披上一层神秘的宗教外衣,所以在《周易参同契》中有很多神秘荒诞和隐奥莫测的内容。
[葛洪](约281-340年)中国东晋的炼丹家。字稚川,自号抱朴子,人称葛仙公。丹阳句容(今江苏句容县)人。他曾受封为关内侯,后隐居罗浮山炼丹。著有《抱朴子》、《肘后备急方》、《西京杂记》等,其中丹书《抱朴子·内篇》具体地描写了炼制金银丹药等多方面有关化学知识,也介绍了许多物质的性质和变化。内容比魏伯阳的《周易参同契》丰富而具体,而且隐讳的内容较少。它涉及的知识有:(1)最早详细地记录反应的可逆性和物质相互转化的实验现象,(2)叙述了金属置换作用的实验事实,(3)制得外表如黄金、白银的几种合金,(4)列举某些化合物的性质及升华提纯的操作要点,(5)汇集了多种炼丹的矿物原料,说明人们认识和应用天然矿物质的范围扩大了。由于历史条件,在《抱朴子·内篇》中仍充满了迷信色彩,宣扬了服丹长生不老之说,但该书集中地反映了当时我国在化学上的成就。葛洪是我国炼丹术发展过程中的一位重要人物,颇受国内外化学史界的重视。
[沈括](1031-1095年)中国北宋的科学家和政治家。字存中。杭州钱塘(浙江杭州)人。宋仁宗嘉祐年进士。神宗时参加王安石变法。他担任过司天鉴、翰林学士、权三司使、知延州等职务,晚年居润州(今江苏镇江东郊)。他的《梦溪笔谈》是一部百科全书式的著作,讨论的问题十分广泛,其中有许多有关化学的知识,如灌钢技术、由胆矾水炼铜等。他还根据陨石的比重和外观断定陨石的主要成分是铁;用比较严格而正确的方法鉴别硫酸盐。他到过许多地方,接触了很多工匠和劳动人民,记载了他们的发明创造,如1080年他在陕北看到老百姓收集石油来点灯,用石油燃烧的烟炱制成墨。“石油”这个名词就是沈括最早使用和写入书籍中的,他曾预言“此物后必大行于世”。《梦溪笔谈》这部书在积累、总结和传播古代化学知识方面起了重要的作用。
[李时珍](约1518-1592)中国明代的医药家。字东壁,蕲州(今湖北蕲春)人。他著有《本草纲目》,其中记有1892种药物,药物中的无机物就有266种,而且在有关化学知识上较前人有较大的提高,他把前人和自己实验的知识系统化。《本草纲目》里把无机药物分为水、土、金、玉、石、卤六类,水部包括许多水溶液,土部包括各种土壤和烧过的泥土,金类包括金属、某些合金以及一些金属化合物的制成品,玉类主要是较纯的硅的化合物,卤类大部分是能溶解于水的盐类。《本草纲目》在17、18世纪传到日本、朝鲜和欧洲,被译成英、德、法、拉丁、俄、日等多种文字,在世界上广泛流传,并得到很高评价。
[宋应星](1587-1655)中国明代科学家。字长庚。江西奉新县人。他在科举失败后专心治学。他到农村田间和手工业作坊中做过长期调查,写成了巨著《天工开物》。该书图文并茂,出版于明末崇祯十年(1637年),书中用很大的篇幅分门别类,有系统、有重点地介绍了冶铁、炼锌、金属加工、染色、陶瓷、制盐、造纸、制糖等工艺技术,如在《冶铸》篇,记载了明代三种典型的铸造工艺,即失蜡铸造、实体模型和无模铸造;在《五金》篇里,记述了由铁矿炼成生铁,生铁炼成熟铁,再由生铁和熟铁合炼成钢的全部生产过程和操作方法。该书17世纪传入日本,18世纪传到欧洲,成为世界科学技术史上的名著之一,被誉为“工艺百科全书”。
[徐寿](1818-1884)中国化学家。号雪邨,江苏无锡人。1862年清朝政府兴办洋务,他曾任安庆军械所的工程技术人员,从事制造我国第一艘“黄鹄号”木质轮船。1867年到江南制造总局(江南造船厂前身)工作,他参与制造我国第一批兵船及各式火炮。与此同时,他用了大量时间从事近代科学书籍的翻译工作,将西方近代化学知识系统地介绍到我国来,为我国化学教育做了先驱性的工作。他共翻译了13部科技书籍,其中化学方面的书籍有:《化学鉴原》(6卷,普通化学)、《化学鉴原续编》(24卷,有机化学)、《化学鉴原补编》(7卷,无机化学)、《化学考质》(8卷,定性分析)、《化学求数》(8卷,定量分析)、《物体遇热改易记》(四卷,物理化学初步知识)、《宝藏兴焉》(16卷,冶金)等。徐寿在元素和化合物的汉语命名等方面用音译方法,巧妙地制造了新字,其中许多化学元素名称,如钠、钾、锰、钴等至今还在沿用。1875年他发起成立格致书院(相当于学会性质的机构),他在讲演化学问题时,配合演示实验,收效甚好。他致力于化学事业,大量引进西方先进的化学知识,不愧是我国近代化学的先驱者。
[丁绪贤](1885-1978)化学史家。安徽阜阳人。清末秀才,1904年入江南高等学校,1908年留学英国,1909年入伦敦大学化学系,是英国著名化学家拉姆赛的学生,1916年冬回国。1917年发起成立“理化学会”,创办的《理化杂志》为我国早期的自然科学期刊之一。曾任北京大学化学系教授、系主任。他主张把科学史列为高校教学内容,他写的《化学史通考》是我国出版的世界化学史名著。他认为学习化学史有以下几点好处:(1)打破狭窄的专业局限、统观化学全局、扩充眼界;(2)养成看问题的发展观点和正确的历史观;(3)从根本上给人们一种训练,提供化学知识的稳固基础;(4)从前人的成败中得到借鉴,观往知来、继承优秀遗产。
[赵承嘏](1885-1966)有机化学及药物化学家。江苏江阴人,清末秀才。1910年去英国曼彻斯特大学学习,是英国有机化学家帕金的学生。他是应用科学方法进行中草药研究的创始人之一。他对植物化学特别对生物碱的分离结晶有独到的专长。曾系统地研究了麻黄、雷公藤、细辛、三七、贝母、常山、防己、钩吻、延胡索等三十种中草药的化学成分,发现许多新的生物碱,例如,从延胡索植物中分离出13种生物碱的结晶、从钩吻植物中分离出7种生物碱的结晶等。他一生勤恳好学,80高龄仍每天坚持工作五、六小时,坚持亲自做实验不肯假手他人,临终当天早晨仍去实验室工作,因实在坚持不住了,才回家休息,于当天下午逝世。
[张子高](1886-1978)化学家和教育家。湖北枝江县人。曾考中秀才,清末第一届官费留美学生。1909年入美国麻省理工学院学习化学,是著名化学家诺伊斯(A.A.Noyes)的学生,他为建立硫化氢定性分析系统做出贡献。张子高和王琎等共同发起组织《中国科学社》,对传播世界先进科学成果做出了贡献。他自1929年起任清华大学化学系教授、系主任、副校长。著有《中国化学史稿》(古代部分)一书,总结了中国古代化学的发展。他一生俭朴,把全副精力贡献给祖国的教育事业。
[王琎](1888-1966)分析化学家。他是我国分析化学和中国化学史研究的先驱者之一,他以分析实验为依据,并与历史考证相结合,开创我国应用新法研究化学史的新河。他曾对五铢钱的化学成分作过专题研究,正确区别了汉、魏、晋(南北朝)和隋的五铢钱。他还用分析结果,澄清了各种我国开始用锌年代的传说,得出我国自明朝嘉靖年间开始用锌的正确结论。
[侯德榜](1890-1974)工业化学家。福建闽侯(今福州市)人。1911年考入清华学堂,1913年赴美留学,入麻省理工学院学习化工,其后在哥伦比亚大学研究院学习、并获得博士学位。1921年应我国知名实业家范旭东的邀请,离美回国,负责塘沽永利碱厂的设计与投产,1932年又负责筹建永利宁厂(即南京硫酸铔厂),这两大化工企业的投产,为我国化学工业的发展奠定了基础。1937年抗日战争爆发,范旭东、侯德榜坚贞爱国,拒绝与日本侵略者合作,毅然放弃沽、宁两厂,率众西撤入川,筹建永利川厂。由于井盐成本昂贵、苏尔维法食盐转化率仅为70%,他全力探索制碱的新法,1940-1943年间,在他的统一指挥下,一批有志之士奋发努力,制碱新法终于取得成功,把制碱与合成氨工业联合起来,使食盐的利用率提高到98%以上,此即“联合制碱法”,后被命名为“侯氏制碱法”。1943年12月在中国化学会十一届年会上公布侯氏制碱法后,很快得到世界各国的公认。侯德榜作为世界制碱的权威,先后获得英国化学工业学会荣誉奖章、美国哥伦比亚大学奖章,荣任英国皇家学会会员、美国化学工程学会会员、美国机械学会会员和美国机械工程学会的终身荣誉会员等,为中华民族争得了荣誉。解放后他任化学工业部副部长、中国科学院学部委员、中国化学会、化工学会理事长等职,为我国化学与化工事业的发展作出重大贡献。1958-1965年他主持设计碳化法合成氨流程制碳酸氢铵工艺,并大力推广小合成氨的生产,建立了我国大、中、小相结合的化肥工业体系。他一生著作甚多,主要有两部:一是《纯碱制造》,该书第一次将氨碱法的全部理论与技术秘密公诸于世,轰动整个化学界,风行世界各国,是公认的制碱权威著作。二是《制碱工学》,全书共80余万字,这部专著内容丰富,全面总结了作者从事制碱工业数十年的研究成果和实践经验。
[庄长恭](1894-1962)有机化学家。福建泉州人。1921年毕业于美国芝加哥大学,1924年获博士学位。1931年赴德国戈丁根大学及慕尼黑大学研究有机化学。1948年任台湾大学校长,解放前夕离台返回大陆。任中国科学院有机化学研究所所长、中国科学院学部委员,中国科学院数理化部学部副主任。他毕生从事科学研究和高等教育事业。1933年他研究麦角甾醇的结构,1934-1938年他从事跟甾体有关的化合物的合成工作,对多环化合物化学的发展起了有力的推动作用。他在有机合成,特别是在甾体化合物的合成,以及天然产物结构的研究方面做出重大贡献,因此在国际有机化学界享有盛名。他治学态度严谨,十分热心高等化学的教育工作,对我国有机微量分析的建立,起了重要作用。
[杨石先](1896-1985)化学家与教育家。浙江杭州人。1918年毕业于清华学校(清华大学前身)高等科,1931年获美国耶鲁大学博士学位,回国后在南开大学任理学院院长。解放后历任中国科学院学部委员、国家科委化学专业组组长、南开大学校长、元素有机化学研究所所长、中国科协副主席、中国化学会理事长等。他根据所观察到的化学结构与生理活性之间的联系,筛选出适合我国生产工艺的含氯丙烯季胺盐类新植物激素“矮健素”,它能使小麦、棉花增产10-20%,并可增强抗旱和抗碱能力。他是有机磷化合物的专家,在农药方面先后制成了杀虫剂有久效磷、螟岭畏;除草剂有燕麦敌、胺草磷;杀菌剂叶枯净等。在元素有机化学理论方面也取得了可喜的成绩。
[黄鸣龙](1898-1979)有机化学家。江苏扬州市人。早年赴瑞士和德国留学,1924年获德国柏林大学博士学位。他最初从事植物化学研究,1938年转到研究甾体化学。1940年在解决山道年一类物质的相对构型等立体化学研究方面,获得了新的发现。1946年他在美国从事科学研究期间,对“开西纳-武尔夫”(Kisher-Wolff)还原法作了卓有成效的改进,被国际上广泛应用,并称作“黄鸣龙还原法”。1952年回国后,开展甾体植物资源的调查和甾体激素的合成研究,他是我国甾体激素药物工业的奠基人,并培养了一批从事甾体化学的专门人才。他是中国科学院学部委员,并担任过国际《四面体》杂志的名誉编辑等。
[曾昭伦](1899-1967)化学家。湖南湘乡人。1915年考入清华留美预备学校,因学习成绩优良提前毕业,1920年赴美公费留学,在麻省理工学院攻读化工,后又转攻化学,1926年获科学博士学位,同年回国任南京中央大学化学系教授、系主任。1931-1936年在北京大学化学系任教,兼系主任,在这期间,他积极推行教育改革,大力提倡化学科学研究--他是我国化学界最早提倡要搞科学研究的人,他亲自带领学生在很多领域做了大量的研究工作,成绩卓著,代表了30年代我国化学研究的部分水平,有的还受到国际化学界的重视。他还在有机理论、分子结构及炸药化学、近代化学史等方面作了不少有价值的研究工作。1937年抗日战争爆发,北京大学等校迁到昆明,在西南联大化学系任教。解放后曾任高教部副部长、中国科学院化学研究所所长、全国高分子委员会主任。1955年当选为中国科学院学部委员。他关心我国化学名词的统一和命名工作,倡导在我国开展元素有机化学的科学研究,并组织撰写了《元素有机化学》丛书,该书是我国第一本元素有机化学方面的专著。
[黄子卿](1900-1982)物理化学家。广东梅县人。青年时期他抱着“中国不能没有科学”的心愿,三次赴美国攻读化学和从事科学研究。1934-1935年他在美国麻省理工学院精确测定了水的三相点(0.00981℃)--这一国际上通用的标准数据,因而被选入美国的世界名人录。1954年在巴黎召开的国际温标会议上再次肯定黄子卿测定的数据,并以此为标准确定绝对零度为273.15K。1949年回到祖国,他说:“我是中国人,我要为中国的科学事业努力。”他曾任中国化学会副理事长、中国科学院学部常委兼国家科委化学组委员、北京大学物理化学教研室主任。他是我国物理化学事业奠基人之一。他编著的《物理化学》等书,一直是国内物理化学教学的主要参考书。
[傅鹰](1902-1979)胶体化学和表面化学家。福建福州人。1919年进燕京大学学习,1922年赴美国密执安大学留学,1928年获科学博士学位。1945年再度赴美,继续在密执安大学研究院工作。他虽身在异国,但向往真理,热爱祖国。1950年10月回到祖国。1954年他任北京大学化学系胶体化学教研室主任。1962年任北京大学副校长,并当选为中国科学院学部委员、《中国科学》编委。早在40年代,他就以热力学为工具,研究溶液的吸附,对固-液界面和气-液界面的吸附层性质作了多方面的考察,设计了一种计算表面活度系数的方法。50年代以来,他继续指导学生研究吸附问题;开展了硅胶的制备、吸附和热稳定性、白土的吸附、润湿性、吸附色谱、金属膜上化学吸附和
[化学]自然科学的一门基础学科。它是研究物质化学运动的科学。主要包括:物质的组成、结构、性质、变化及其相关的现象、规律和原因;物质在自然界的存在、提取、人工合成和应用。
化学起源于人类的生产实践,从火的利用到烧制陶器、冶炼金属以及酿酒、造纸、染色等工艺的出现,均属于实用化学工艺时期。直到十七世纪英国化学家波义耳提出了科学的化学元素概念,化学的发展极为迅速。主要表现在对物质结构与化学变化的规律有了较深刻的认识,各种不同类型物质大量地被合成出来,形成了庞大的化工体系。
按照研究物质的化学运动的对象和方法不同,化学通常分为无机化学、有机化学、分析化学、物理化学等基础学科。随着化学在各方面的应用,化学与其它学科的结合及新技术、新材料的发展,又陆续形成了许多新的分支和边缘学科,例如:农业化学、生物化学、海洋化学、环境化学等。
[无机化学]化学的基础学科。它是研究碳氢化合物及其衍生物以外的全部元素和它们的化合物的性质、结构、变化规律及应用的化学学科。
在最近几十年中无机化学发展很快,派生出稀有元素化学、络合物化学、同位素化学、金属间化合物化学等新的分支学科。无机化学的发展对解决矿产资源的综合利用,近代技术中所迫切需要的原材料等有重要的作用。
[有机化学]化学的基础学科。它的研究范围是碳氢化合物及其衍生物的来源、制备、结构、性质、用途及其有关理论。有机化合物都含有碳,并以碳氢化合物为母体,所以有机化学又可称为“碳化合物的化学”或“碳氢化合物及其衍生物的化学”。
在人类已发现的化合物中,有四百多万种是有机化合物,比无机化合物多三十多倍。随着有机化学的发展,已派生出天然有机物化学、高分子化学、元素有机化学、药物化学等分支学科。
[分析化学]化学的基础学科。它是研究物质的化学组成及其有关理论的学科,根据分析任务,可以分为定性分析和定量分析两个部门。
定性分析的任务是鉴定物质的成分,即检出化合物或混合物是由何种元素所组成;定量分析是测定各组成部分间的数量关系。根据分析方法,可分为化学分析和仪器分析两大类。就试样用量的不同,分析化学可分为常量、半微量和微量分析。分析化学的发展促进了其它学科和技术科学的发展,并在国民经济各部门有着广泛的应用。
[物理化学]又称理论化学。化学的基础学科。应用物理学原理和方法研究有关化学现象和化学过程的一门学科。内容包括:物质结构、化学热力学、化学动力学、电化学、光化学、胶体化学等部分。主要从理论上探讨物质结构与其性质间的关系;化学反应的方向和限度以及化学反应的热效应;化学反应的速度和机理等。它是整个化学学科和化学工艺学的理论基础。
[理论化学]即“物理化学”。
[化学热力学]物理化学的一个分支,研究热力学原理在化学方面的应用,主要任务是解决化学和物理变化进行的方向和限度,特别是对化学反应的可能性和平衡条件作出预示,化学热力学能独立地解决如何判定化学过程的自发性问题。化学热力学的内容一般包括普通热力学、溶液、相平衡、化学平衡等。
[化学动力学]物理化学的一个分支,主要研究化学反应速度和控制反应速度的因素,并根据反应速度与控制反应速度的因素之间关系推测化学反应的机理。化学动力学也称反应动力学。
[热化学]物理化学的一个分支,研究物理和化学过程中的热效应规律的一门学科,即对于随着化学反应和状态的变化而发生的热的变化的测量、解释和分析,它是以热力学第一定律为基础,在量热计中直接测量变化过程的热效应,是热化学的重要实验方法。热化学的数据(如燃烧热、生成热等)在热力学计算、工程设计和科学研究等方面都有广泛应用。
[电化学]物理化学的一个分支,主要研究化学能与电能间相互转变的规律,如电极电位、电解、电镀、原电池、电化学腐蚀、化学电源等,都属于电化学的范围,是一门密切联系生产的学科。电化学在国民经济中有着极重要的应用。
[胶体化学]物理化学的一个分支,研究胶体溶液的一门学科,胶体溶液分散微粒的直径一般在10-9-10-7米之间,分散微粒直径大于10-7米的粗分散系(即浊液)一般也包括在胶体化学的研究范围之内,高分子溶液其微粒大小与胶体溶液相似,其性质虽有所区别,但也包括在胶体化学的研究范围之内。胶体化学的内容有三部分:(1)胶体溶液及粗分散系的物理化学;(2)高分子溶液的物理化学;(3)表面化学。它在石油工业、选矿、食品工业、橡胶、纤维、塑料工业以及农业、医学等方面均有广泛的应用。
[化学物理学]化学和物理学间的一门边缘科学。研究对象以宏观为主的属于物理化学,以微观为主的则属于化学物理学。化学物理学包括量子化学、分子光谱、各种衍射方法、结晶化学、物质结构的统计理论等。
[量子化学]应用量子力学的规律和方法来处理和研究化学问题的一门学科。量子化学的主要研究对象是分子和原子。量子化学从分子中电子和原子核的运动角度,研究并揭示原子与分子、分子与分子之间的相互转变。主要内容包括:化学键理论、分子间作用力、分子结构与性能关系的理论问题。
[结晶化学]研究晶体结构与晶体的化学组成及其性质相互关系和规律的学科。测定晶体结构的实验方法为X射线、电子或中子衍射分析。结晶化学帮助弄清单质和化合物的结构问题,而且推动了具有指定性能的晶体物质(如半导体)的制备工艺。
[半导体化学]是正在迅速发展的一门学科。其主要内容包括:半导体材料的合成制备、分析鉴定、缺陷控制和性能与其结构间的关系等。
[原子能化学]是研究原子能科学技术中有关化学问题的一门学科。包括放射化学、辐射化学、核燃料化学、同位素化学等。
[放射化学]是原子能化学的一个分支。放射化学的研究内容包括三个方面:(1)普遍放射化学,研究在极稀浓度下放射性物质的一般法则及其性质;(2)放射性元素化学,研究各个放射性元素的分离、制备、纯化、富集、分析和鉴定等方法;(3)有关放射化学在各学科和技术部门中的应用问题。
[辐射化学]研究物质在高能电离射线作用下形成激发原子、分子、游离基或离子的过程及其化学行为的一门学科。高能电离射线主要指α、β、γ射线以及中子射线等。辐射化学对原子能事业的发展有着极其重要的作用。例如在建造原子反应堆时,必须对各种结构材料在辐射场中的行为进行研究等。
[光化学]研究物质因吸收外来辐射而发生化学反应的一门学科,在光作用下进行的化学反应称为光化反应。其常用的波长范围约在100-1000纳米之间。光化反应的活化来源于辐射能,可使某些自由焓增加的反自发过程得以实现;有些自发反应,在光照下能加速进行。光化反应在植物生长及照相术上,在光聚合、光引发等方面都有重大的作用。光化学属于广义的辐射化学的范围之内。
[激光化学]研究激光和物质相互作用所引起的化学效应的学科。其研究对象包括激光在化学各个领域的应用,如同位素分离、反应机理的研究等。主要是研究激光如何引发和控制化学反应。如特定频率的红外激光,可能引发预期特定的反应,制得用普通方法难以合成的化合物,或使通常需要高温才能发生的反应在常温下进行等。
[同位素化学]以同位素为研究对象的学科。主要内容是同位素的分布、性质、分析、分离和应用,同位素的应用越来越重要。例如,放射性同位素和稳定同位素都可作为标记原子(示踪原子),广泛地用来研究化学、物理学、生物学、地质学、医学和工农业中的各种问题。
[核化学]研究原子核(稳定性的和放射性的)的反应、性质、结构、分离、制备、鉴定等的一门学科。属于物理学和化学的边缘学科,全称为“原子核化学”。放射性原子核方面的研究也包括在“放射化学”的范围之内。
[结构化学]物理化学的一个分支。研究原子、分子和晶体结构及其与性质间的关系的一门学科。内容包括原子结构、化学键、分子间作用力、分子和晶体的立体构型、结构与性质的关系、物质结构的实验方法等。
[立体化学]研究化合物分子中原子或原子团的空间排列,以及空间关系对化合物的物理和化学性质的影响的学科。主要内容有分子的构造、构型和构象、有机化合物的分子结构与取代基的电子效应和立体效应、分子结构对有机化合物酸碱性影响等。
[表面化学]又称“界面化学”,属于胶体化学的一部分,它是研究非均相体系中异相界面的物理、化学现象的一门学科。主要包括表面能、表面张力、吸附、催化和电动现象等方面的研究。如色层分析、萃取、离子立换、接触催化、泡沫浮选等的原理和方法等均属表面化学研究范围。
[络合物化学]又称“配位化合物化学”。研究配位化合物的结构、组成、性质、反应机理及其应用。它对稀有、分散元素的分离、提纯、矿石浮选,对动植物的生理、生化研究,以及工农业生产技术(如电镀工业、工业用水处理、改良土壤等)都有广泛的应用。
[高分子化学]以高分子化合物为研究对象的一门学科。内容包括高分子化合物的结构、性质、合成方法、反应机理和高分子化合物溶液的性质等。当前以高分子化合物为基础的合成材料如橡胶、塑料、合成纤维、涂料、粘合剂等,在国民经济各部门成为不可缺少的材料。
[计算化学]根据大量实验和已有的规律,针对化学问题的特征,抽象出合理的数学模型,以计算机为工具,应用数学的方法,确定经验与理论,定性与定量,宏观与微观,静态与动态,简单体系与复杂体系等彼此间的内在联系,为最终实现分子设计奠定基础和创造前提的一门新兴的学科。主要内容有化学信息的运筹、计算方法的最优化、计算模拟及计算控制等。计算化学在寻找反应条件和反应器的最优化方面将发挥很大的作用。
[分子生物学]是在分子水平上研究生命现象的物质基础的一门学科。它是生物学的一个重要发展,表明生物科学已开始由现象的描述深入到基本作用规律的研究。如蛋白质和核酸的结构与功能的研究等就属于分子生物学的范围。
[生物化学]运用化学理论和方法研究生命现象的本质的一门学科。其主要任务是研究构成生物体的基本物质(如蛋白质、核酸、糖类等)的结构、性质及其在生命活动过程中的变化规律。根据不同的研究对象和目的,生物化学又可分为医用生物化学、微生物生物化学、农业生物化学、工业生物化学等。随着现代化学、物理学和数学最新研究成果和实验技术的渗入,生物化学获得了迅速的发展,在医药卫生、工农业生产和国防等方面,得到日益广泛的应用。
[化学仿生学]是一门在分子生物学的发展推动下产生的,介于化学与生物学之间的边缘学科。它在分子水平上模拟生物的功能,将生物的功能原理应用于化学,借以改善现有的和创造崭新的化学工艺过程。化学仿生学的内容有模拟生物体内的化学过程、物质输送过程、能量转换和信息传递过程等。
[药物化学]又称“医药化学”,研究药物的化学成分、结构、性质、制备、分析鉴定以及对有机体的作用等的一门学科。目的在于不断地提高药物的质量、指导药物的生产与保管,提高药物的疗效,创造高效低毒的新药物。
[食品化学]研究食品的组成及其营养价值,食品中杂质的检验以及供人类消费的食品管理等内容。它属于应用化学的范围。食品化学与生物化学有密切的联系。
[化学工艺学]又称“工业化学”。研究综合利用天然原料和合成半成品,加工成生产资料或生活资料的化学生产过程的一门科学。在化学和物理学原理的基础上,寻找技术上先进、经济上合理的方法、原理、流程和设备。例如硫酸工艺学、石油化工工艺学等。
[工业化学]即“化学工艺学”。
[化学工程学]属于工程学科。以物理学、化学、数学为基础,结合工业经济基本法则,研究化学工业中具有共同特点的物理和化学变化过程及其有关的机理和设备。研究内容包括流体的流动和输送,传热,传质和反应器原理。以指导各种过程及其设备的改进和发展。在石油、轻工、冶金、原子能等工业中也广泛应用。
[石油化学]主要研究石油的组成、分类、性质以及石油的炼制和石油产品的加工、合成的一门学科。
[地球化学]研究地球表面的化学资源,以及大气圈、水圈、岩石圈内所存在的化学变化的一门学科。
[海洋化学]利用化学原理研究海洋中物质(无机物和有机物)的分布、变化规律以及海洋化学资源的开发与利用的一门学科。内容包括海水化学(海水的组成与分析),海洋生物学(海洋生物体的化学组成以及某些微量元素对生物生长的影响),海底化学(海底沉积物的化学组成以及海水中元素与海底沉积物的平衡关系)等三个主要组成部分。
[农业化学]应用化学的原理和方法,研究土壤的肥力、植物营养、肥料施用、农药性能以及农产品加工利用等与农业生产有关问题的一门学科。它对土壤的改良、合理施肥、防治病虫害、提高农作物产量等都有重要作用。
[环境化学]随着环境污染问题的提出而兴起的一门综合性基础学科。它是由从化学中分化出来的大气污染化学、水污染化学和土壤污染化学等分支学科,与气象学、生物学、水文地质学、土壤学等进行综合而逐渐形成的。其任务是从化学的角度来探讨由人类活动而引起的环境质量的变化规律及保护和改善的原理。主要包括:环境污染的化学监测、环境中化学污染的机理、应用化学方法、物理化学方法防治污染及其化学原理的研究等。
22.(湖南10)在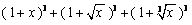 的展开式中,
的展开式中,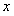 的系数为_____(用数字作答) 答案:7解析:
的系数为_____(用数字作答) 答案:7解析: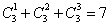
21.(湖南5).从10名大学生毕业生中选3个人担任村长助理,则甲、乙至少有1人入选,而丙没有入选的不同选法的种数为( )
A 85 B 56 C 49 D 28
答案:C 解析: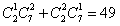
20.(海南15)7名志愿者中安排6人在周六、周日两天参加社区公益活动。若每天安排3人,则不同的安排方案共有________________种(用数字作答)。140
19.(四川13)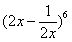 的展开式的常数项是
(用数字作答)
的展开式的常数项是
(用数字作答)
[答案]-20
[解析]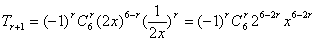 ,令
,令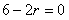 ,得
,得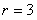
故展开式的常数项为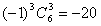
18.(四川11)3位男生和3位女生共6位同学站成一排,若男生甲不站两端,3位女生中有且只有两位女生相邻,则不同排法的种数是
A. 360 B. 228 C. 216 D. 96
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com