
[硼]元素符号B,原子序数5,原子量10.81,外国电子排布式2s22p1,位于第二周期第ⅢA族。天然存在的硼由两种稳定的同位素硼-10(19.78%)和硼-11(80.22%)组成。硼有无定形和结晶形两种单质,无定形硼为棕黑色或黑色粉末;结晶形硼为乌黑色或银灰色有光泽,硬度与金刚石相近。共价半径82皮米,离子半径20皮米,电离势800.0千焦/摩尔,电负性2.0,主要氧化数+3。无定形硼密度2.3克/厘米3,晶形硼密度2.31克/厘米3,熔点2300℃,沸点2550℃。晶态硼已知有八种同素异形体。单质硼晶体是由B-12正二十面体的基本结构单元组成的。结晶硼属于原子晶体,因此,结晶硼的硬度大,熔点、沸点高,化学性质不够活泼。
无定形硼的化学性质比较活泼,室温时在空气中缓慢氧化,700℃以上能燃烧,生成氧化硼B2O3并放出大量的热,常温下跟氟化合生成三氟化硼BF3,加热时跟氯、溴、硫等化合,高温时还与碳、氮或氨反应,分别得到硬度很大的碳化硼B4C、氮化硼(BN);加热时跟水蒸气反应生成氢氧化硼并放出氢气。

硼和氧的亲和力很强,它能从许多金属氧化物或非金属氧化物中夺取氧,所以硼可做还原剂。硼跟某些金属化合生成金属硼化物。硼很难和氢化合。硼不跟盐酸和氢氟酸反应。但可被浓硫酸或浓硝酸氧化
B+3HNO3=H3BO3+3NO2↑
2B+3H2SO4=2H3BO3+3SO2↑
硼跟氢氧化钠溶液反应生成偏硼酸钠并放出氢气
2B+2NaOH+2H2O=2NaBO2+3H2↑
硼跟硅在2000℃以上时反应生成硼化硅。过氧化氢或过硫酸铵能缓慢氧化结晶硼,热浓硝酸和重铬酸钠与硫酸的混合物也能缓慢地氧化晶态硼。上述试剂跟无定形硼反应激烈。跟碱金属碳酸盐和氢氧化物混合共熔时,各种形态的硼都能被完全氧化。由于硼在高温时化性很活泼,因此被用做冶金时的除气剂,煅铁热处理时,硼能增加合金钢的高温强固性。因硼有吸收中子的特性,棒状或条状硼钠在原子反应堆中用做控制棒,由于硼有低密度、高强度和高熔点等特性,可用来制导弹和火箭的结构材料。制发动机启动装置和变压器热断电器。热电偶中也用到硼。用硼、钴、钛、镍可制成耐高温超硬质金属陶瓷。硼在自然界中丰度不大,没有游离态,主要矿物有硼砂和硼镁矿。1808年,英国戴维和法国的盖吕萨克、泰纳、用钾还原硼酸制得硼。通常将三氧化二硼及卤化硼用氢气或活泼金属还原:

将氢气和三溴化硼或三氯化硼的混合气体通过1200-1400℃的钨丝或钽丝可得到硼:

电解熔融的KBF4,可以得到更纯的硼。
[三氟化硼]化学式BF3,式量67.82。无色有刺激性气体。非极性分子。不能燃烧,溶于乙醚成暗褐色液体。在潮湿空气中易水解。沸点-99.9℃。用作有机合成的催化剂及制备硼烷的原料。用三氧化二硼和氟化钙在浓硫酸中加热制得。
[氧化硼]别名三氧化二硼,化学式B2O3,式量69.62。无色透明玻璃状固体或正交晶体。有吸湿性。溶于酸、碱溶液和乙二醇。溶于水成为硼酸。熔点450℃,沸点约1860℃。用来制硼,可做半导体的掺杂源,硅酸盐分解时的助熔剂。用硼酸加热脱水可制得本品。
[硼烷]又称硼氢化合物,这是一系列硼跟氢组成的化合物的总称。硼烷分子有两种类型:BnHn+4和BnHn+6,前者较稳定。现在已制得二十多种硼烷。其中乙硼烧B2H6、丁硼烷B4H10在室温下为气体,戊硼烷B5H9或已硼烷B6H10为液体,癸硼烷为固体。乙硼烷易溶于乙醚,其余多数溶于苯。加热时易分解成硼和氢气,多数硼烷在空气中能自燃,硼烷燃烧时放出大量的热,所以可用作火箭的高能燃料,但这类物质毒性大,在一般条件下燃烧不完全。硼烷水解时放出大量的热
B2H6+6H2O=2H3BO3↓+6H2↑
乙硼烷有强还原性,可作还原剂。它跟氢化锂反应生成更强的还原剂硼氢化锂,用于有机合成:

乙硼烷可用硼的卤化物在乙醚溶液中跟氢化铝锂LiAlH4反应制得。将乙硼烷加热到100-250℃得其它高硼烷。
[硼酸]化学式H3BO3,式量61.83。无色略带珍珠光泽的三斜晶体或白色粉末。密度1.435克/厘米3。溶于水、乙醇和甘油。更易溶于高级醇,微溶于乙醚和丙酮。水溶液呈弱酸性。它是一元弱酸Ka=6×10-10,它之所以有酸性,并不是由于它电离出氢离子,而是因为硼在p亚层上有空轨道,它加合了水电离出来的OH-(其中氧原子有弧电子对)而释放出H+离子。

硼酸在医药上用作消毒剂、收敛剂,食物的防腐剂。工业上大量地用于制搪瓷、玻璃、光纤。化学上用作分析试剂,缓冲剂,还应用于照像和电子工业。硫酸跟硼砂溶液反应可析出硼酸沉淀。
[铝]元素符号Al,原子序数13,原子量26.98,外围电子排布式3s23p1,位于第三周期第Ⅲ A族。金属半径143.1皮米,离子半径51皮米,第一电离能577.4千焦/摩尔,电负性1.5,氧化数+3。银白色有光泽金属,质轻,有良好的延展性和传热导电性,熔点660.5℃,沸点2467℃,硬度2-2.9,密度2.7克/厘米3。丰度(质量%)8.05%,在地壳中居第三位。铝是化学性质较活泼的金属。常温下在空气中金属表面发生缓慢氧化生成一薄层致密氧化物膜,阻止氧气、水继续跟铝反应,但可透过光线,这层膜对铝起保护作用,因此铝有一定抗锈蚀能力。若去掉这层氧化膜,并使铝跟汞形成铝汞齐,则很易被空气中氧气氧化,也能跟水剧烈反应放出氢气生成氢氧化铝。铝在加热时可在氧气中燃烧生成氧化铝发强白光并放出大量的热。由于铝跟氧有较强的亲合力,因此铝有强还原性,冶金工业上用做还原剂,冶炼高熔点金属如镍、铬、锰、钒等,铝粉跟上述金属氧化物粉末的混合物叫铝热剂。用铝还原金属的方法,称为铝热还原法。铝也用做炼钢中的脱氧剂。加热时铝可跟卤素、氮气、磷、硫、碳等化合。高纯铝不跟一般酸反应,只溶于王水。一般铝可溶于盐酸、稀硫酸并放出氢气。常温时在浓硫酸或浓硝酸中发生钝化,因此,可用铝容器储运这些浓酸。铝可跟热硫酸反应放出二氧化硫:
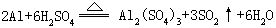
铝可溶于强碱溶液中生成偏铝酸盐并放出氢气。
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
纯铝可用于制电线、电缆。铝大量用于制合金、电器设备、建筑设备、机械、化工设备:汽车、飞机、宇航飞行器、日用器皿等。铝粉(俗称“银粉”)用于配制油漆、烟火等。铝在自然界主要以铝硅酸盐的形式存在,如长石、云母、高岭土等。铝矿石主要有铝土矿(Al2O3·nH2O)和冰晶石(Na3AlF6)。1827年德国化学家维勒把无水氯化铝跟钾放在铂坩埚里密闭加热得到粉末状铝。工业上用电解氧化铝跟冰晶石的熔融混合物制得铝。
[铝镍合金]别称雷氏合金,具有活性较高的催化性能,干燥的铝镍合金在空气中能自燃,应保存在无水乙醇中。它是一种还原或加氢反应的催化剂,多用于有机合成中。
[氧化铝]化学式Al2O3,式量101.96。矾土的主要成分。白色粉末。具有不同晶型,常见的是α-Al2O3和γ-Al2O3。自然界中的刚玉为α-Al2O3,六方紧密堆积晶体,α-Al2O3的熔点2015±15℃,密度3.965克/厘米3,硬度8.8,不溶于水、酸或碱。γ-Al2O3属立方紧密堆积晶体,不溶于水,但能溶于酸和碱,是典型的两性氧化物。
Al2O3+6H+=2Al3++3H2O
Al2O3+2OH-=2AlO-2+H2O
刚玉粉硬度大可用作磨料,抛光粉,高温烧结的氧化铝,称人造刚玉或人造宝石,可制机械轴承或钟表中的钻石。氧化铝也用作高温耐火材料,制耐火砖、坩埚、瓷器、人造宝石等,氧化铝也是炼铝的原料。煅烧氢氧化铝可制得γ-Al2O3。γ-Al2O3具有强吸附力和催化活性,可做吸附剂和催化剂。
[铝矾土]又称矾土或铝土矿,主要成分是氧化铝,系含有杂质的水合氧化铝,是一种土状矿物。白色或灰白色,因含铁而呈褐黄或浅红色。密度3.9-4克/厘米2,硬度1-3,不透明,质脆。极难熔化。不溶于水,能溶于硫酸、氢氧化钠溶液。主要用于炼铝,制耐火材料。
[刚玉]主要成分α-Al2O3。桶状或锥状的三方晶体。有玻璃光泽或金刚光泽。密度为3.9-4.1克/厘米3,硬度9,熔点2000±15℃。不溶于水,也不溶于酸和碱。耐高温。无色透明者称白玉,含微量三价铬的显红色称红宝石;含二价铁、三价铁或四价钛的显蓝色称蓝宝石;含少量四氧化三铁的显暗灰色、暗黑色称刚玉粉。可用做精密仪器的轴承,钟表的钻石、砂轮、抛光剂、耐火材料和电的绝缘体。色彩艳丽的可做装饰用宝石。人造红宝石单晶可制激光器的材料。除天然矿产外,可用氢氧焰熔化氢氧化铝制取。
[氢氧化铝]化学式Al(OH)3,式量78,白色无定形粉末,不溶于水和乙醇。密度2.42克/厘米3,不溶于氨水。加热至300℃时分解生成氧化铝和水。氢氧化铝是典型的两性氢氧化物,可溶于强酸生成铝盐和水,也溶于强碱溶液,生成偏铝酸盐和水,但碱性略强于酸性。跟弱酸反应时生成碱式盐或不生成盐。用于制铝盐、陶瓷、玻璃、医药,还用做吸附剂。净水剂、媒染剂、纸张填料、防水填料。用可溶性铝盐溶液跟氨水或碳酸钠溶液反应制得。
[氯化铝]化学式AlCl3,式量133.34。无色透明晶体或白色而微带浅黄色的结晶性粉末。密度2.44克/厘米3,熔点190℃(2.5大气压),在常压下177.8℃升华,沸点182.7℃。氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以共价的二聚分子Al2Cl6形式存在。在空气中极易吸收水分并部分水解放出氯化氢而形成酸雾。易溶于水并强烈水解,溶液显酸性。也溶于乙醇和乙醚,同时放出大量的热。六水合氯化铝为无色斜方晶体,密度 2.398克/厘米2,100℃时分解。用做有机合成和石油工业的催化剂、染料的中间体,还用于处理润滑油,制造葸醌、丁基橡胶和烃类树脂。金属铝跟氯气反应或无水氯化氢跟熔融铝反应均可制得。
[硫酸铝]化学式Al2(SO4)3·18H2O,式量666.43,无色单斜晶体,密度1.69克/厘米3,86.5℃时失去结晶水。无水硫酸铝为白色粉末,密度2.71克/厘米3,770℃分解为氧化铝和三氧化硫。易溶于水并水解,水解产物有碱式盐和氢氧化铝的胶状沉淀。容易跟钾、钠、铵的盐结合形成矾,如硫酸铝钾KAl(SO4)3·12H2O。用作净水剂,防水剂、媒染剂,油脂澄清剂,石油除臭脱色剂,还用于鞣革、造纸、防火、医药。由氧化铝或氢氧化铝跟硫酸反应制得,也可用硫酸处理铝土矿制得。
[硫酸钾铝]又称明矾,钾明矾、钾铝矾,是含有结晶水的同晶形的硫酸钾和硫酸铝的复盐,化学式KAl(SO4)2·12H2O或K2SO4·Al2(SO4)3·24H2O,式量474.39或948.72。无色立方、单斜或六方晶体,密度1.757克/厘米3,熔点92.5℃,有酸涩味,有收敛性。溶于水并水解,水溶液呈酸性,水解生成的Al(OH)3胶体、有很强的吸附性能。64.5℃失去3/4的结晶水,200℃时失去全部结晶水而生成白色粉末(烧明矾)。用作净水剂、媒染剂、造纸工业用作胶料。还用于制焙粉、药物、钾肥。由明矾石(K2SO4·Al2(SO4)3·4Al(OH)3)经煅烧、萃取、结晶制得。
[明矾]见硫酸钾铝条。
[硝酸铝]化学式Al(NO3)3·9H2O,式量375.13。无色正交晶体,熔点73.5℃。容易潮解,易溶于水和乙醇,水溶液呈酸性,溶于丙酮。有强氧化性,跟有机物混合加热时燃烧并爆炸。有毒。熔融时分解而变成Al(NO3)3·6H2O,140℃时形成碱式盐4Al2O3·3N2O5·14H2O,到200℃时变成Al2O3并放出氧气和二氧化氮。用作分析试剂、氧化剂、媒染剂。硝酸跟氢氧化铝反应制得本品。
[溴化铝]化学式AlBr3,式量266.69。有光泽的单斜无色结晶小片。密度为2.64克/厘米3,97℃时熔融成无色透明易流动液体,在260-270℃时沸腾。易潮解,在空气中发烟,能溶于二硫化碳和丙酮中。和水发生激烈反应,并放出大量的热,甚至喷溅出反应物。有腐蚀性。用作分析试剂、有机合成和异构化的催化剂。将液态溴慢慢滴注到铝屑上,反应完全后,再经蒸馏提纯制成本品。
[硫化铝]化学式Al2S3,式量150.16。纯品为白色针状晶体,通常见到的不纯物为黄灰色致密的物质。密度2.02克/厘米3熔点1100℃,硫化铝在热水中完全水解生成氢氧化铝沉淀和硫化氢。在潮湿空气中也能水解,因而有硫化氢气味。本品不能用盐溶液法制备,把铝粉跟硫华混合放入大坩埚中,用点燃的镁条把混和物点燃即可制得。
[高岭土]化学成分近似为Al4[Si4O10][OH]8。又称瓷土。纯净的为白色,通常因含杂质而显淡黄色或灰色,呈致密块状或松散块状。密度2.54-2.60克/厘米3,熔点约1785℃,干燥的易碎成粉状。潮湿的有可塑性,溶于盐酸。主要用于制造纸器、陶瓷、搪瓷、电瓷、耐火砖,也用于制明矾、硫酸铝;在造张、橡胶、塑料、油漆等工业中用做填料。
[冰晶石]主要化学成分是Na3AlF6,一种矿物,由于光泽和折光率近于冰而得名。单斜晶体呈立方形,通常为块状或粒状。纯者为无色透明,因含杂质而显淡黄、淡红或褐色,有玻璃光泽。密度2.95-3.01克/厘米3,硬度1.2-3.0。用作冶炼铝的熔剂、玻璃和搪瓷的乳白剂、农业杀虫剂,还用于制钠盐或铝盐。
[镓]元素符号Ga,原子序数31,原子量69.72,外围电子排布4s24p1,共价半径125皮米,离子半径82皮米,第一电离能578.8千焦/摩尔,电负性1.6,位于第四周期第ⅢA族。柔软的银白色金属,密度5.904克/厘米3,熔点29.9℃,沸点2403℃。受热至熔点时变为液体,再冷却至0℃而不固化,由液体转变为固体时,其体积约增大3.2%。硬度1.5-2.5。常温时镓在干燥空气中稳定,在潮湿空气中氧化,加热至500℃时着火。室温时跟水反应缓慢,跟沸水反应剧烈生成氢氧化镓放出氢气。加热时溶于无机酸或苛性碱溶液。能跟卤素、硫、磷、砷、锑等反应。主要用途是作半导体材料,制低熔点合金,制镓盐,在原子反应堆中液态镓用作载热体,制高温温度计,制高反射率的镓镜、牙科合金,作有机合成的催化剂。1875年,法国的布瓦博德朗用光谱分析从闪锌矿得到的提取物时,发现了镓。他电解Ga(OH)3的KOH溶液得到金属镓。镓在地壳中的丰度为0.0019%(质量),由铝土矿或闪锌矿中提取。
[氧化镓]化学式Ga2O3,式量187.44。白色三角形的结晶颗粒。有α型与β型之分。不溶于水。微溶于热酸或碱溶液。在氢气流中加热至红色即还原成一氧化镓。熔点1900℃(在600℃时转化为β型)。用做半导体材料、分析试剂。
[氯化镓]化学式GaCl3,式量176.08,无色或白色针状结晶。易潮解,易溶于水和乙醇,溶于氨水,微溶于石油醚。熔点77.9±0.2℃,沸点为102.3℃。共价型化合物,气态时为双聚分子。在水中强烈水解,遇潮湿空气则发烟。用作有机反应的催化剂。
[铟]元素符号In,原子序数49,原子量114.8,外围电子排布5s25p1,位于第五周期第ⅢA族,主要氧化数+1,+3,共价半径150皮米,离子半径(In3+)81皮米,第一电离能558.1千焦/摩尔,电负性1.7。银白色金属,有延展性,熔点156.61℃,沸点2080℃,硬度1.2,密度7.30克/厘米2。在常温下干燥空气中很稳定,在潮湿空气中表面生成氢氧化物的薄膜,高温时燃烧呈现鲜紫色火焰并生成黄色三氧化二铟,在较高温度时能与卤素、硫、硒、磷等直接化合。不与水反应,能溶于酸但不溶于碱。主要存在于锡石和闪锌矿中,在地壳中的丰度为2.5×10-5%(质量)。1863年德国的赖希和李希特用光谱法分析闪锌矿时发现了铟,他们用氧化铟、焦炭、纯碱共热制出不纯的金属铟。可用来制低熔点合金、轴承合金,半导体掺杂源,制砷化铟,玻璃密封合金,补牙合金等。用化学法或电解法从闪锌矿或烟灰中提取铟。
[铊]元素符号Tl,原子序数81,原子量204.4,外围电子排布6s26p1,位于第六周期第ⅢA族,主要氧化数+1,(+3),共价半径155皮米,离子半径(Tl3+)95皮米,第一电离能589.1千焦/摩尔,电负性1.8。系柔软的银白色金属,六方紧密堆积结构晶体,密度11.85克/厘米3,熔点303.5℃,沸点为1457±10℃,硬度1.2-1.3。是一种稀散元素,常与碱金属在一起,在铁、锌、铜、铝、硒和碲矿中有少量存在。在地壳中的丰度1×10-4%(质量百分数)。常温下在空气中易被氧化并使金属颜色变暗。可跟卤素反应,生成共价型卤化物。在气态时为双聚分子。不溶于水和碱溶液。溶于盐酸或稀硫酸生成一价铊盐TlCl或Tl2SO4。并放出氢气,溶于稀硝酸生成硝酸铊、一氧化氮和水,铊和铊盐有毒。1861年英国克鲁克斯对硫酸厂气灰中的物质进行光谱分析,看到新的绿色谱线,从而发现了铊。同年法国的拉迈电解三氯化铊溶液制得金属铊。主要用于制低熔合金,电子器件、光学玻璃、温度计、医药等。电解铊的盐溶液可制取金属铊。
[硝酸亚铊]化学式TlNO3,式量266.37。白色结晶,易溶于水,溶于丙酮,不溶于醇。热至450℃分解,75℃时γ型转化为β型,145℃时β型转化为α型,熔点206℃,有毒,有氧化性。用作分析试剂,定量分析共存的氯、溴、碘,还用于制光导纤维。
[三氧化二铊]化学式Tl2O3,式量456.74。棕色或暗红色粉末。有氧化性,溶于盐酸时放出氯气,溶于硫酸时放出氧气,不溶于水和碱。熔点717±5℃,有毒。用作催化剂、高纯分析试剂,配制铊标准试剂等。
[铍]元素符号Be,原子序数4,原子量9.012,核外电子排布1s22s2,位于第2周期第ⅡA族,原子半径111.3皮米,离子半径35皮米,第一电离能905千焦/摩尔,电负性1.5。钢灰色金属,密度为1.848克/厘米3,熔点1278±5℃,沸点2970℃,质坚硬,电导性5.2,氧化数+2。在空气容易形成致密氧化膜保护层,故在空气中加热到赤红时也很稳定。铍有剧毒。不溶于冷水,微溶于热水,生成氢氧化铍和氢气,灼热的铍跟水蒸气反应生成氧化铍和氢气。可以跟卤素化合生成卤化物。可溶于稀盐酸,稀硫酸和氢氧化钾溶液并放出氢气。氢氧化铍是两性氢氧化物,溶于氢氧化钠溶液生成铍酸钠Na2BeO2。铍盐多有甜味,有毒。铍对钠及液态钠钾合金有抗腐蚀性。用来制造核反应堆中的热交换器。铍还用做原子反应堆中的中子减速剂和反射层。高纯度铍是快中子的重要来源。铍透X射线能力最强,有金属玻璃之称。用来制造X光管的窗口。铍主要用来制合金如高弹性的铍青铜,制造不发火工具的铜铍镍合金,以及用于制造飞机用的含铍合金。1798年法国的沃克兰在研究绿宝石时发现了铍(希腊文原意是绿宝石,因铍最初从绿宝石中提取)。铍在自然界中含量为6ppm。最常见的铍矿有绿柱石、铍硅石、光榴石。电解熔融的氯化铍制取铍。
[镁]元素符号Mg,原子序数12,原子量24.312,外围电子排布为3s2,位于第3周期ⅡA族,原子半径160皮米,离子半径66皮米,第一电离能742千焦/摩尔,电负性1.2,氧化数为+2。银白色有金属光泽,密度1.74克/厘米3,熔点648.8℃,沸点1107℃,是轻金属之一。有延展性,硬度为2,电导性21.4。化学性质很活泼,在空气中表面慢慢被氧化,形成致密的氧化物保护膜而发暗。镁粉在空气或氧气中剧烈燃烧发出强白光,生成氧化镁和少量氮化镁Mg3N2。镁能跟大多数非金属和许多酸反应,镁能在二氧化碳中燃烧生成氧化镁,游离出碳。常温时镁不跟水反应,但镁跟沸水反应生成氢气和氢氧化镁。镁可从熔融盐中把金属还原出来,如:

镁主要用于制造轻金属合金如镁铝合金,应用于航空、汽车工业,制造球墨铸铁,制铜合金,镍合金中用做除氧剂,还用于制烟火、闪光粉、镁盐等。1808年,英国戴维用电解法发现镁,希腊文原意为希腊地名“美格尼西亚”。镁是在自然界中分布很广的元素之一,在地壳中,镁的含量为1.4%。主要的镁矿有白云石,菱镁矿等。在海水中,镁的含量仅次于钠。用电解法电解熔融氯化镁制得。
[氧化镁]化学式MgO,式量40.31,又称苦土。白色粉末,密度3.58克/厘米3,熔点2852℃,沸点3600℃,不溶于水。氧化镁是碱性氧化物,可跟水反应,生成难溶于水的氢氧化镁,跟酸反应生成镁盐,可跟酸性氧化物反应,如跟三氧化硫剧烈反应发出白光。用做耐火材料,如制镁砖、坩埚,用做颜料调制油漆和化妆品,还可用做橡胶填料、绝热材料,医药上用做抗酸药和轻泻药治疗胃酸过多和十二指肠溃疡病。煅烧碳酸镁可制得轻质氧化镁,煅烧碱性碳酸镁可制得重质氧化镁。
[氢氧化镁]化学式Mg(OH)2,式量58.32。白色无定形粉末。难溶于水,易溶于稀酸和铵盐溶液。饱和水溶液的浓度为1.9毫克/升(18℃),呈碱性。加热到350℃失去水生成氧化镁。用做分析试剂,还用于制药工业。氧化镁跟水反应可得氢氧化镁。
[氯化镁]化学式MgCl2。常见的是六水合物,它的化学式为MgCl2·6H2O,式量203.30。晶体为无色易潮解的单斜晶体,有苦咸味。密度1.569克/厘米3,熔点118℃(分解),极易溶于水和乙醇。高于170℃时生成碱式氯化镁和氯化氢。600℃时分解生成氧化镁和氯化氢。将六水合氯化镁在干燥的氯化氢气流中加热脱水可生成无水氯化镁。无水氯化镁是白色有光泽六方晶体,密度2.32克/厘米3,熔点714℃,沸点1412℃,在湿空气中潮解并发烟,在氢气的气流中白热时则升华,极易溶解于水同时剧烈放热。主要用于制金属镁,用做消毒剂、灭火剂、冰盐冷冻剂,也应用于陶瓷、纺织、造纸等工业。氯化镁溶液跟氧化镁按一定比例混合,俗称镁氧水泥,质坚硬耐磨,如加入木屑、刨花做填料可制成人造大理石、刨花板等。将氯化镁跟镁砂混合,可做炼钢炉衬里。海水及盐卤中均含氯化镁。用氧化镁或菱苦土跟盐酸反应可制得。
[过氧化镁]化学式MgO2,式量56.32。白色粉末,不溶于水。溶于酸,生成过氧化氢。用做氧化剂、漂白剂,杀菌剂。用过氧化氢跟氧化镁反应或用氯化镁溶液跟过氧化钠反应制得。
[高氯酸镁]化学式Mg(ClO4)2,式量223.23。无水高氯酸镁为白色多孔物质,密度2.6克/厘米3,易溶于水和乙醇。受热易分解。有氧化性,接触还原性物质易发生爆炸。具有极强烈的吸水性能,用水浸湿则产生热,并发出嘶嘶的声音,吸水量可达到它本身质量的60%。它是一种中性物质,因此,高氯酸镁是一种优良的气体干燥剂(适于干燥H2、O2、Cl2、HCl、NH3、CO2等),还用做氧化剂。用高氯酸跟氧化镁反应可制得本品。
[溴化镁]化学式MgBr2·6H2O,式量292.2,无色结晶或白色结晶颗粒。易潮解,味苦,易溶于水、乙醇和丙酮。无水溴化镁的密度为3.72克/厘米3,熔点700℃,六水合物在172.4℃时熔于结晶水中(165℃开始分解)。用于各种有机溴化物的制备,也用于制药工业。
[氟化镁]化学式MgF2,式量62.3,无色结晶或白色粉末。在灯光下发生紫色萤光。溶于硝酸,难溶于水和乙醇。熔点1248℃,有毒。用做光谱试剂,还应用于光学玻璃、陶瓷以及电子等工业。
[碳酸镁]化学式MgCO3·3H2O,式量135.38。无色有光泽细小针状晶体,密度3.04克/厘米3,结成小球或聚为小团,在空气中逐渐风化。热至100℃时即失水及CO2,将本品跟水一并沸腾时也能失去二氧化碳,难溶于水。用于镁盐制造、制药工业、高级玻璃制造等。用碱式碳酸镁加热至150-220℃通入干燥的二氧化碳,直到生成白色松散粉末并成恒重时,即得本品。
[碱式碳酸镁]化学式Mg(OH)2·4MgCO3·6H2O,式量503.66。白色质松体轻粉末,一般聚为易碎小团。难溶于水,不溶于乙醇,能溶于铵盐溶液。加热至700℃能变成氧化镁、水、二氧化碳。溶于稀酸放出二氧化碳。用于橡胶填料、镁盐制造、制药工业、制高级玻璃等。由氯化镁溶液跟碳酸钠溶液在60℃时反应,滤出沉淀、洗涤、在70℃以下干燥制得本品。
[醋酸镁]别名乙酸镁,化学式Mg(CH3COO)2·4H2O,式量214.48。无色单斜晶体,密度为1.454克/厘米3(无水物密度为1.42克/厘米3),易溶于水和乙醇,水溶液呈中性或弱酸性,80℃时溶于结晶水中。在潮湿空气中潮解,在浓硫酸干燥器中风化,100℃时脱水。用做分析试剂,制备乙酸钠酰镁以测定物质中钠的含量。碳酸镁跟醋酸反应,经浓缩,析出醋酸镁晶体。
[硫酸镁]化学式MgSO4,式量120。白色晶体,它有多种结晶水化物,其中MgSO4·7H2O称泻盐,MgSO4·H2O称为硫酸镁石。七水硫酸镁的式量为246.46,无色正交或单斜棱柱形晶体,密度为1.68克/厘米3。在干燥空气中风化,易溶于水,微溶于乙醇,68℃时熔于结晶水中,150℃时失去6个结晶水,生成硫酸镁石,250℃失去全部结晶水成为无水物,无水物密度为2.66克/厘米3,熔点1124℃,有苦咸味。用做分析试剂、媒染剂,还用于制革、造纸、陶瓷工业等,还可用做口服泻药。用硫酸跟氧化镁,氢氧化镁或碳酸镁反应制得。
[硝酸镁]化学式Mg(NO3)2·6H2O,式量256.41。无色单斜晶体。密度1.636克/厘米3,89℃熔于结晶水中,有潮解性,易溶于水和乙醇。加热到90℃以上即转化为碱式盐,加热至330℃分解为氧化镁、二氧化氮和氧气。跟有机物接触、摩擦或撞击,能引起燃烧或爆炸,有强氧化性。用做氧化剂、催化剂、制造烟火或镁盐。硝酸跟氧化镁或氢氧化镁反应,经浓缩、结晶可制得硝酸镁。
[氟硅酸镁]化学式MgSiF6·6H2O,式量274.51。白色结晶或粉末。易风化,溶于水,不溶于乙醇。热至120℃分解。用做防水剂、防蛀剂、混凝土加固、制陶瓷等。
[泻盐]见硫酸镁条。
[硫酸镁石]见硫酸镁条。
[白苦土]也叫苦土,主要成分是氧化镁。
[卤盐]主要成分是氯化镁。
[镁砂]又称烧结镁砂,由菱镁矿、水镁矿或以海水与石灰乳反应制得的氢氧化镁,经高温煅烧而成,水化能力强。主要用于制碱性耐火材料,或镁砖、镁铝砖,含杂质多的用于铺炼钢炉底。
[镁剂]又称镁氧混和剂,是由氯化镁、氯化铵、氨水混和制成的透明无色溶液,能跟磷酸根离子或砷酸根离子形成白色的复盐沉淀。用于磷和砷的检验。
[镁橄榄石]主要成分是Mg2SiO4或2MgO·SiO2,白色带绿色或黄色,斜方晶体,密度3.21克/厘米3,硬度6-7。是制耐火材料的原料。
[镁质水泥]由轻质氧化镁粉跟氯化镁或硫酸镁溶液调制成的胶凝材料,硬化快,强度高,一般认为硬化作用主要由于碱式氯化镁或碱式硫酸镁的形成。可掺加木屑、刨花等填料制成人造大理石或刨花板等建筑材料。
[光卤石]矿物名。化学成分KCl·MgCl2·6H2O。亦称砂金卤石。正交晶体,通常成粗粒集合体。透明或微透明。密度1.6克/厘米3,硬度1-3,性脆。味苦涩。在空气中易潮解,易溶于水。形成于富含镁和钾的盐湖中,产于沉积盐层中。经溶解、分步结晶等加工步骤,可使氯化钾同氯化镁分离。是制取钾肥的重要原料,也是提炼金属镁的重要原料。
[绿柱石]矿物名。化学成分Be3Al2[Si6O13]。六方晶系,常呈柱状晶体。玻璃光泽。质硬而脆。含铬呈鲜绿色的称纯绿宝石(祖母绿),透明蓝色的称蓝宝玉,含铯显玫瑰色的称玫瑰绿柱石。主要用于提炼铍,也用于制工艺美术品。
[钙]元素符号Ca,原子量40.08,原子序数20,外围电子排布式4s2,位于第四周期第ⅡA族,原子半径197.3皮米,离子半径99皮米,摩尔体积25.9厘米3/摩尔,主要氧化数+2,第一电离能593千焦/摩尔,电负性1.01。银白色有金属光泽金属。密度1.55克/厘米3,熔点839℃,沸点1484℃,硬度1.5,电导性20.8。化学性质活泼,在空气中表面上能形成一层氧化物或氮化物薄膜,可减缓进一步腐蚀。可跟氧化合生成氧化钙,跟氮化合生成氮化钙Ca3N2,跟氟、氯、溴、碘等化合生成相应卤化物,跟氢气在400℃催化剂作用下生成氢化钙。常温下跟水反应生成氢氧化钙并放出氢气,跟盐酸稀硫酸等反应生成盐和氢气,跟碳在高温下反应生成碳化钙CaC2。加热时几乎能还原所有金属氧化物,在熔融时也能还原许多金属氯化物。钙常用做合金的脱氧剂,冶金的还原剂,制备铬、锆、铀,铁和铁合金的脱硫、脱碳剂,氮和氩气体的分离剂,以及油类的脱水剂等。1808年英国的戴维、瑞典的贝采利鸟斯、法国的蓬丁,用汞做阴极电解汞和生石灰的混合物时得到钙汞合金,蒸去汞得到钙。钙在自然界中分布很广,都以化合态存在,占地壳原子总数的1.5%,钙在地壳中的含量仅次于氧、铝、硅、铁,居第五位,主要矿物有石灰石、大理石、石膏、磷灰石等。在动物体的骨骼和血浆中也含有钙,并参与凝血和肌肉的收缩过程。金属钙是由电解熔融氯化钙制得。
[氧化钙]化学式CaO,式量56.08。生石灰的主要成分。白色立方晶体粉末。密度 3.25-3.38克/厘米3,熔点2614℃,沸点2850℃。在空气中吸收二氧化碳生成碳酸钙。难溶于水,跟水化合生成氢氧化钙。溶于酸生成相应的钙盐,跟二氧化硅在高温下生成易熔的硅酸钙,跟焦炭在高温下反应生成电石CaC2和一氧化碳。多用于建筑工程、鞣制皮革、制造漂白粉。农业上用石灰中和土壤的酸性,使土壤胶体凝聚,增进团粒结构。还用于制糖、制电石、造纸、净化污水。将石灰石置于石灰窑中煅烧至900℃以上,可制得生石灰。
[氢氧化钙]化学式Ca(OH)2,式量74.09。俗称熟石灰或消石灰。白色粉末。密度2.24克/厘米3,580℃失水。微溶于水。具有强腐蚀性,对皮肤、毛丝都有腐蚀性。有强吸湿性。是较强的碱,溶液有涩味。吸收二氧化碳生成碳酸钙和水,跟酸中和生成盐和水。潮湿的氢氧化钙粉末吸收氯气可制成漂白粉,氢氧化钙跟盐卤中的氯化镁反应可生成氢氧化镁;跟纯碱反应可制成烧碱。氢氧化钙的澄清水溶液叫石灰水,氢氧化钙与水组成的白色悬浊液叫石灰乳,组成的膏状物叫石灰膏。氢氧化钙可用来制糖、制药、制漂白粉,从卤水中制取氢氧化镁,还可用做硬水软化剂、消毒剂、制酸剂、收敛剂。大量用做建筑材料。氧化钙跟水反应可制得氢氧化钙。
[过氧化钙]化学式CaO2,式量72.08。白色或微黄色粉末。难溶于水。溶于酸生成过氧化氢
CaO2+2H+=Ca2++H2O2
常用作杀菌剂、防腐剂。由钙盐溶液跟过氧化钠或氧化钙与过氧化氢作用制得
Ca2++Na2O2=2Na++CaO2
CaO+H2O2+7H2O=CaO2·8H2O
[氢化钙]化学式CaH2,式量42.096。白色粉末。离子型类盐化合物。加热时不到熔点便分解,跟水发生剧烈反应放出氢气
CaH2+2H2O=Ca(OH)2+2H2↑
氢化钙有强还原性。常用做强还原剂,以及在野外工作时用来制氢气。钙在氢气流中加热可制得氢化钙。
[氟化钙]化学式CaF2,式量78.08。是氟石或萤石的主要成分。无色立方晶体,天然矿石中含有杂质,略带绿色或紫色。密度3.18克/厘米3,熔点1423℃。极难溶于水。可溶于盐酸、氢氟酸、硫酸、硝酸和铵盐溶液。溶于铝盐和铁盐溶液时形成络合物。氟化钙跟浓硫酸在铅制容器中反应可制得氟化氢。氟化钙用于制氢氟酸、氟化物、陶瓷、搪瓷。冶金工业用做助熔剂,有机化学反应中用作脱水或脱氢催化剂。还可用于电子、仪表、光学仪器制造。由可溶性钙盐溶液跟氟化钠反应可制得氟化钙。
[氯化钙]化学式CaCl2,式量110.99。无水氯化钙为白色多孔状熔块或颗粒。易潮解。熔点为782℃,密度为2.15克/厘米3,沸点高于1600℃,易溶于水并放出大量的热,也溶于乙醇和丙酮。常见的是六水合氯化钙CaCl2·6H2O,无色三方晶体,易潮解,有苦咸味,密度1.71克/厘米3,29.92℃溶于结晶水。加热至30℃时失去四个分子水而成二水合物(CaCl2·2H2O),系白色多孔而有吸湿性的固体,继续加热可生成一水合物。温度高于200℃时,完全失水而成吸湿性很强的无水氯化钙。氯化钙跟氨反应生成氨合物CaCl2·8NH3。无水氯化钙用做脱水剂、干燥剂(但不能干燥氨、硫化氢和酒精),氯化钙还用做纺织物的上浆剂、净水剂、防冻剂、食物保存剂、路面整洁剂。将CaCl2·6H2O跟冰按1.44∶1混合,在实验室中用做致冷剂,可获得-54.9℃的低温。由盐酸跟碳酸钙反应制得,工业上主要由氨碱法副产物提供

[溴化钙]化学式CaBr2,式量199.89。无水溴化钙为白色粒状物或结晶,易潮解,密度3.35克/厘米3,熔点730℃微分解,沸点806-812℃。常见的为二水化物(CaBr2·2H2O)。无色或白色结晶,式量235.92。易溶于水,溶于乙醇和丙酮。久置空气中变黄,高温分解成溴和石灰。用于分析试剂,制药工业和照像工业等。
[碘化钙]化学式CaI2,式量293.89。浅黄色晶体,易潮解,密度3.956克/厘米3,熔点784℃,沸点1100℃。易溶于水,水溶液呈中性,溶于乙醇和丙酮,跟酸反应放出碘化氢。二水化物化学式为CaI2·2H2O,式量330.02。无色块状或粉末。易潮解,在空气中受热能被氧化或水解,久置因析出游离碘而呈黄色。用于分析试剂、照像和制药工业等。
[硫化钙]化学式CaS,式量72.14。无色立方晶体或浅黄色不透明物质,密度2.5克/厘米3,没有气味,能溶于水,易水解
2CaS+2H2O=Ca(HS)2+Ca(OH)2
氢硫化钙溶于水,氢氧化钙则析出沉淀。硫化钙跟水、二氧化碳反应,生成多硫化钙CaSx放出硫化氢。跟酸反应放出硫化氢。硫化钙用于制发光漆和硫脲等,皮革工业用作脱毛剂。由硫酸钙粉末跟焦炭在高温下还原制得:
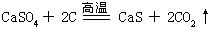
[碳化钙]化学式CaC2,式量64.10。工业品呈灰色、黄褐色或黑色块状固体。密度2.22克/厘米3,熔点447℃,沸点2300℃。跟水剧烈反应生成乙炔
CaC2+2H2O=Ca(OH)2+C2H2↑
跟氮气在加热条件下生成氰氨化钙CaCN2
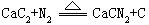
碳化钙用于制造乙炔,氰氨化钙提供有机合成原料。生石灰跟焦炭在电炉中反应制得碳化钙
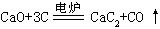
[磷化钙]化学式Ca3P2,式量182.19。灰色块状物,溶于酸,不溶于乙醇、醚和苯,溶点约1600℃。跟水反应放出磷化氢
Ca3P2+6H2O==3Ca(OH)2+2PH3↑
磷化钙用于制磷化氢、信号和烟火等的制造。
[碳酸钙]化学式Ca2CO3,式量100.09。无色正交晶体或白色粉末,密度2.93克/厘米3,熔点520℃。825℃分解生成氧化钙和二氧化碳。不溶于水。溶于酸放出二氧化碳,溶于饱和的二氧化碳的水溶液,生成可溶性的碳酸氢钙。纯碳酸钙用作分析试剂、基准试剂、光谱分析试剂,硅单晶切片胶,厚膜电容材料。医疗上用做抗酸药,中和胃酸,保护溃疡面,用于治疗胃酸过多病、胃和十二指肠溃疡病。碳酸钙是自然界中分布很广的一种碳酸盐,天然矿物有方解石、大理石、石灰石、白垩等。这些矿物广泛地用做建筑材料、烧制石灰和水泥等。用硝酸钙溶液跟碳酸铵溶液反应,经吸滤、洗涤沉淀可制得纯碳酸钙。
[硫酸钙]化学式CaSO4,式量136.14。白色固体或无色斜方晶体。易吸潮。密度2.61克/厘米3,熔点1450℃。带两个分子结晶水的叫石膏或生石膏CaSO4·2H2O,将石膏加热到150-170℃时,失去大部分结晶水变成熟石膏CaSO4·1/2H2O,或写为:2CaSO4·H2O,200℃以上长时间加热成为无水物。不溶于水和乙醇,溶于铵盐、硫代硫酸钠、氯化钠等溶液。无水硫酸钙或熟石膏与适量水混和时,即慢慢地凝固。用做阻滞剂、粘合剂、吸湿剂、磨光粉、纸张充填物、气体干燥剂、制石膏绷带、制工艺品。用石膏可以调节水泥凝固时间。有天然石膏矿,磷酸盐工业的副产品中含有硫酸钙,硫酸铵溶液跟氯化钙溶液反应,吸滤、洗涤沉淀,可制得纯品。
[硝酸钙]化学式Ca(NO3)2,式量164.09。无色立方晶体,密度2.504克/厘米3,熔点561℃,在空气中潮解,易溶于水。可形成一水合物和四水合物。其中Ca(NO3)2·4H2O,式量236.15,无色晶体,易潮解,溶于甲醇和丙酮。
其中α-式,密度为1.896克/厘米3,熔点42.7℃;β-式,密度为1.82克/厘米3,熔点39.7℃,于132℃分解,一水物是颗粒状物质,熔点约560℃。硝酸钙灼热时分解生成亚硝酸钙并放出氧气。有强氧化性,跟硫、磷、有机物等摩擦、撞击能引起燃烧或爆炸。用作分析试剂、制造烟火、炸药、电子管、火柴等,农业上可用做氮肥。用硝酸跟氢氧化钙或碳酸钙反应可制得本品。
[氰氨化钙]化学式CaCN2,式量80.10。又称碳氮化钙,石灰氮。无色六方晶体,熔点1300℃,当温度高于1150℃时可升华。遇潮湿空气,水解放出氨,具有电石或氨的气味,对人体有刺激性,能使粘膜肿胀,对牲畜也有毒害作用。跟水反应可生成氨和碳酸钙
CaCN2+3H2O=CaCO3+2NH3↑
氰氨化钙是一种重要的氮肥,跟水、二氧化碳反应后方能被植物吸收。一般用做基肥,适用于酸性土壤,也用来做脱叶剂或除草剂。将氮气和碳化钙在电炉中加热至1000℃生成粘结的块状氰氨化钙。
[碳氮化钙]见氰氨化钙条。
[醋酸钙]化学式(CH3COO)2Ca·H2O,式量176.2。俗名醋石,别名乙酸钙。白色针状晶体或结晶性粉末,微有乙酸气味。溶于水,微溶于乙醇。加热时醋酸钙分解为碳酸钙和丙酮。

跟硫酸等反应生成醋酸。用于制丙酮、醋酸及印染业。工业上用木醋液(木材干馏产物)跟消石灰反应,蒸干滤液,再经重结晶制得醋酸钙。用纯醋酸跟纯碳酸钙反应可制得纯醋酸钙。
[氰化钙]化学式Ca(CN)2,式量92.12。无色晶体或白色粉末。在潮湿空气中分解生成氢氧化钙放出剧毒的氰化氢。溶于水及弱酸放出氰化氢。有毒。350℃分解。用做杀虫剂、杀鼠剂,可熏灭柑桔果树上的害虫。用氢氧化钙中和氢氰酸制得。
[磷酸钙]别名磷酸三钙。化学式Ca3(PO4)2,式量310.18。白色无定形粉末。溶于稀盐酸、硝酸、磷酸、乙酸、亚硫酸,生成可溶性酸式磷酸盐,也能溶于铵盐溶液。不溶于水、乙醇和乙醚。熔点1670℃,密度3.14克/厘米3。用于制乳色玻璃、陶瓷、涂料、媒染剂、药物、肥料、家畜饲料添加剂、糖浆澄清剂、塑料稳定剂等。天然矿物叫磷灰石矿,纯品可用氰化钙和磷钠酸溶液作用或者用氢氧化钙跟磷酸作用制得。
[磷酸二氢钙]别名磷酸一钙,化学式Ca(H2PO4)2·H2O式量为252.07。白色三斜晶体。密度2.22克/厘米3,109℃失去结晶水,203℃分解。易潮解,溶于水,不溶于乙醇。用做分析试剂、塑料稳定剂,农业上用做磷肥。由磷酸钙溶于磷酸制得。
[磷酸氢钙]别名磷酸二钙,化学式CaHPO4·2H2O,式量172.09。白色三斜晶体或粉末,密度为2.3克/厘米3,109℃失去一个分子结晶水熔化。微溶于水和乙酸,不溶于乙醇。溶于稀盐酸和硝酸。用做塑料稳定剂,食品添加剂、磷肥、医药。用可溶性钙盐跟磷酸氢二钠反应制取。
[草酸钙]别名乙二酸钙,化学式(COO)2Ca·H2O,式量146.11。白色结晶性粉末。不溶于水和乙酸,溶于稀硝酸和盐酸。200℃时完全失水。用做分析试剂,在分离稀土金属时用作载体,还用于草酸盐的合成。
[钨酸钙]化学式CaWO4,式量287.93。白色结晶,不溶于水。在热盐酸或硝酸中反应生成钨酸。熔点1535℃用于照像、制钨丝。
[次氯酸钙]化学式Ca(ClO)2,式量142.98。白色晶体,密度2.35克/厘米3,不吸湿。100℃时分解。溶于水,易水解。有氧化性。它是漂白粉的有效成分。用作漂白剂、消毒剂、杀菌剂和去臭剂,军事上用于消除毒气。将氯气通入石灰乳中(次氯酸钙比氯化钙溶解度小),经过滤、干燥可得本品。
[漂白粉]由次氯酸钙、氯化钙和氢氧化钙组成的水合复盐。次氯酸钙是其有效成分(纯次氯酸钙又称漂白精)。白色粉末状物质,有氯气气味,这是因为漂白粉吸收空气中的水和二氧化碳,在光照条件下分解,放出游离氯,漂白粉即失效,反应式为
Ca(ClO)2+H2O+CO2=CaCO3+2HClO
2HClO=2HCl+O2↑
Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O
漂白粉有较强的氧化性和漂白作用。通常漂白粉中的有效氯(即一定量的漂白粉跟过量酸作用放出氯气所占样品重量的百分数)约含35%。漂白粉可用于漂白棉、麻、纸浆,也是一种廉价有效的消毒剂、杀虫剂。将氯气通入消石灰中,经干燥制得。
[漂白精]见次氯酸钙条。
[漂白液]通常指次氯酸钙或次氯酸钠液。将氯气通入石灰乳或烧碱溶液中得到的混和物溶液。广泛地用于漂白织物和纸浆。
[碱石灰]又称钠石灰。是氢氧化钠和氧化钙的混和物,白色粉状或颗粒状。能吸收二氧化碳和水分。用做气体的干燥剂和二氧化碳的吸收剂。用浓氢氧化钠溶液跟氧化钙颗粒混和后。在200-250℃时干燥制得。
[电石]见碳化钙条。
[沸石]又称泡沸石。系一系列含结晶水的钠、钙、钡、锶和钾的铝硅酸盐矿物的总称。如钠沸石(Na2O·Al2O3·2SiO2)(H2O)。色浅,具有铝硅酸盐四面体网状结构。密度2.0-2.5克/厘米3,硬度3.5-5.5。有多孔性,表面积很大,有离子交换和吸附能力。用于软化硬水,作催化剂或催化剂载体。有天然沸石也有人造沸石。
[磷酸三钙]见磷酸钙条。
[磷酸二钙]见磷酸一氢钙条。
[磷酸一钙]见磷酸二氢钙条。
[醋石]见醋酸钙条。
[生石灰]见氧化钙条。工业用石灰石经石灰窑煅烧后生成的氧化钙叫生石灰。
[熟石灰]见氢氧化钙条。
[消石灰]见氢氧化钙条。
[过磷酸钙]是磷酸二氢钙跟硫酸钙的混和物,灰褐色颗粒状固体,农业上用做磷肥,其中有效成分是磷酸二氢钙。工业上用磷灰石矿粉跟浓硫酸按一定比例混合制得
Ca3(PO4)2+2H2SO4=Ca(H2PO4)2+2CaSO4
[钠石灰]见碱石灰条。
[大理石]主要成分是碳酸钙。天然产者呈粒状或结晶形。由极细的方解石或白云石的结晶组合而成。质地较硬致密,有良好的磨光性。洁白的汉白玉也是一种大理石。主要用做建筑材料,室内装饰材料,细粉可用作橡胶,油漆的填料。
[方解石]主要成分是碳酸钙。无色有玻璃光泽的透明晶体,含杂质者呈淡黄色,玫瑰色或褐色。三方晶系。成菱面体和偏三角体,三向完全解理。密度为2.6-2.8克/厘米3,硬度3.0。用于制碳酸钙,磨成细粉可做橡胶,油漆的填充物,可用做建筑材料和硅酸盐工业的原料。
[白云石]主要成分是CaMg(CO3)2或CaCO3·MgCO3,常呈白色、黄色或灰白色。密度2.872克/厘米3,硬度3.5-4.0,熔点730-760℃并分解。质密,块状,三方晶系,有玻璃光泽,有时呈珍珠光泽,条痕为白色。难溶于水。遇冷盐酸反应缓慢,跟10%盐酸几乎不反应,跟方解石有明显的区别。用作建筑材料、耐火材料、冶金熔剂。制水泥的原料。磨成细粉,用来作橡胶制品、油漆的填料。
[白垩]主要成分是碳酸钙,白色或灰白色固体。质地松软,容易破碎。是生物有机质形成的沉积岩,由方解石质点和有孔虫、软骨动物和球菌类的方解石质碎屑组成。用作制造石灰、水泥、玻璃、陶瓷、粉笔,以及橡胶、油漆、纸张的填料等。
[石灰石]主要成分是碳酸钙,是由方解石组成的一种矿石,含有石英、白云石和粘土等杂质。因含有不同的杂质,颜色有灰白色、灰色、灰黑色、浅黄色,褐色或浅红色等,密度为2.2-2.9克/厘米3。难溶于水。易溶于含二氧化碳的水中,生成可溶性的酸式碳酸钙。溶于盐酸放出二氧化碳。煅烧时生成生石灰和二氧化碳。用做建筑材料,烧制右灰,制造水泥、玻璃、纯碱和沉淀碳酸钙等。炼铁时用做熔剂。
[石灰水]氢氧化钙的水溶液。
[石灰乳]氢氧化钙跟水组成的白色悬浊液,可用来粉刷墙壁、消毒杀菌等。
[石灰氮]见氰氨化钙条。
[萤石]主要成分是氟化钙CaF2,又称氟石。含氟的主要矿石。因有显著的萤光现象而得名。常呈立方体、八面体、菱形十二面体等不同晶体,萤石为致密的块状矿石。因含不同的杂质而呈无色、灰色、黄色、绿色、紫色等。透明,有玻璃光泽,质脆,密度3.01-3.25克/厘米3,硬度4.0。难溶于水,跟硫酸反应,放出氟化氢。萤石在冶金工业上用作助熔剂,化学工业用它制氟、氟化氢和其它氟化物,硅酸盐工业用它制乳浊玻璃和搪瓷等,无色透明的萤石可制光学仪器中的棱镜和透光镜。
[石膏]又称生石膏,主要成分是CaSO4·2H2O。常见的硫酸盐矿物。系无色、白色、灰色、淡黄色、粉红色、透明或半透明的单斜晶体。有玻璃光泽,常为块状,纤维状或片状,完全解理,质脆、密度2.32克/厘米3、硬度2.0,微溶于水。细粒致密块状的称为雪花石膏。128℃失3/2H2O,150℃脱水成熟石膏(CaSO4·H2O),加热到500℃以上成无水石膏。用于制造硫酸,水泥,熟石膏,还用作制油漆,纸张的填料,制豆腐的凝结剂。中医用它做清热药,性大寒,味辛甘,可治高烧、烦渴、肺热喘嗽和胃火牙痛等。
[熟石膏]主要成分CaSO4·H2O,白色粉状固体。由生石膏CaSO4·2H2O,在150℃时脱水生成。熟石膏跟水混和成糊状逐渐硬化并膨胀,可用来制石膏塑像、模型、粉笔及医用石膏绷带等。
[重过磷酸钙]即磷酸二氢钙Ca(H2PO4)2,是用磷酸跟磷灰石(主要成分是磷酸钙)混合制得
Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2
主要用作磷肥,但不能跟碱性肥料或石灰混合施用,否则会转化成难溶于水的磷酸钙。
[亚硫酸钙]化学式CaSO3·2H2O,式量156.17。白色结晶性粉末,微溶于水,易溶于二氧化硫饱和溶液,生成易溶的亚硫酸氢钙Ca(HSO3)2。在空气中易被氧化生成硫酸钙。用作分析试剂,还用于纺织工业和造纸工业。由熟石灰跟二氧化硫反应制得。
[锶]元素符号Sr,原子序数38,原子量87.62,外围电子排布式5s2,位于第五周期第ⅡA族。是一种银白色有光泽的金属质软,容易传热导电。密度2.54克/厘米3,熔点769℃,沸点1384℃。原子体积33.3厘米3/摩尔,原子半径215.1皮米,离子半径112皮米,第一电离能552千焦/摩尔,电负性1.0。硬度1.8,电导性4.2,主要氧化数±2。化学性质活泼,在空气中加热到熔点时即燃烧,呈红色火焰,生成氧化锶SrO,在加压条件下跟氧气化合生成过氧化锶SrO2。跟卤素、硫、硒等容易化合。加热时跟氮化合生成氮化锶Sr3N2。加热时跟氢化合生成氢化锶SrH2。跟盐酸、稀硫酸剧烈反应放出氢气。常温下跟水反应生成氢氧化锶和氢气。用于制造合金、光电管、照明灯。它的化合物用于制信号弹、烟火等。质量数为90的锶是一种放射性同位素,可做β射线的放射源,半衰期为25年,在医学上有一定的应用。在自然界主要以化合态存在,主要的矿石有天青石SrSO4,菱锶矿SrCO3。锶是碱土金属中丰度最小的元素。1808年英国化学家戴维电解碳酸锶时发现了金属锶。工业用电解熔融的氯化锶制取锶。
[氢氧化锶]化学式Sr(OH)2·8H2O,式量265.76。无色结晶或白色粉末。易潮解,在空气中吸收二氧化碳成碳酸盐,在干燥空气中能失去七个分子结晶水。溶于热水和酸,微溶于冷水。用于制备各种锶盐。
[硝酸锶]化学式Sr(NO3)2,式量211.63。无色晶体或白色粉末。易潮解,易溶于水,微溶于乙醇和丙酮,遇高温或与硫、磷及有机物接触、摩擦或撞击能引起燃烧或爆炸。熔点570℃。用作高纯分析试剂,电子管阴极材料,烟火材料。用硝酸跟氢氧化锶反应可制得本品。
[碳酸锶]化学式SrCO3,式量147.63。白色粉末,不溶于水,微溶于含二氧化碳的水和铵盐溶液。加热至900℃分解成氧化锶和二氧化碳,溶于稀盐酸和稀硝酸并放出二氧化碳。熔点1497℃。用作电子元件材料、光谱试剂、烟火材料、制彩虹玻璃和其它锶盐的制备。
[氯化锶]化学式SrCl2·6H2O,式量266.62。白色针状晶体,味苦,在干燥空气中风化,在潮湿空气中潮解。溶于水,微溶于乙醇和丙酮。热至61.4℃失去四个分子结晶水,100℃成为一水盐,115℃溶于结晶水中,无水盐熔点873℃。用做化学试剂、制药、制锶盐。用盐酸跟氢氧化锶或碳酸锶反应制得。
[钡]元素符号Ba,原子序数56。原子量137.33,外围电子排布式6s2,位于第六周期第ⅡA族。银白色金属,略有光泽,有延展性,密度为3.51克/厘米3,熔点725℃,沸点1640℃。原子半径为217.3皮米,离子半径134皮米,第一电离能564千焦/摩尔,电负性0.9,主要氧化数+2。化学性质很活泼,在室温下钡在空气中缓慢氧化生成氧化膜阻碍进一步氧化。在空气中或氧气中燃烧呈现绿色火焰,生成过氧化钡BaO2。能跟卤素,硫等非金属化合,在120℃时吸收氢气并化合生成氢化钡BaH2。常温下跟水反应生成氢氧化钡放出氢气。跟盐酸、稀硫酸等反应生成钡盐并放出氢气。钡盐除硫酸钡外都有毒。用于生产钡镍合金、钡钙铅等合金,制钡盐,制烟火。1808年英国化学家戴维用汞做阴极、电解由重晶石制得的电解质时发现了金属钡。自然界主要含钡的矿物有重晶石和碳酸钡矿。电解熔融的氯化钡(含有氯化铵)可制得钡。
[氧化钡]化学式BaO,式量153.34。白色固体,有毒,密度5.72克/厘米3,熔点1918℃,沸点200O℃,极易从潮湿空气中吸收水蒸气。溶于水并跟水化合生成氢氧化钡,吸收二氧化碳生成碳酸钡,跟酸反应生成钡盐和水,在高温时能跟氧反应形成过氧化钡BaO2。用于玻璃工业,陶瓷工业。制造过氧化钡和钡盐,还用作脱水剂、气体干燥剂。加热碳酸钡或硝酸钡可制得本品。
[过氧化钡]化学式BaO2,式量169.34,白色或微带灰色的粉末,在空气中吸收二氧化碳生成碳酸钡放出氧气,跟酸反应生成盐和过氧化氢。跟有机物接触、摩擦或撞击,能引起燃烧或爆炸。熔点450℃。有漂白性。用于制过氧化氢、用做氧化剂、漂白剂、媒染剂等。
[氢氧化钡]化学式Ba(OH)2,式量171.36。白色无定形粉末,溶于水,微溶于乙醇。熔点408℃。有毒。碱性较强,吸收二氧化碳生成碳酸盐和水,跟酸反应生成盐。用作分析试剂,如作标准碱液,测定二氧化碳的含量等。
[氯化钡]化学武BaCl2,式量208.25。无色单斜晶体。密度3.856克/厘米3。二水合氯化钡BaCl2·2H2O为无色有光泽的单斜晶体,密度3.097克/厘米3,在113℃失去结晶水。氯化钡的熔点963℃。沸点1560℃。在空气中能吸收水分。易溶于水。微溶于盐酸,不溶于乙醇。有毒,对人的致死量为0.8克。用作分析试剂(例如硫酸盐和硒酸盐的测定)、脱水剂。用于电子、仪器、冶金等工业。还用于鞣革、颜料工业,用作杀鼠剂、润滑油填加剂,冶金工业热处理的介质等。由重晶石跟煤粉混和焙烧,生成硫化钡,再用水浸取,硫化钡水解生成Ba(HS)2,BaOH)2进入溶液,再用盐酸酸化浸出液至pH=9时经提纯得本品。
BaSO4+4C=BaS+4CO↑
BaSO4+4CO=BaS+4CO2↑
2BaS+2H2O=Ba(HS)2+Ba(OH)2
Ba(HS)+2HCl=BaCl2+2H2S↑
Ba(OH)2+2HCl=BaCl2+2H2O
[硝酸钡]化学式Ba(NO3)2,式量261.35。无色立方晶体或白色粉末、有毒、密度3.24克/厘米3,微具吸湿性,溶于水,不溶于乙醇。加热时分解放出氧气,有强氧化性,跟硫、磷、有机物接触、摩擦或撞击能引起燃烧或爆炸。熔点592℃,温度再高即分解。燃烧时呈现绿色火焰。用作氧化剂、分析试剂。用于制钡盐、信号弹及焰火,还用于制陶瓷釉、医药等。由硝酸跟氢氧化钡反应制得。
[碳酸钡]化学式BaCO3,式量197.35。六角形微细晶体或白色粉末。不溶于水,密度4.43克/厘米3,熔点1740℃(8820千帕--90大气压)。1450℃分解,放出二氧化碳。微溶于含有二氧化碳的水,也溶于氯化铵或硝酸铵溶液生成络合物,溶于盐酸、硝酸放出二氧化碳。有毒。用于电子、仪表、冶金工业。配制焰火,制信号弹,陶瓷涂料,制光学玻璃的辅料。还用作杀鼠药、水澄清剂和填料。有天然碳酸钡矿,将二氧化碳通入氢氧化钡溶液,或将碳酸钠溶液跟硝酸钡溶液混合制得。
[硫酸钡]化学式BaSO4,式量233.4。白色斜方晶体。密度4.5克/厘米3,熔点1590℃,1149℃转变为单斜晶体。难溶于水。不溶于盐酸、硝酸、稀硫酸、醋酸等。溶于浓硫酸和热亚硫酸。具有强烈吸收X射线的能力。硫酸钡是唯一无毒的钡盐。跟煤粉混和煅烧,可生成硫化钡和一氧化碳。用于分析试剂、电子、仪表、冶金等工业,用作白色颜料,肠胃X射线透视造影时服用的药剂,以及橡胶、造纸、塑料的白色填料。由硫酸跟氯化钡反应制得。天然矿物叫重晶石。
[重晶石]天然产硫酸钡矿石。无色透明晶体,含有杂质时呈现白色、灰色、红色、黄色或褐色。有玻璃光泽,斜方晶体,多为板状,也有柱状,完全解理,质脆,密度4.3-4.6克/厘米3,硬度2.5-3.5,不溶于水,不溶于酸。用作白色颜料、涂料、橡胶、造纸的填料,制造各种钡化合物。石油钻井中用作泥浆的加重剂,防止井喷,还用于玻璃,陶瓷的制造。
[硫化钡]化学式BaS,式量169.4。黄色或黑红粉末。有硫化氢气味。遇水逐渐水解为硫化氢和氢氧化钡。含有微量杂质时则发磷光。有腐蚀性。用于制无砷硫化氢。加硫剂,制造钡盐、发光粉的基质。硫酸钡跟煤粉混和煅烧、分离提纯即得。
[钡白]见硫酸钡条。
[氯酸钡]化学式Ba(ClO3)2·H2O,式量322.26。无色晶体或白色粉末。溶于水,微溶于乙醇和丙酮。迅速加热或跟碳末、硫、磷、有机物混合撞击会发生爆炸。用做分析试剂、氧化剂、还用于染料工业,绿色焰火和炸药的配制。
[镭]元素符号Ra,原子序数88,原子量226.03。外围电子排布7s2,密度6.0克/厘米3,熔点700℃,沸点<1140℃,位于第七周期第ⅡA族。银白色有光泽的软金属。第一电离能509.37千焦/摩尔,电负性0.9。化学性质活泼,在空气中不稳定,易跟空气中氮气和氧气化合。跟水反应生成氢氧化镭(Ra(OH)2)并放出氢气。溶于稀酸。化学性质跟钡十分相似。镭的氯化物、溴化物、氢氧化物易溶于水,硫酸盐、碳酸盐微溶于水。已知镭有13种同位素,镭-226半衰期最长,为1622年。镭有很强的放射性,衰变时放出α和γ两种射线,并放出大量热(每克镭每小时放热586.18焦尔),裂变生成氡和氦,氡也有放射性。在镭射线照射下,水、氨、氯化氢能分解,氧气能转变成臭氧。硫化锌、硫化钙等碱土金属硫化物,在镭射线的照射激发下能发出浅绿色柔和的磷光。镭射线能破坏动物体,杀死细胞、细菌。利用镭的放射性可治疗癌症,在硫化锌,硫化钙中混入10ppm的镭盐,可制成发光涂料、发光塑料。镭盐跟铍粉的混合制剂,可作中子放射源,用于探测石油资源和岩石的组成。镭在自然界中以化合态存在,主要存在于多种矿物、土壤、矿泉水和海底淤泥中。镭在自然界中分布特别稀少,仅占地壳原子总数的一百亿亿分之八。1898年法国科学家居里夫妇从沥青铀矿中发现镭,居里夫人于1910年从沥青铀矿中制得纯净金属镭。镭的希腊原文是射线。用汞阴极和钯-铱阳极电解氯化镭溶液可得到镭汞剂,然后在氢气中进行热分解制得。
[锂]元素符号Li,原子序数3,原子量6.94,核外电子排布式1s22s1,在元素周期表中第二周期第Ⅰ主族。在常温下是银白色金属,密度0.534克/厘米3,熔点180.54℃,沸点1317℃,硬度0.6,导电性11.2(Hg=1),锂是最轻的金属。化学性质活泼,电离势520.27千焦/摩尔。电负性1.0。可与氧、氯、氮、硫等直接化合。在常温下锂跟氮化合生成氮化锂(Li3N),在500℃时跟氢化合生成稳定的氢化锂(LiH)。锂跟水剧烈反应生成氢氧化锂和氢气,跟盐酸反应生成氯化锂和氢气。1817年瑞典化学家阿尔费德逊研究锂长石时得到硫酸锂,从而发现了锂,1865年德国化学家本生等电解氯化锂制得金属锂。在自然界中,锂主要以锂辉石和锂云母及磷铝石矿的形式存在,工业上由电解熔融的氯化锂来制取锂。将质量数为6的同位素(6Li)放在原子反应堆中用中子照射,可以得到氚,氚用来进行热核反应,是制造氢弹的重要材料。在冶金工业中锂可用作脱氧剂和脱氯剂并用以制取轻质铝合金。由于锂易被氧化,它通常保存在液体石蜡中。
[氧化锂]化学式Li2O,分子量29.88,白色立方晶体,密度2.013克/厘米3,熔点>1700℃。属于碱性氧化物,跟水化合较慢。锂在空气中燃烧可生成氧化锂。
[氢氧化锂]化学式LiOH,分子量23.95。白色四方晶体,密度1.46克/厘米3,熔点450℃,沸点924℃(分解),能溶于水,20℃在水中的溶解度为12.8克,略溶于乙醇。属于中强碱。有腐蚀性,防潮,应密封保存。可用作照像显影剂,制锂盐,碱性铁镍蓄电池的制造。
[氢化锂]化学式LiH,分子量7.95。白色或浅灰色半透明晶体。见光迅速变暗。在常温或干燥空气中,较稳定。遇水迅速反应生成氢氧化锂和氢气而燃烧;遇低级醇或有机酸也能反应并放出氢气。不溶于乙醚、苯和甲苯等各种溶剂。熔点668℃。用做干燥剂,氢气发生剂,有机合成还原剂等。
[氯化锂]化学式LiCl,分子量42.44。白色晶体或粉末。易潮解,溶于水、醇、醚、丙酮、异戊醇和氢氧化钠溶液等。熔点614℃。用做气相色谱固定相,用于沸点较高的多核芳香烃的分析及烟火制造、制药工业等。
[碳酸锂]化学式Li2CO3,分子量73.88。白色单斜结晶或粉末,微溶于水,不溶于醇和丙酮。1310℃时碳酸锂分解为氧化锂和二氧化碳,碳酸锂溶于稀酸放出二氧化碳。碳酸锂可用做催化剂,制备锂盐,制造陶瓷,制药等。
[硝酸锂]化学式LiNO3,分子量68.94。无色结晶或白色结晶颗粒。易潮解,溶于水和醇。硝酸锂是强氧化剂,受热分解生成氧化锂、二氧化氮和氧气。硝酸锂常用做分析试剂,制造荧光体,溶解降温剂、制造锂盐等。
[硫酸锂]化学式Li2SO4 ·H2O,分子量192。无色单斜结晶。溶于水,不溶于醇和丙酮。加热至130℃时失去结晶水。熔点860℃(无水物)。可用做分析试剂,钙和镁的分离,医药工业等。
[氢化锂铝]化学式LiAlH4,分子量37.95。多孔的微晶性粉末。久贮能变成灰色,在干燥的室温下较稳定,在潮湿空气中易分解。易跟水或醇反应而放出氢气,氢气随即燃烧。加热至130℃时分解。溶于醚、四氢呋喃。应密封保存。用做测定羰基的试剂、还原剂以及氢化物、硅烷、硼烷等的制备等。
[硼氢化锂]化学式LiBH4,又称锂硼氢,白色或灰色结晶粉末。有吸湿性,能溶于水。在干燥空气中稳定,在潮湿空气中分解,在碱性水溶液中缓慢分解。与甲醇作用生成硼甲氧化锂和氢气。跟氯化氢反应生成氢气、乙硼烷和氯化锂。还可用做强还原剂。由硼氢化钠和氯化锂作用而制得。
[云母]云母族矿物的总称。商业上称作“千层纸”。主要成分是钾、镁、铝、锂等的铝硅酸盐。单斜晶系,晶体常呈假六方片状,集合体为鳞片状。颜色随成分而异,有白色、黑色、褐色、绿色。有玻璃光泽,硬度2-3,解理平行底轴面,极完全,薄片具有弹性。根据成分不同,云母分为白云母、黑云母、锂云母、金云母等。白云母、金云母有优良的耐热性、电气绝缘性及耐酸碱腐蚀性,是重要的电气绝缘材料。锂云母是提取锂盐的重要材料之一。
[钠]元素符号Na,原子序数11,原子量22.99,核外电子排布式为1s22s22p63s1,在元素周期表中第三周期第Ⅰ主族,属于碱金属元素。固体原子体积23.68厘米3/摩尔,原子半径0.154纳米(1.54 ),离子半径0.095纳米(0.95
),离子半径0.095纳米(0.95 ),第一电离势495.77千焦/摩尔,电负性0.9,固体密度0.971克/厘米3(20℃),熔点97.8℃,沸点883℃,硬度0.4。银白色有金属光泽、轻软,有良好延展性和传热导电性。化学性质很活泼。钠在常温缺氧条件下跟氧化合生成氧化钠,燃烧时有黄色火焰生成过氧化钠,在300℃以上跟氢气化合生成离子型氢化钠,在氯气中燃烧有黄色火焰生成氯化钠。少量钠跟硫粉混和研磨则剧烈反应生成硫化钠,钠在常温下跟水剧烈反应生成氢氧化钠和氢气,跟盐酸或稀硫酸等酸反应生成钠盐和氢气,钠有很强的还原性,可将钛、锆、铌、钽等金属从它们的熔融卤化物中还原出来。将钠投入较不活动金属盐溶液中时,钠先跟水反应生成氢氧化钠和氢气,氢氧化钠再跟盐发生复分解反应生成新碱和新盐。在自然界中,钠以化合态存在,分布广,在地壳中约含2.64%。1807年英国化学家戴维在电解熔融的碳酸钠和氢氧化钠时发现了钠。工业上一般用电解熔融的氯化钠来制取钠。钠在有机合成及某些稀有金属冶炼中用做还原剂,钠可用来制备过氧化钠、四乙基铅等。钠和钾的合金(含50-80%的钾)在常温下呈液态,可用做核反应堆的导热剂;钠蒸气的光谱,主要是黄色D线,能用做单色光源。
),第一电离势495.77千焦/摩尔,电负性0.9,固体密度0.971克/厘米3(20℃),熔点97.8℃,沸点883℃,硬度0.4。银白色有金属光泽、轻软,有良好延展性和传热导电性。化学性质很活泼。钠在常温缺氧条件下跟氧化合生成氧化钠,燃烧时有黄色火焰生成过氧化钠,在300℃以上跟氢气化合生成离子型氢化钠,在氯气中燃烧有黄色火焰生成氯化钠。少量钠跟硫粉混和研磨则剧烈反应生成硫化钠,钠在常温下跟水剧烈反应生成氢氧化钠和氢气,跟盐酸或稀硫酸等酸反应生成钠盐和氢气,钠有很强的还原性,可将钛、锆、铌、钽等金属从它们的熔融卤化物中还原出来。将钠投入较不活动金属盐溶液中时,钠先跟水反应生成氢氧化钠和氢气,氢氧化钠再跟盐发生复分解反应生成新碱和新盐。在自然界中,钠以化合态存在,分布广,在地壳中约含2.64%。1807年英国化学家戴维在电解熔融的碳酸钠和氢氧化钠时发现了钠。工业上一般用电解熔融的氯化钠来制取钠。钠在有机合成及某些稀有金属冶炼中用做还原剂,钠可用来制备过氧化钠、四乙基铅等。钠和钾的合金(含50-80%的钾)在常温下呈液态,可用做核反应堆的导热剂;钠蒸气的光谱,主要是黄色D线,能用做单色光源。
[氧化钠]化学式Na2O,式量61.98。白色固体,密度2.27克/厘米3,熔点920℃,1275℃升华,易潮解。氧化钠系碱性氧化物,跟水化合生成氢氧化钠。制备纯氧化钠很困难,在真空中使叠氮酸钠(NaN3)和硝酸钠反应可生成氧化钠并放出氮气,或用钠跟过氧化钠、硝酸钠、亚硝酸钠相互反应来制备:
2Na+Na2O2=2Na2O
6Na+2NaNO2=4Na2O+N2↑
5NaN3+NaNO3=3Na2O+8N2↑
[过氧化钠]化学式Na2O2,式量77.98,密度2.805克/厘米3,熔点460℃(分解)。属于离子型化合物,含O22-离子。过氧化钠的结构可表示为:
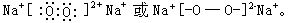
淡黄色粉末(十分纯的为白色粉末),易水解,跟水反应生成氢氧化钠和过氧化氢,过氧化氢进一步分解生成水并放出氧气,过氧化钠溶液有强氧化性,可用作氧化剂、杀菌剂、漂白剂、消毒剂。过氧化钠溶于稀硫酸生成硫酸钠和过氧化氢,过氧化钠在潮湿空气中吸收二氧化碳并放出氧气同时生成碳酸钠,过氧化钠用于潜水艇中。工业上用钠在不含二氧化碳的干燥空气流中加热到300-400℃即可制得Na2O2。
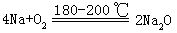

[氢化钠]化学式NaH,式量23.998。白色晶体,属于离子晶体,类盐化合物,其中氢为负一价离子。加热时不稳定,不待熔化即分解,氢化钠跟水发生水解反应生成氢氧化钠并放出氢气。氢化钠是强还原剂,如在400℃时能将四氯化钛还原为金属钛:
TiCl4+4NaH=Ti+4NaCl+2H2↑
钠在氢气流中于300-400℃时化合生成氢化钠。
[氢氧化钠]化学式NaOH,式量40。俗称烧碱、火碱、苛性钠。白色固体、密度2.13克/厘米3,熔点318.4℃,沸点1390℃,易溶于水,并放出大量热,溶解热43.47千焦/摩尔,暴露在空气中易吸收水分而潮解,其水溶液能使酚酞试液变红,便红色石蕊试纸变蓝,使甲基橙溶液变黄。苛性钠是可溶性强碱,有强腐蚀性,可跟酸中和生成盐和水,可跟酸性氧化物反应生成对应酸的盐和水,可跟某些金属盐溶液反应生成不溶性碱和盐,跟油脂发生皂化反应。苛性钠是重要的基本化工原料,利用氢氧化钠跟油脂的反应制取肥皂;在纺织、印染工业上用来清除纤维表面的油脂,电镀时用来清洗金属表面的油污,石油炼制中用来中和酸,造纸工业用来制造纸浆。工业上主要用电解饱和食盐水来制备氢氧化钠,同时得到氢气和氯气。土法用碳酸钠与石灰乳反应制取。由于氢氧化钠易潮解,同时吸收空气中的二氧化碳变成碳酸钠,故应保存在密闭容器中。
[氯化钠]化学式NaCl,即食盐。式量58.44。无色立方晶体,常见的为白色晶体粉末,密度2.165克/厘米3,熔点800.4℃,沸点1413℃,味咸。易溶于水,略有潮解性,可用于食品,调味和腌制鱼肉禽蛋蔬菜,纯NaCl可配成生理盐水,用于医疗和生理实验;是重要的化工原料,可用于制钠、氯气、氢氧化钠、盐酸、次氯酸盐、氯酸盐、漂白粉等。自然界中有固态食盐矿,大量食盐存在于海水和盐湖中。工业上主要通过蒸发海水法析出食盐晶体。
[氟化钠]化学式NaF,式量41.99。白色粉末,易溶于水,水溶液显碱性,对玻璃有腐蚀性。熔点992℃,有毒。主要应用于微量分析法测定钪、光电比色法测定磷、钢铁分析试剂,血液检验、掩蔽剂,木材防腐剂等。
[溴化钠]化学式NaBr,式量102.9。无色单斜晶体,密度3.203克/厘米3,熔点755℃,沸点1390℃。易潮解,易溶于水,微溶于乙醇和甲醇,应避光,密封保存。医药上用做神经镇静剂、分析试剂、微量分析法测定镉的含量;还用于有机合成,跟硝酸银溶液等作用制备照像用乳胶。在沸腾的碳酸钠溶液中逐渐加入溴化铁溶液呈中性时,过滤、蒸发滤液析出溴化钠晶体。
[碘化钠]化学式Nal,式量149.88。晶体为二水合碘化钠,化学式Nal·2H2O,式量185.92,无色晶体,有潮解性,易溶于水、乙醇和甘油。65℃以上失去结晶水,熔点752℃。在空气或水溶液中易被空气中的氧氧化而析出碘颜色变黑。应避光,密封保存。碘化钠用做分析试剂、微量分析法测定钯、铂和铊等。碘的助溶剂(碘化钠在水溶液中跟碘形成络合物,增大碘的溶解性),还可用作制药,照像用乳胶和制单晶的原料。
[硝酸钠]化学式NaNO3,式量84.99,俗名智利硝石。无色六角晶系菱面体结晶,密度2.25克/厘米3,在潮湿空气中潮解。熔点308℃。极易溶于水,微溶于醇。加热到380℃即分解生成亚硝酸钠和氧气。有强氧化性,与硫、磷、有机物等摩擦或撞击,能引起燃烧或爆炸。用作化学分析试剂、氧化剂、化学肥料,制焰火,制硝酸,染料合成等。
[亚硝酸钠]化学式NaNO2,式量69。细小的无色或微黄色结晶,密度2.168克/厘米3,极易溶于水,极难溶于无水乙醇。熔点271℃(约320℃分解),有毒,有潮解性。宜防潮密封保存。有强氧化性。跟硫、磷、有机物等摩擦或撞击可引起燃烧或爆炸。用做微量分析试剂、氧化剂、重氮化试剂、亚硝酸盐或亚硝基化合物的合成。大量用做防锈剂、印染、制取偶氮染料等。亚硝酸钠水溶液呈弱碱性,能从空气中吸取氧,使亚硝酸钠逐渐氧化成硝酸钠。将硝酸钠跟铅混合加热至熔融可制得亚硝酸钠。
[硫酸钠]化学式Na2SO4 ,式量142.04。无色单斜晶体。密度2.68克/厘米3,熔点884℃,241℃转为六方晶体,有潮解性、易溶于水,不溶于醇。无水硫酸钠可用做分析试剂,如氮的测定。还可用做脱水剂。硫酸钠的结晶水合物有两种:一种是七水合硫酸钠Na2SO4 ·7H2O,白色正交或四方晶体,24.4℃时失水。另一种是十水硫酸钠Na2SO4 ·10H2O,俗名芒硝,元明粉,保险粉等。无色单斜晶体、密度1.464克/厘米3,熔点32.38℃,100℃时失去结晶水变成无水硫酸钠,易溶于水,在干燥空气中易风化变成无水白色粉末。硫酸钠可用做化学分析试剂,如染料的检定,印染工业用做媒染剂,也是重要的化工原料,用来制造硫化钠、玻璃、水玻璃、瓷釉、造纸浆,医疗上用做缓泻剂和钡盐中毒的解毒剂。冬季盐池中有硫酸钠晶体析出。
[亚硫酸钠]化学式Na2SO3,式量126.04。无色或白色结晶性粉末,易溶于水,微溶于醇。亚硫酸钠结晶水合物,化学式Na2SO3·7H2O,式量252.15,无色单斜晶体,密度2.63克/厘米3,易溶于水,水溶液呈碱性。加热到150℃时失去结晶水,继续加热可熔化为硫酸钠和硫化钠的混和物。它的水溶液可以溶解硫生成硫代硫酸钠Na2S2O3。在空气中逐渐被氧化成硫酸钠。可以用做还原剂,防腐剂,制备硫代硫酸钠,光敏电阻、配制照像用的显影液。把碳酸钠溶液加热到40℃,通入二氧化硫使溶液饱和,再加入等量的碳酸钠溶液,即得亚硫酸钠溶液,密闭静置即得晶体。
[硫代硫酸钠]俗名海波或大苏打。化学式Na2S2O3·5H2O,式量248.18。无色透明,单斜晶体,密度1.729克/厘米3,在33℃以上的干燥空气里风化。易溶于水,水溶液呈弱碱性,不溶于乙醇。56℃时溶于结晶水中,100℃时失水,灼烧时分解为硫化钠及硫酸钠,跟强酸反应析出硫并放出二氧化硫。
Na2S2O3+H2SO4 =Na2SO4 +S↓+SO2↑+H2O
其水溶液可溶解溴化银或氯化银。
AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr
因此,可用做照像的定影剂。海波有还原性,可用做去氯剂、媒染剂,还常用做分析试剂,如氧化-还原滴定剂。用亚硫酸钠溶液跟硫共煮后过滤、蒸发、结晶即得硫代硫酸钠晶体。
[硫化钠]化学式Na2S·9H2O,式量240.18。无色晶体,易潮解,能溶于水和乙醇。水解后溶液呈碱性,有腐蚀性,接触皮肤或角质时,能使之软化溶解并使毛发脱落。50℃时溶于结晶水中。见光变黄,在空气中能被氧化成硫代硫酸钠。在水溶液中加硫后生成多硫化钠(Na2Sx,x=2,3,4或5)。用于制备硫化染料,皮革脱毛剂,有机化学工业上用做还原剂。用硫酸钠跟碳混和煅烧,硫酸钠可被还原生成硫化钠。
[氯酸钠]化学式NaClO3,式量106.46。无色正交或三方晶系,密度2.49克/厘米3,熔点248-261℃,极易溶于水难溶于乙醇。温度高于261℃时分解生成氯化钠和氧气,是强氧化剂。用于制火柴、烟火、可做氧化剂,除草剂,还用于冶金工业。工业上用电解热浓碱性氯化钠溶液制备。
[高氯酸钠]化学式NaClO4·H2O,式量140.46。无色棱形晶体。密度2.02克/厘米3,熔点482℃,并开始分解,有潮解性,能溶于水和酒精,其饱和水溶液在143℃时沸腾。加热到50℃时失去结晶水而成无水物,具有强氧化性,和硫、磷、有机物共同研磨或撞击会发生爆炸或燃烧。可用做分析试剂、氧化剂。工业上用电解氯酸钠冷溶液后经浓缩,结晶制取。
[次氯酸钠]化学式NaClO,式量74.45。没有无水状态的次氯酸钠。次氯酸钠的水溶液是碱性无色液体,能逐渐转化成氯化钠、氯酸钠和氧气,转化的速度取决于溶液的浓度及游离碱杂质的浓度,在光照或加热条件下反应进行的特别迅速。在真空中蒸发次氯酸钠溶液时,可以析出不稳定的NaClO·5H2O,它极易转变为NaClO·H2O,后者加热到70℃时即分解并爆炸。次氯酸钠是强氧化剂,有漂白性,医疗上用做强消毒剂,可杀灭肝炎病毒,还可用于纺织品和纸浆的漂白。在-10℃以下时向50%氢氧化钠溶液和冰的混合物中通入氯气,可制成中等浓度的次氯酸钠溶液,保存在冷暗的地方。
[氰化钠]化学式NaCN,式量49.01。无色立方晶体,熔点563.7℃,沸点1496℃,易溶于水,微溶于乙醇。易潮解并产生微量氰化氢。剧毒。易水解,水溶液呈强碱性。化学分析中用它做掩蔽剂,冶金、电镀工艺中用它做络合剂,用于昆虫激素的研究。用氢氧化钠和氢氰酸中和制成。
[碳酸钠]俗名纯碱,苏打。无水碳酸钠的化学式Na2CO3,式量105.99。白色晶体。通常含有结晶水,有一水合物Na2CO3·H2O、七水合物Na2CO3·7H2O和一水合物Na2CO3·10H2O。无水物密度2.532克/厘米3,熔点851℃,易溶于水,水溶液呈碱性,能从潮湿空气中吸收水蒸气和二氧化碳生成碳酸氢钠。碳酸钠的结晶水合物在干燥空气中容易风化。碳酸钠是重要的化工原料,广泛应用于纺织、造纸、肥皂、玻璃、洗涤剂和皮革等的生产,冶金工业用它做助熔剂,还可用做硬水软化剂。
[碳酸氢钠]也叫重碳酸钠或酸式碳酸钠,俗称小苏打。化学式NaHCO3,式量84。白色单斜棱柱晶体。密度2.159克/厘米3,加热时(270℃)分解生成碳酸钠、水和二氧化碳。能溶于水,不溶于乙醇,水溶液显弱碱性。遇酸放出二氧化碳。用于制造糕点、清凉饮料、医药和喷粉灭火剂等。
[磷酸钠]又称磷酸三钠。十二水合磷酸钠的化学式是Na3PO4·12H2O,式量380.12。无色三方晶体,密度1.62克/厘米3,73.4℃时溶于结晶水中,100℃时失去结晶水。可溶于冷水,易溶于热水。在水溶液中水解生成磷酸氢二钠及氢氧化钠,故溶液呈强碱性。无水物密度2.54克/厘米3,熔点1340℃。用做软水剂、金属防锈剂、糖汁净化剂、锅炉清洁剂等。
[磷酸氢二钠]别名磷酸二钠或磷酸一氢钠,化学式Na2HPO4·12H2O,式量358.14。无色正交或单斜晶系柱状晶体。密度1.52克/厘米3,34.6℃溶于结晶水中,易溶于水不溶于醇,水溶液呈碱性。易风化,35.1℃时失去5个结晶水,100℃时失去全部结晶水。250℃分解为焦磷酸钠Na4P2O7。纯品为常用分析试剂,pH基准试剂,工业上用做木材、纺织品及纸张的防火剂,也用于配制釉药、焊药等。用20%磷酸跟饱和碳酸钠混和加热,至溶液呈弱碱性时,过滤、蒸发、结晶可制得本品。
[磷酸二氢钠]别名磷酸一钠,化学式NaH2PO4·2H2O。式量156.01,无色正交系晶体,密度1.91克/厘米3,60℃时溶于结晶水,100℃时失去结晶水,继续加热至200℃时分解成Na2H2P2O7。易溶于水,它的水溶液呈弱酸性。用于制革,处理锅炉水,制焦磷酸钠等。用50%磷酸跟碳酸钠反应至甲基橙显明显红色(pH4.2-4.6)时,除去CO2,结晶即得。
[焦磷酸钠]化学式Na4P2O7·10H2O,式量446.05。无色透明晶体,在干燥空气中易风化,易溶于水,不溶于醇,水溶液呈碱性,100℃时失去结晶水。用做分析试剂、软水剂、分散剂和乳化剂,制洗衣粉。用无水磷酸氢二钠在550-600℃灼烧可制得本品的无水盐。反应式

[四硼酸钠]化学式Na2B4O7·10H2O,式量381.37。别名硼酸钠、硼砂,无色单斜晶体,密度1.73克/厘米3,60℃失去8个结晶水,75℃溶于结晶水中,320℃失去全部结晶水。无水物密度2.367克/厘米3,熔点741℃,沸点1575℃。易溶于水,水溶呈碱性。不溶于醇或酸。可用做分析试剂、缓冲剂、防腐剂、金属助熔剂。用以制造化学玻璃、珐琅、瓷釉、人造宝石、焊药,还可用做清热解毒药物,配制照像用药液。主要由天然硼砂矿物中提取。
[硅酸钠]别名偏硅酸钠,化学式Na2SiO3,式量122,无色晶体或白色粉末,不溶于醇或酸,水溶液呈碱性,跟酸反应可析出硅酸胶状沉淀。它的透明粘稠溶液叫做“水玻璃”,可用做粘合剂、防火剂、肥皂及纸张中的填料。用石英砂和纯碱共熔制成,反应式

[亚硝酸钴钠]化学式Na3Co(NO2)6·H2O,式量412.94。黄色或橙黄色结晶粉末,易溶于水,微溶于乙醇,可水解,加入乙酸可抑制水解。是钾的微量分析试剂。用氯化钴跟亚硝酸钠反应制得。
[醋酸钠]学名乙酸钠,化学式CH3COONa·3H2O,式量136.08。无色透明晶体,密度1.45克/厘米3,58.3℃溶于结晶水,123℃时失去结晶水,无水物密度1.528克/厘米3,熔点324℃,易溶于水,水解,溶液呈弱碱性,稍溶于乙醇。用做分析试剂、媒染剂、缓冲剂、染料合成、影片洗印,肉类防腐等。用碳酸钠或氢氧化钠跟醋酸反应制取。
[钨酸钠]化学式Na2WO4·2H2O,式量329.86。无色或白色结晶粉末。在干燥空气中风化。易溶于水,水溶液呈弱碱性,不溶于醇。无水物熔点698℃。用做分析试剂、生物碱沉淀剂、织物的防水防火剂和制取金属钨及其化合物的原料。向20%NaOH溶液中加入过量的H2WO4,加热、过滤、蒸发、结晶制得本品。
[钼酸钠]化学式Na2MoO4·10H2O或Na2MoO4·2H2O,有两种结晶水合物。白色晶体,易溶于水。加热到100℃以上,可得无水钼酸钠。在酸性溶液中,有强的聚合倾向,可产生各种钼酸盐。用做化学分析试剂,也用以制颜料、医药。用氢氧化钠或碳酸钠溶液跟氧化钼反应后,过滤、浓缩、结晶即可制得。
[铀酸钠]化学式Na2UO4,式量348.01。橙黄色固体。不溶于水,溶于酸。用于制造荧光铀玻璃和陶瓷中的釉料,也用于制造其它铀化合物。
[铋酸钠]又称偏铋酸钠,化学式NaBiO3,式量279.97。黄色无定形粉末。不溶于水,在热水中水解,在酸性介质中有强氧化性。用来测定钢铁中的锰。三氧化二铋、氢氧化钠和次氯酸钠反应制得。
[苯甲酸钠]别名安息香酸钠,化学式C6H5COONa,式量144.11。白色颗粒或结晶粉末,易溶于水,微溶于醇,水溶液呈弱碱性。用做杀菌剂、防腐剂,制医药、染料,还用于植物遗传的研究。
[硫酸氢钠]化学式NaHSO4 ·H2O,式量138.07。无色晶体。有潮解性,易溶于水,水溶液呈强酸性。熔点58.54℃,315℃时分解,有腐蚀性。用做分析试剂,如矿物分析,还用做助熔剂。
[偏重亚硫酸钠]化学式Na2S2O5,式量190.1。白色结晶或粉末,有吸湿性,易溶于水和甘油,水溶液呈酸性,稍溶于乙醇。大于150℃分解。在空气中徐缓氧化成硫酸盐。用做分析试剂、防腐剂、还原剂。还用于染料合成、制药等。
[甲酸钠]化学式HCOONa·2H2O式量104.04。无色晶体,稍有甲酸气味。易溶于水和甘油,微溶于乙醇。熔点253℃(无水物),有毒。强热时分解为氢和草酸钠。用做化学分析试剂,以测定砷和磷的含量,还用作消毒剂、媒染剂等。用碳酸氢钠跟甲酸反应,使溶液保持碱性,除去Fe3+、过滤、在滤液中加入甲酸,使溶液呈弱酸性后,蒸发、结晶即得本品。
[重铬酸钠]别名红矾钠,化学式Na2Cr2O7·2H2O,式量298,浅黄红色单斜晶系针状或片状晶体,高于30℃时失去部分结晶水,84℃溶于结晶水,110℃完全转为无水物。无水物是橙红色粉末。比重为2.5,320℃熔融,有极强的吸水性,极易溶于水并形成具有酸性的橙黄色溶液。400℃时分解放出氧气。用做分析试剂、氧化剂和防腐剂等。还用于有机合成和电镀工业。将铬酸钠溶于少量水中,加硫酸后,蒸发、结晶、得到本品。
[钠汞齐]是钠和汞的合金,呈银白色,钠的含量在1%以下的汞齐为液体,含钠为1-2.5%者为面团状,含2.5%以上者为固体结晶。放置空气中,跟空气中的氧气和水反应,在表面上覆盖一层氢氧化钠薄膜。跟水反应,生成氢氧化钠放出氢气。钠汞齐比纯钠反应缓慢,用做还原剂,也用于制造氢气。将汞加热到150-200℃后加入钠,即可制得。
[苏打]见碳酸钠条。
[纯碱]见碳酸钠条。
[小苏打]见碳酸氢钠条。
[大苏打]见硫代硫酸钠条。
[海波]见硫代硫酸钠条。
[芒硝]见硫酸钠条。
[烧碱]见氢氧化钠条。
[苛性钠]见氢氧化钠条。
[硼砂]见四硼酸钠条。
[智利硝石]见硝酸钠条。
[水玻璃]见硅酸钠条。
[红矾钠]见重铬酸钠条。
[食盐]见氯化钠条。
[钾]元素符号K,原子序数19,原子量39.10,核外电子排布式1s22s22p63s23p64s1,位于第四周期第Ⅰ主族,银白色有金属光泽的金属,密度0.86克/厘米3,柔软,有延展性和导热、导电性,熔点63.65℃,沸点774℃。第一电离能为418.86千焦/摩尔,电负性0.8,化合价+1,化学性质活泼,在空气中跟氧气强烈反应生成K2O和过氧化钾K2O2,燃烧时有紫色火焰生成超氧化钾KO2,钾跟氢气在加热条件下生成氢化钾KH,钾跟卤素等非金属剧烈反应,跟水反应剧烈,生成氢气和氢氧化钾,同时燃烧,燃烧时有紫色火焰。钾同盐酸等剧烈反应,放出氢气,几乎达到爆炸程度。钾在自然界中主要以化合态存在,钾在地壳中的含量占第七位,在海水中钾元素的百分含量占第六位。1807年,英国化学家戴维在电解熔融氢氧化钾时发现了钾。工业上还用电解熔融的氯化钾或氢氧化钾来制钾,将钠蒸气通入熔融的氯化钾中,在高温下钠把钾从氯化钾中还原出来形成钠钾合金,钾的沸点比钠低,在分馏塔中把钾分离出来。反应式如下

钾在有机合成中用做还原剂。制电子管时常用钾来吸收真空管内剩余的氧气和水气。用钾来制钠钾合金,含77.2%钾和22.8%钠的合金熔点为-16.4℃,常温下为液态,有较高的热容,因此用它做核反应堆的冷却剂。
[氧化钾]化学式K2O,式量94.2。白色固体,密度2.32克/厘米3,350℃时分解。易潮解,易溶于水并跟水化合生成氢氧化钾,氧化钾是碱性氧化物。用钾还原过氧化钾或硝酸钾来制备。
2KNO3+10K=6K2O+N2↑
[过氧化钾]化学式K2O2,式量110.2。白色无定形固体。熔点490℃,高温下分解。易潮解,跟水反应生成氢氧化钾,放出氧气。溶于稀硫酸生成过氧化氢;过氧化钾能吸收二氧化碳并放出氧气。是强氧化剂。在熔融的氢氧化钾中通入氧气,即有K2O2生成,在真空中加热超氧化钾到460℃,也能制得过氧化钾。
[超氧化钾]化学式KO2,式量71.1。橙黄色晶体,熔点380℃。超氧化钾中含有超氧离子O-2,其中含有三电子键,稳定性比K2O2差,是强氧化剂。跟水剧烈反应,产生氧气和过氧化氢。
2KO2+2H2O=2KOH+O2↑+H2O2
超氧化钾跟二氧化碳反应,放出氧气。
4KO2+2CO2=2K2CO3+3O2↑
常用于急救用的呼吸面具中。钾在过量空气中燃烧可生成超氧化钾。
[氢化钾]化学式KH,式量40.1。白色固体,属于离子晶体,盐型氢化物,其中氢为H-离子。不稳定,加热不待熔化即分解,和水作用放出氢气。
KH+H2O=KOH+H2↑
钾在300-400℃的氢气流中生成氢化钾。
[氢氧化钾]化学式KOH,式量56.11。亦称苛性钾。白色固体,密度2.044克/厘米3,熔点360.4℃,沸点1320-1324℃。易潮解,极易溶于水并放出大量的热。有强腐蚀性。强碱性,可跟酸、酸性氧化物以及某些盐反应。在潮湿空气中易吸收二氧化碳、水蒸气生成碳酸钾。可用于制液体肥皂,制钾盐,也用于雕刻、电镀方面。工业上用电解氯化钾浓溶液或用碳酸钾跟石灰乳反应制取。
[氟化钾]化学式KF·2H2O,式量94.13。无色单斜结晶或白色结晶性粉末。可潮解,易溶于水,水溶液显碱性,不溶于醇。熔点41℃,能腐蚀玻璃和陶瓷,有毒。无水物熔点846℃,沸点1505℃,密度2.48克/厘米3。可用做分析试剂,如钽的微量分析。也可用做络合物的形成剂,掩蔽剂,细菌抑制剂,以及玻璃的浸蚀。在聚氯乙烯反应器中用氢氟酸跟碳酸钾反应来制备。
[氟化氢钾]化学式KHF2(或KH3F4),式量78.11。亦称酸式氟化钾,是氢氟酸的酸式盐。无色等轴晶系结晶,密度2.369克/厘米3。在干燥空气中较稳定,在潮湿空气中吸收水蒸气潮解,同时释放出氟化氢,有腐蚀性,加热到310℃即释放出氟化氢。电解熔融的氟化氢钾可得到氟。工业上用于制氟,雕刻玻璃,或用做防腐剂。用碳酸钾或氢氧化钾跟适量的氢氟酸反应,经浓缩、结晶即得。向饱和的氟化钾溶液中通入氟化氢也能制取。
[氯化钾]化学式KCl,式量74.55。无色等轴系晶体(常呈长柱状),密度1.984克/厘米3,在空气中稳定,熔点770℃,沸点1417℃。易溶于水,不溶于无水乙醇。农业上用做钾肥,但在盐碱地或对马铃薯、番薯、甜菜、烟草等忌氯农作物不宜施用,工业上常用它制钾和钾的化合物。医疗上用它防治缺钾症。分离光卤石可制得。
[溴化钾]化学式KBr,式量119.02。无色等轴有光泽晶体,密度2.756克/厘米3,熔点734℃,沸点1435℃,有潮解性,易溶于水。有咸味,见光颜色变黄,能溶于醇和甘油。用做分析试剂,制备摄影用感光乳剂,医药上用做神经镇静剂。用碳酸钾溶液跟溴化铁溶液反应,过滤、蒸浓、结晶即得。
[碘化钾]化学式KI,式量166.01。无色或白色立方晶体或粉末,密度3.13克/厘米3,熔点681℃,沸点1330℃,极易溶于水、醇、丙酮和甘油,不溶于醚。微有潮解性,久置或见光可变黄。应防潮、避光保存。碘化钾是常用的分析试剂,可用来配制照像用的感光乳剂,医药上用它防治甲状腺肿大症和祛痰药。用碳酸钾跟氢碘酸或碘化亚铁溶液反应制备。
[硫化钾]化学式K2S·5H2O,式量200.33,无色透明或浅黄色结晶。有潮解性。在空气中能逐渐氧化变质。溶于水,水溶液显碱性,溶于乙醇和甘油,不溶于醚。60℃时溶于结晶水中,无水物熔点840℃,密度1.805克/厘米3。应密封保存。多用于分析试剂,可用于脱毛剂、杀虫剂、制药工业。
[硝酸钾]化学式KNO3,式量101.10。无色晶体或白色粉末,密度2.109克/厘米3,熔点333℃,在400℃时分解成亚硝酸钾和氧气。有潮解性,易溶于水,微溶于醇。与有机物接触摩擦或撞击能引起燃烧和爆炸。常用做分析试剂、氧化剂、化学肥料。用以配制黑火药,制取钾盐。有天然产物,也可用硝酸钠和氯化钾的混合饱和溶液分步结晶、重结晶制得。
[亚硝酸钾]化学式KNO2,式量85.1,白色或浅黄色粒状结晶。有潮解性,密度1.92克/厘米3,熔点440℃,易溶于水,水溶液呈碱性。与有机物接触摩擦或撞击,能引起燃烧或爆炸。应防潮、避光,密封保存。用做分析试剂、有机合成、钢铁试剂。工业上将亚硝酸钠和碳酸钾溶液混合,利用碳酸钠的溶解度比亚硝酸钾小的特性蒸发溶液,分步结晶,即得亚硝酸钾。
[硫酸钾]化学式K2SO4 ,式量174.27。无色菱形晶体,密度2.66克/厘米3,熔点1069℃,易溶于水而不溶于乙醇。用做分析试剂、肥料、药物。可用以制钾盐,制玻璃。用硫酸跟氯化钾或氢氧化钾反应制得。
[亚硫酸钾]化学式K2SO3,式量158.25。白色晶体或粉末。易溶于水,微溶于醇。在空气中逐渐被氧化成硫酸盐,遇稀酸分解放出二氧化硫。应密封保存。可做印染工业的还原剂,照像用显影液或定影液的保护剂,羊毛、蚕丝的漂白剂,有机合成的加成剂等。将二氧化硫通入碳酸钾溶液即可制得。
[碳酸钾]化学式K2CO3,式量138.21。白色结晶粉末,密度2.428克/厘米3,熔点891℃,在潮湿空气中潮解,易溶于水,水溶液呈碱性。用做分析试剂,熔融硅酸盐和不溶性硫酸盐时的助熔剂,还可做制硬质玻璃、钾肥皂、钾化合物的原料。农业上用做钾肥。可从草木灰浸液中提取。
[碳酸氢钾]化学式KHCO3,式量100.119。无色单斜晶系晶体,密度2.17克/厘米3,在空气中稳定,能溶于水,水溶液有极弱的碱性,难溶于乙醇中。100℃时KHCO3分解生成K2CO3、H2O和CO2。用做分析试剂。向KOH的80%酒精溶液中通入CO2,可制得极纯的碳酸氢钾。
[磷酸钾]化学式K3PO4·7H2O或K3PO4·3H2O,前者式量为338.37,后者为266.31。白色结晶,有潮解性。易溶于水,水溶液呈碱性,不溶于乙醇。用做分析试剂,硬水软化剂,制造液体肥皂,用做肥料。在磷酸氢钾溶液中加入氢氧化钾溶液,结晶制得。
[磷酸氢二钾]化学式K2HPO4·3H2O,式量228.22。无色片状或针状晶体或白色颗粒。有潮解性,易溶解于水,水溶液呈弱碱性,易溶于乙醇。密度2.33克/厘米3,灼烧后生成焦磷酸钾K4P2O7。用做分析试剂、缓冲剂、制药原料。让磷酸跟碳酸钾溶液反应,再加入少量KOH至溶液使酚酞呈玫瑰红色时,蒸发结晶制得。
[磷酸二氢钾]化学式KH2PO4,式量136.09。无色柱状晶体或白色粉末。易溶于水,水溶液显弱酸性。不溶于乙醇。熔点252.6℃熔成无色透明液体,冷却后变为不透明的玻璃状物质偏磷酸钾
KH2PO4=KPO3+H2O
用做分析试剂、缓冲剂、制药原料,还用于制压电元件、电光学元件。让磷酸跟氢氧化钾或碳酸钾在溶液中反应到呈弱酸性时,蒸发、结晶制得本品。
[氯酸钾]化学式KClO3,式量122.55。无色带珠光的小片,或为六角的单斜晶系晶体。在空气中稳定,溶于水,水溶液呈中性。密度2.34克/厘米3。溶于50%乙醇。熔点356℃。加热到400℃时分解出氧气和氯化钾,是很强的氧化剂。跟硫、磷等接触摩擦或撞击发生爆炸。用做分析试剂、强氧化剂,实验室制氧气,用以制发令纸、火柴、烟火、医药、消毒剂等。氯酸钠跟氯化钾溶液混合,利用KClO3和NaCl的溶解度受温度变化的影响不同分步结晶制得。
[高氯酸钾]化学式KClO4,式量138.56。无色透明菱形晶体,密度2.52克/厘米3,溶于水,不溶于乙醇。别名过氯酸钾。在610℃左右熔融,同时分解为KCl和O2。与有机物、磷、硫等接触、摩擦或撞击,能引起燃烧和爆炸,是一种强氧化剂。用做分析试剂和氧化剂。KCl跟NaClO4溶液混合,利用KClO4比NaCl的溶解度受温度变化的影响不同,分步结晶析出KClO4。
[高锰酸钾]化学式KMnO4,式量158.03。俗名灰锰氧。黑紫色的菱形晶体,有金属光泽,密度2.7克/厘米3。溶于水,易溶于甲醇,丙酮中。遇乙醇即分解。高于240℃时分解,生成锰酸钾、氧气和二氧化锰。跟甘油、蔗糖、樟脑等混合,可引起燃烧或爆炸,是强氧化剂。用于钡、银、硫酸盐的微量分析,铁、钒、锡的测定,氧化-还原的滴定等。还用做氧化剂,消毒杀菌剂和有机物的合成等。将软锰矿跟氢氧化钾共熔得锰酸钾,再将它溶于碱性溶液中电解制得。
[锰酸钾]化学式K2MnO4,式量197.14。绿色细小菱形晶体,溶于水形成不稳定的溶液,在酸性溶液中易被空气中的氧气氧化成高锰酸钾。190℃时分解,有较强氧化性,用做氧化剂、媒染剂、消毒剂等。用熔融的氢氧化钾或碳酸钾跟二氧化锰反应制取,或用高锰酸钾饱和溶液跟氢氧化钾溶液混和共煮、结晶、制备。
[氰化钾]化学式KCN,式量65.12。无色立方晶体或白色粒状粉末。密度1.52克/厘米3,熔点634.5℃。有剧毒。易溶于水,水溶液显碱性。稍溶于乙醇,溶于甘油。易潮解,吸收空气中的水分和二氧化碳,逐渐分解放出苦杏仁气味。在空气中或者加入氧化性强的金属氧化物熔融时,氰化钾即吸收氧生成氰酸钾KCNO。氰化钾水溶液长期储存或加热至沸腾时生成甲酸钾并放出氨
KCN+2H2O=NH3↑+HCOOK
[硫氰酸钾]别名硫氰化钾,化学式KSCN,式量97.18。无色晶体,有潮解性,密度1.886克/厘米3,易溶于水并急剧降温。还易溶于酒精和丙酮。熔点173℃。加热到430℃时变蓝,冷却后重新变为无色。500℃时分解。用做分析试剂,致冷剂,还用于制医药和照像业。硫氰酸铵溶液跟氢氧化钾溶液混合共热,除氨后结晶制得本品。
[铁氰化钾]俗名赤血盐,化学式K3[Fe(CN)6],式量329.25,深红色晶体或黄色粉末,有毒。密度1.85克/厘米3,溶于水,不溶于乙醇。见光或在水溶液中都不稳定,加热时分解。在碱性介质中是强氧化剂。铁氰化钾跟稀硫酸混合加热时即分解放出剧毒的氢氰酸。和浓硫酸作用时放出一氧化碳。跟亚铁盐溶液反应时可生成蓝色沉淀。用于印染、电镀、制革工业,也用于制颜料、晒蓝图等。还用于测定锌的试剂、无机络合物的合成、影片洗印等方面。将氯气通入亚铁氰化钾溶液中可制得本品。
[亚铁氰化钾]俗名黄血盐,化学式K4[Fe(CN)6]·3H2O,式量422.41。浅黄色单斜晶体。常温下稳定。密度1.88克/厘米3,加热至100℃即失去结晶水变成白色固体。强热分解放出氮气并生成氰化钾和碳化三铁。能溶于水而不溶于乙醇和乙醚中。水溶液长期放置则逐渐分解,在日光下分解更快。亚铁氰化钾溶液跟铁的盐溶液反应生成普鲁士蓝沉淀,跟亚铁盐溶液反应生成红褐色沉淀。用于钯、银、锇、铀的点滴分析,照相用的显影剂,还可用以制颜料。亚铁氰化钾在有酸或酸性盐存在,特别在加热时,则分解放出剧毒的氢氰酸。亚铁氰化钙溶液跟碳酸钾溶液共热,浓缩结晶即得。
[硫酸铬钾]别名铬矾。化学式KCr(SO4 )2·12H2O,式量499.39。黑紫色有光泽的结晶或浅紫色颗粒或粉末。溶于水,溶液凉时为紫色。热时为绿色,不溶于醇。有毒。89℃熔于结晶水。用于分析试剂,照像制版。
[铬矾]见硫酸铬钾条。
[铬酸钾]化学式K2CrO4,式量194.20。黄色斜方晶体,密度2.732克/厘米3,熔点968.3℃。溶于水成深黄色溶液,溶液中性,不溶于酒精及乙醚中。性毒。有氧化性。水溶液中加入硫酸后溶液变成橙红色,这是由于生成了重铬酸钾的原故
2K2CrO4+H2SO4 =K2CrO7+K2SO4 +H2O
铬酸钾加热变成红色,冷却后又重新变为黄色。用做氧化剂,媒染剂和金属防锈剂。还用于银、钡等的微量分析、鞣革、制药等。把磨细的铬铁矿跟氢氧化钾、石灰石一起煅烧后,再加入硫酸钾溶液,便可制得铬酸钾。
[重铬酸钾]化学式K2Cr2O7,式量294.18。别名红矾钾。红色单斜或三斜有光泽的晶体。密度2.676克/厘米3,熔点398℃,溶于水,水溶液显酸性,不溶于乙醇。500℃分解,生成铬酸钾和三氧化二铬。有强氧化性,是重要的氧化剂。跟有机物接触摩擦或撞击能燃烧或爆炸。在冷溶液中可以氧化硫化氢、亚硫酸、碘化氢和亚铁离子等。加热时可氧化盐酸、氢溴酸,在这些反应中重铬酸钾被还原成三价铬离子。饱和的重铬酸钾溶液和浓硫酸的混合物叫做铬酸洗液,实验室中用于洗涤化学玻璃器皿。用它做基准试剂、氧化剂、氧化还原滴定剂、微量分析中测定氯的含量,制颜料,还应用于有机合成、鞣革、电镀等。重铬酸钠跟硫酸钾或氯化钾溶液混合反应后分步结晶,可制得本品。
[过硫酸钾]别名过二硫酸钾。化学式K2S2O8,式量270.33。无色或白色细小的三菱形晶体,慢慢结晶时为大片晶体。密度2.48克/厘米3。溶于水,水溶液显酸性,不溶于乙醇。加热低于100℃时即开始放出氧气。跟某些金属盐溶液反应时,K2S2O8即分解为H2SO4 、K2SO4 及O2,这些能形成过氧化物的金属(如Mn、Ni、Co、Pb等)在有碱存在下能形成黑色过氧化物沉淀。有强氧化性。用做分析试剂、强氧化剂、塑料引发剂、影片洗印等。还可用做漂白剂、防腐剂。由电解硫酸钾的浓溶液或由过硫酸铵跟碳酸钾溶液反应制取。
[草酸钾]别名乙二酸钾。化学式K2C2O4·H2O,式量184.22。无色晶体或白色晶体粉末。在干燥空气中易风化,密度2.08克/厘米3,在160℃时失去结晶水,变为不透明物。饱和溶液有弱碱性。用做分析试剂,防止血液凝固,还用于制药工业和影片洗印等。将碳酸钾放入草酸热溶液中至溶液对酚酞显弱碱性时,结晶即可制得。
[碘酸钾]化学式KIO3,式量214.01。无色、无光泽或乳白色等轴晶体,密度3.89克/厘米3,易溶于水而不溶于乙醇,水溶液显中性。熔点560℃(部分分解),温度更高时,分解生成碘化钾和氧气。碘酸钾有强氧化性,是强氧化剂,跟有机物混合经撞击即行爆炸。用做分析试剂、基准试剂、氧化剂、氧化还原滴定剂等。由氯酸钾跟盐酸及碘反应先制成酸式碘酸钾KIO3·HIO3;再使之跟氢氧化钾溶液反应,即可制得。
[溴酸钾]化学式KBrO3,式量167。无色结晶或粉末。溶于水,微溶于乙醇。密度3.24克/厘米3。在434℃时熔融并分解为溴化钾和氧气。有强氧化性,干燥的溴酸钾能使某些有机物(如酒精、甘油等)燃烧。用做分析试剂,氧化剂等。电解溴化钾的热溶液可制得本品。
[氰化金钾]别名氰金酸钾。化学式KAu(CN)4,式量340.14。无色或微黄色晶体,易溶于水,微溶于乙醇,有毒,用于镀金。
[氯铂酸钾]化学式K2PtCl6,式量486。橙黄色晶体或粉末。微溶于水,不溶于乙醇。熔点250℃(分解)。用于分析试剂,催化剂,电镀业。
[赤血盐]见铁氰化钾条。
[黄血盐]见亚铁氰化钾条。
[硫氰化钾]见硫氰酸钾条。
[硝石]见硝酸钾条。
[苛性钾]见氢氧化钾条。
[红矾钾]见重铬酸钾条。
[过氯酸钾]见高氯酸钾条。
[过二硫酸钾]见过硫酸钾条。
[过锰酸钾]见高锰酸钾条。
[灰锰氧]见高锰酸钾条。
[山奶钾]见氰化钾条。
[乙二酸钾]见草酸钾条。
[铷]元素符号Rb,原子序数37,原子量85.47,核外电子排布式1s22s22p63s23p63d104s24p65s1,在周期表中位于第五周期ⅠA族。原子金属半径247.5皮米(Pm),离子半径147皮米,第一电离能405千焦/摩尔,电负性0.8,主要氧化数+1。银白色有金属光泽,质软,硬度为0.3,密度为1.532克/厘米3(固),1.475克/厘米3(液),熔点38.39℃,沸点688℃,电导性7.7。化学性质极活泼,在空气中很快形成氧化层而失去光泽并自燃生成深棕色的超氧化物RbO2。臭氧跟氢氧化铷反应可生成臭氧化铷,铷跟氯气或溴猛烈反应燃烧形成火焰,不跟氮气反应。铷跟水剧烈反应并发生爆炸,跟温度低于-100℃的冰也能发生剧烈的反应,生成氢气和氢氧化铷。跟氢气化合生成氢化铷。它是碱金属氢化物中最不稳定的一种,加热不待熔化即行分解,铷平时保存在煤油里。铷的蒸气在180℃时显绛红色,高于250℃时则变为橙黄色。铷有优异的光电性能,铷原子受光的照射时会激发释放出电子,利用这种特性,可把铷喷镀在银片上,制成光电管,广泛应用于电影、电视、自动控制设备中。由于铷能强烈地跟氧气化合,制造真空管时用做吸氧剂。铷汞齐用做催化剂。有些铷的化合物用于医药。1861年德国的本生和基尔霍夫,用光谱分析的方法从云母提取物中发现了铷,并根据谱线的颜色命名为铷(原意是暗红)。铷在自然界很少,而且分散,海水中含量较多,用重结晶法从海水中提取氯化铷。可用电解熔融氯化铷的方法制备铷,但有危险,工业上主要用钙或镁在700-800℃和真空条件下还原氯化铷制取铷

铷的沸点比钙低,便于分离收集。
[铯]元素符号Cs,原子序数55,原子量132.9,外围电子层排布6s1,原子半径265.4皮米,离子半径167皮米,第一电离能371千焦/摩尔,电负性0.7,主要氧化数+1,银白色金属,质软而轻,密度1.8785克/厘米3,硬度0.2,电导性4.8。在自然界中铯是碱金属里最活泼的,能跟氧剧烈反应生成多种氧化物的混和物,在空气中常温下铷能自燃,生成红黄色晶体超氧化铯CsO2,铯不跟氮反应,可在高温下跟氢气化合生成较稳定的氢化物CsH,跟卤素能剧烈反应生成稳定的卤化物。不仅在常温下,甚至温度低到-116℃时铯跟水都可发生爆炸性的反应,生成氢氧化铯和氢气。氧化铯跟水反应时燃烧甚至爆炸,生成氢氧化铯。铯对光特别灵敏,光照射下,铯容易释放出电子,因此,铯单质主要用于制造光电管、摄谱仪、闪烁计数器、电子管、红外信号灯、以及光学自动控制仪器,还用于电子管的吸氧剂。医疗中用铯盐做药物。同位素铯-137,可用来治疗癌症。1860年德国本生和基尔霍夫在对矿泉的提取物进行光谱实验时,发现了铯,并根据谱线的颜色命名为铯(原意是天蓝)。铯在自然界分布少而分散,主要有氯化铯存在于海水或光卤石中,主要矿物有铯榴石、绿柱石等。工业上用镁或钙在700-800℃和真空条件下还原氯化铯制取铯

加热叠氮化铯CsN3也可分解生成铯。
[钫]化学符号Fr,原子序数87,原子量223,外围电子层排布7s1,位于第七周期ⅠA族。是放射性元素,已知钫的同位素半衰期都很短,钫-223的半衰期最长仅有22分钟,其化学性质只能在痕量范围内研究,是最重最活泼的碱金属元素,盐类都是水溶性的。1939年法国佩里(女)首先从铀-235的蜕变产物中发现了钫的同位素钫-223,佩里为了纪念她的祖国,命名该元素为钫(原意法兰西)。
[氢]元素符号H,原子序数1,原子量1.0079,核外电子排布式为1s1,氢的电离能为1306.47千焦/摩尔,电负性为2.1。氢在元素周期表中位于第一周期第Ⅰ主族或第Ⅶ主族。氢在自然界中有三种同位素,氕、氘、氚,其中氢-1(1H,氕)相对丰度为99.985%,氢-2(2H,氘也叫重氢)相对丰度为0.016%,这两种氢是在自然界中稳定的同位素。从核反应中还找到质量数为3的同位素氢-3(3H,氚,也叫起重氢),它在自然界中含量极微。氢在自然界中主要以化合物存在,其中以水和碳氢化合物为主,在大气中含量极微(体积百分比为5×10-5%),在地壳里的丰度为0.76%。根据光谱分析在太阳和某些星球的大气中含有大量氢气。1776年,英国化学家卡文迪许用金属跟酸作用时发现了氢。氢原子是结构最简单的原子。氢是元素中最轻的元素。氢气的分子式为H2,氢气在通常状况下为无色、无气味的气体,氢气的密度为0.0899克/升,液氢的密度为0.070克/厘米3,熔点-259.14℃,沸点-252.4℃,氢气是最轻的气体(密度最小),微溶于水(0℃时,每体积水溶解0.0214体积氢气)。氢气有最大的扩散速度,容易通过各种细小的空隙,如钢板。高扩散速度使氢气有高导热性。用氢气冷却物体比用空气冷却约快6倍。氢分子通过电弧或高温,都能离解成氢原子,氢原子在金属表面很快又结合成氢分子,同时放出大量的热,形成氢原子火焰,温度可高达3500℃。
氢气有可燃性,它在空气中燃烧生成水并放出大量的热,当空气中含4.1-75%(体积百分比)氢气时,点火则发生爆炸。氢气跟氧气按一定比例混和时即得爆鸣气,因此,点燃氢气前必须检验氢气的纯度,保证安全。氢气可以跟氟、氯、溴、碘、硫、氮等很多非金属化合生成气态氢化物,其中氢为+1价。氢气还能跟一些碱金属、碱土金属化合生成固态金属氢化物如:LiH、NaH、KH、CaH2、BaH2等,在这些化合物中氢为-1价。这些氢化物属于离子型化合物。氢气有还原性,在一定温度下,氢气可以从某些金属氧化物或非金属氧化物中夺取氧。用氢气可使氧化钨还原为金属钨。在一定温度下,也可从某些金属氯化物或非金属氯化物中夺取氯,使金属或非金属还原出来。氢气还可跟不饱和烃及其衍生物发生加成反应。钯和某些合金如LaNi5等能大量“吸收”氢气,在一定条件下氢气又可以被释放出来,因此钯和这些合金可用做氢气的储运材料。
氢气或氢氦混和气体可用来充填气球,氢气可用来制燃料电池,液氢和液氧可用做火箭的高能燃料,氢原子焰可用来焊接金属。利用氢气的还原性可用来冶炼金属或制纯硅。氢气是重要的化工原料,可用于合成氨、合成盐酸以及有机合成等。
氢气可用下列几种方法制取。(1)电解氢氧化钠水溶液,制得的氢气纯度较高(99.9%);(2)甲烷转化法,甲烷和水蒸气在高温和镍、钴催化作用下转化成氢气和一氧化碳;(3)水煤气法,用焦炭在高温下跟水蒸气反应;(4)离子型金属氢化物如氢化钙跟水反应;(5)用过渡金属络合物做催化剂,利用太阳能分解水制取氢气是发展氢能源的方向;(6)在实验室中常用锌跟稀硫酸或稀盐酸作用制取少量氢气。
[重氢]符号21H(或D),又名氘(音刀),是氢的同位素,质量数为2,原子核中有一质子和一中子。常温下为气体,分子式为D2,分子量为4。沸点-249.7℃,熔点-254.6℃,都高于氢气。
重氢(氘)的化学性质跟氢(氕)相似,但活动性较氢差,跟氧化合生成重水(D2O),与氮化合生成重氨(ND3)。重氢主要存在于重水中,氢气中含重氢约0.02%。重氢通常通过电解重水,或者通过重水跟锌、铁、钙等反应制得。分馏液态氢,氕先蒸馏出来,剩下氘。人工加速的重氢原子核(即由一个质子和一个中子组成的原子核-氘核)能参与许多核反应。重氢(氘)和超重氢(氚)在极高温度(如1亿K)可发生核聚变反应生成氦,同时释放出巨大能量。核聚变反应也叫热核反应。重氢是制造氢弹的核材料,也是可控热核反应的核燃料。
[超重氢]符号31H或T,原子核由一个质子和两个中子组成,质量数为3,是氢的唯一的放射性同位素。在通常状况下T2是气体,熔点-252.54℃,沸点-248.12℃。化学性质和氢(氕)相似,因为氚比氕重,所以氚的许多反应比氕要慢得多。氚能发射β粒子衰变成质量数为3的氦核,在衰变过程中不发射γ射线,半衰期为12.26年。氚和氘可发生热核反应,放出巨大能量。氚有放射性可用做研究化学反应过程和生物体中物质变化过程时的示踪原子。用高能氘核轰击氘化合物可得到氚。锂的同位素63Li吸收慢中子可产生氚。
[氕]氢的同位素,符号11H。原子核由一个质子组成,详见氢条。
[氘]氢的同位素,详见重氢条。
[氚]氢的同位素,详见超重氢条。
[水]分子式为H2O,水在地球表面上分布最广,约占地球表面的3/4,大气中含有水蒸气,土壤、岩石、动植物体中也含有大量的水,动物体中的水约占70%,新鲜植物体中的水分约占80-90%,地球上水的含量约有2×1018吨。
18世纪以前,人们认为水是一种单质,1781年英国化学家卡文迪许首先发现氢气在空气中燃烧生成的唯一产物是水,证明水是由氢、氧两种元素组成的化合物。几年以后,拉瓦锡测定了水的质量组成。近代结构理论证明,水分子呈V形结构。用X射线测定水的晶体(冰)结构,证明两个O-H键间形成104.5°的键角,由于水分子是不对称结构,故知水是极性分子。实验还证明,水分子通过氢键发生缔合,形成较复杂的分子集团,水沸腾时水蒸气中含有3.5%的双分子水(H2O)2,液态水中含有较复杂的(H2O)n分子(n可以是2、3、4…),这些较复杂的缔合水分子的化学性质和水(H2O)相同。
纯水是无色、无嗅、无味的液体,深层的天然水呈蓝绿色。水的热容为4.1868焦尔/克·度(1卡/克·度),在所有液态和固态物质中,水的热容最大。水在4℃时密度为1克/厘米3。在101325帕(1大气压)时,水的沸点为100℃,水的气化热为2.257千焦/克,凝固点是0℃。水是极弱的电解质,可发生自偶离解:
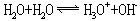
常温下,水的电离常数为1.8×10-16,水的离子积Kw=1×10-14。
水是较稳定的化合物,在1000℃以上才开始分解。在硫酸或氢氧化钠等存在条件下,电解水可生成氢气和氧气。许多活动性强的金属如K、Na、Ba、Ca等在常温下可跟水反应生成碱和氢气,Mg、Al在加热至水沸腾时跟水反应生成碱和氢气。水可跟许多较活动金属如锌、铁等在高温下反应生成金属氧化物和氢气。水可跟某些非金属反应,如:
2F2+2H2O=4HF+O2↑
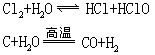
水可以跟许多碱性氧化物如K2O、Na2O、CaO、BaO、MgO等化合生成碱,水可以和多种酸性氧化物SO3、SO2、CO2、P2O5等化合生成相应的酸。水还能跟某些盐或酯、糖等有机物发生水解反应。
水是一种广泛应用的溶剂,极性物质(如HCl、NaCl等)容易在水中溶解。
[重水]化学式D2O,是氢的同位素重氢(氘)和氧的化合物。式量20.31。普通水中约含重水0.015%。重水是无色、无嗅的液体,密度是1.105克/厘米3,熔点3.82℃,沸点101.42℃。重水在原子核反应堆中用做中子的减速剂,也可用做制取重氢(氘)的原料。大量重水是以天然水为原料,通过电解、蒸馏、与硫化氢双重温度交换再电解等方法制取并富集的。
[双氧水]见过氧化氢条。
[过氧化氢]化学式H2O2,式量34。俗名双氧水。纯者为淡蓝色粘稠液体,密度1.465克/厘米3,熔点-0.41℃,沸点150.2℃。商品一般为30%的水溶液,医疗用3%的稀溶液做消毒剂,洗涤伤口。在过氧化氢分子中有一个过氧原子团-O-O-。每个氧原子各连结一个氢原子。常温时纯过氧化氢相当稳定,当加热到153℃以上时,纯过氧化氢即发生爆炸,分解生成水和氧气。过氧化氢及其水溶液经阳光照射或混有重金属离子(如Mn2+、Cu2+、Cr3+、Fe2+)时都能加速分解。过氧化氢中氧的氧化数是-1,它有向-2或0价态转化的两种可能性,因此,它既有氧化性又有还原性。过氧化氢在酸性介质或碱性介质中都是强氧化剂,它主要用做氧化剂;但若遇到更强的氧化剂时(如KMnO4),在酸性或碱性介质中,它即用做还原剂。纯过氧化氢可用作某种火箭的氧化剂和推进剂,纺织工业中用作漂白剂。可用硫酸或酸式硫酸盐电解氧化生成过硫酸或过硫酸盐,再经水解后制得;工业上还可以用乙基蒽醌法来制备过氧化氢。
[络合物]又称配位化合物。凡是由两个或两个以上含有孤对电子(或π键)的分子或离子作配位体,与具有空的价电子轨道的中心原子或离子结合而成的结构单元称络合单元,带有电荷的络合单元称络离子。电中性的络合单元或络离子与相反电荷的离子组成的化合物都称为络合物。习惯上有时也把络离子称为络合物。随着络合化学的不断发展,络合物的范围也不断扩大,把NH+4、SO24-、MnO-4等也列入络合物的范围,这可称作广义的络合物。一般情况下,络合物可分为以下几类:(1)单核络合物,在1个中心离子(或原子)周围有规律地分布着一定数量的配位体,如硫酸四氨合铜[Cu(NH3)4]SO4、六氰合铁(Ⅱ)酸钾K4[Fe(CN)6]、四羧基镍Ni(CO)4等,这种络合物一般无环状结构。(2)螯合物(又称内络合物),由中心离子(或原子)和多齿配位体络合形成具有环状结构的络合物,如二氨基乙酸合铜:

螯合物中一般以五元环或六元环为稳定。(3)其它特殊络合物,主要有:多核络合物(含两个或两个以上的中心离子或原子),多酸型络合物,分子氮络合物,π-酸配位体络合物,π-络合物等。
[配位化合物]见络合物条。
[中心离子]在络合单元中,金属离子位于络离子的几何中心,称中心离子(有的络合单元中也可以是金属原子)。如[Cu(NH3)4]2+络离子中的Cu2+离子,[Fe(CN)6]4-络离子中的Fe2+离子,Ni(CO)4中的Ni原子等。价键理论认为,中心离子(或原子)与配位体以配位键形成络合单元时,中心离子(或原子)提供空轨道,是电子对的接受体。
[配位体]跟具有空的价电子轨道的中心离子或原子相结合的离子或分子。一般配位体是含有孤对电子的离子或分子,如Cl-、CN-、NH3、H2O等;如果一个配位体含有两个或两个以上的能提供孤对电子的原子,这种配位体称作多齿配位体或多基配位体,如乙二胺:
H2N-CH2-CH2-NH2,三乙烯四胺:H2N-C2H4-NH-C2H4-NH-C2H4-NH2
等。此外,有些含有π键的烯烃、炔烃和芳香烃分子,也可作为配位体,称π键配位体,它们是以π键电子与金属离子络合的。
[络离子]见络合物条。
[内界]在络合物中,中心离子和配位体组成络合物的内界,通常写在化学式的[ ]内加以标示,如:
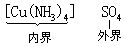
[外界]络合物内界以外的组成部分称外界。如[Cu(NH3)4]SO4中的SO24-离子。外界离子可以是阳离子,也可以是阴离子,但所带电荷跟内界络离子相反。在络合物中外界离子与内界络离子电荷的代数和为零。
[配位数]在络合单元中,一个中心离子(或原子)所能结合的配位体的配位原子的总数,就是中心离子(或原子)的配位数。如[Fe(CN)6]4-中,Fe2+是中心离子,其配位数为4,二氨基乙酸合铜(见络合物)中Cu2+是中心离子,它虽然与两个二氨基乙酸离子络合,但是直接同它络合的共有4个原子(2个N原子,2个O原子),因此C2+的配位数也是4。
[配位原子]配位体中具有孤对电子并与中心离子(或原子)直接相连的原子。
[单齿配位体]又称单基配位体,是仅以一个配键(即孤电子对)与中心离子或原子结合的配位体。如[Ag(NH3)2]+中的NH3分子,[Hgl4]2-中的I-离子,[Cu(H2O)4]2+中的H2O分子等。
[单基配位体]见单齿配位体条。
[多齿配位体]又称多基配位体,若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体。如乙二胺H2CH2-CH2-H2,乙二胺四乙酸酸根离子(EDTA):
[多基配位体]见多齿配位体条。
[螯合物]见络合物条。
[螯环]螯合物中所形成的环状结构。一般以五元环和六元环为稳定。
[螯合剂]能够提供多齿配位体和中心离子形成螯合物的物质。
[螯合效应]对同一种原子,若形成螯合物比单基配位体形成的络合物(非螯合物)要更加稳定,这种效应称作螯合效应。螯合物一般以五元环、六元环为最稳定,且一个络合剂与中心离子所形成的螯环的数目越多就越稳定。以铜离子Cu2+和氨分子及胺类形成的络合物为例:

[内轨型络合物]价键理论认为中心离子(或原子)和配位体以配位键结合,中心离子(或原子)则以杂化轨道参与形成配位键。若中心离子(或原子)以(n-1)d、ns、np轨道组成杂化轨道与配位体的孤对电子成键而形成的络合物叫内轨型络合物。如[Fe(CN)6]4-离子中Fe2+以d2sp3杂化轨道与CN-成键;[Ni(CN)4]2-离子中Ni2+以dsp2杂化轨道与CN-成键。内轨型络合物的特点是:中心离子(或原子)的电子层结构发生了变化,没有或很少有末成对电子,因轨道能量较低,所以一般内轨型络离子的稳定性较强。
[外轨型络合物]若中心离子(或原子)以ns、np、nd轨道组成杂化轨道与配位体的孤对电子成键而形成的络合物叫外轨型络合物。如[FeF6]3-离子中Fe3+以sp3d2杂化轨道与F-成键;[Ni(H2O)6]2+离子中Ni2+以sp3d2杂化轨道与H2O成键。有的资料把中心离子以ns、np轨道组成的杂化轨道和配位体成键形成的络合物也称作外轨型络合物,如[Zn(NH3)4]2+离子中,Zn2+以sp3杂化轨道与NH3成键。外轨型络合物的特点是:中心离子(或原子)电子层结构无变化,未成对电子数较多,因轨道能量较高,所以一般外轨型络合物的稳定性较差。
[低自旋络合物]含有较少的未成对电子的络合物,一般是内轨型络合物。这种络合物的中心离子的未成对电子数目,一般比络合前有所减少,如[Fe(CN)6]3-中,Fe3+离子在未络合前3d亚层有5个未成对电子:

而在此络离子中Fe3+离子的3d亚层上只有1个未成对电子:

[高自旋络合物]含有较多的未成对电子的络合物,一般是外轨型络合物。这种络合物的中心离子的未成对电子数目,在络合前后一般保持不变。如[FeF6]3-络离子中Fe3+离子仍含有5个不成对电子。
[络合平衡]溶液中存在的络离子(或络合分子)的生成与离解之间的平衡状态。例如:

当络离子的生成与离解达到平衡状态时,虽然两个相反过程还在进行,但它们的浓度不再改变。
[稳定常数]络合平衡的平衡常数。通常指络合物的累积稳定常数,用K稳表示。例如:


对具有相同配位体数目的同类型络合物来说,K稳值愈大,络合物愈稳定。
[逐级稳定常数]络合物的生成一般是分步进行的。对应于这些平衡也有一系列的稳定常数,每一步的稳定常数就是逐级稳定常数。例如,[Cu(NH3)4]2+的生成(或解离)分四步:

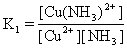

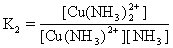
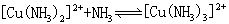
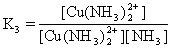


K1、K2、K3、K4就是[Cu(NH3)4]2+的逐级稳定常数,逐级稳定常数的乘积就是累积稳定常数。
K稳=K1·K2·K3·K4
lgK稳=lgK1+lgK2+lgK3+lgK4
[不稳定常数]络合物的不稳定常数用K不稳表示,与稳定常数成倒数

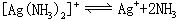
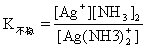
对具有相同数目配位体的同类型络合物来说,K不稳愈大,络合物愈易离解,即愈不稳定。
[络酸]外界离子是氢离子,在溶液中能电离产生氢离子而显酸性的络合物。如氯铂酸即六氯合铂(Ⅳ)酸H2[PtCl6]:
H2[PtCl6]→2H++[PtCl6]2-
[络碱]外界离子是氢氧离子OH-,在溶液中能电离产生OH-而显碱性的络合物。如氢氧化四氨合铜(Ⅱ)[Cu(NH3)4](OH)2:
[Cu(NH3)4](OH)2→[Cu(NH3)4]2++2OH-
[络盐]又称错盐,指含有络离子的盐类。例如K4[Fe(CN)6]、[Ag(NH3)2]Cl、[Cu(NH3)4]SO4等。络盐中的络离子,在溶液中较稳定,很难离解,这是络盐和复盐的重要区别。
[错盐]见络盐条。
[维尔钠配位理论]1893年由瑞士化学家维尔纳(Wer-ner)提出。其要点是:(1)一些金属的化合价除主价外,还可以有副价。例如在CoCl3·4NH3中,钴的主价为3,副价为4,即三个氯离子满足了钴的主价,钴与氨分子的结合使用了副价。(2)络合物分为“内界”和“外界”,内界由中心离子与周围的配位体紧密结合,而外界与内界较易解离。例如CoCl3·4NH3可写成[Co(NH3)4Cl2]Cl,内界是[Co(NH3)4Cl2]+,外界是Cl-。(3)副价也指向空间的确定方向。维尔纳的配位理论解释了大量的实验事实,但对“副价”的本质未能给以明确的解释。
[络合物的价键理论]络合物的化学键理论之一。其要点如下:(1)中心离子(或原子)提供空轨道,配位体提供孤对电子,以配位键结合。(2)中心离子(或原子)参与成键的空轨道都是杂化轨道,具有一定的饱和性和方向性。(3)中心离子(或原子)提供杂化轨道接受配位体的孤对电子形成配位键时,由于采用的能级轨道不同,形成的络合物分为外轨型和内轨型。若中心离子(或原子)以ns、np、nd轨道组成杂化轨道和配位原子形成配位键时,就叫外轨型络合物,如[FeF6]3-;中心离子(或原子)以(n-1)d、ns、np轨道组成杂化轨道和配位原子形成配位键时,则叫内轨型络合物,如[Fe(CN)6]4-。
[络合物的晶体场理论]络合物的化学键理论之一。是1923-1935年由培特(H.Bethe)和冯弗莱克(J.H.Van Vleck)提出了晶体场理论(CFT),本世纪50年代晶体场理论又发展成配位场理论(LFT)。晶体场理论的基本观点是:认为中心离子和配位体之间的相互作用是静电作用。它的要点如下:(1)中心离子原来简并的d轨道在配位体电场的作用下,发生了能级分裂,有的能量升高,有的能量降低。分裂后,最高能量d轨道和最低能量d轨道之间的能量差叫分裂能。中心离子的d轨道能量在正八面体场中的分裂如下图所示:

中心离子的d轨道能量在正四面体场中的分裂如下图所示:

(2)分裂能Δ值的大小,主要受配位体的电场、中心离子的电荷及它属于第几过渡系等因素的影响。(3)使本来是自旋平行分占两个轨道的电子挤到同一轨道上去必会使能量升高,这增高的能量称为成对能,用Ep表示。在弱配位场中Δ<Ep,d电子尽可能占据较多的轨道且自旋平行,形成高自旋络合物;在强配位场中Δ>Ep,d电子尽可能占据能量较低的轨道形成低自旋络合物。
[晶体场稳定化能]在晶体场理论中将d电子从未分裂的d轨道进入分裂的d轨道所产生的总能量的下降值,称为晶体场稳定化能(CFSE)。总能量下降愈多,即CFSE愈大(负值绝对值愈大),络合物就愈稳定。
[络合物的分子轨道理论]络合物的化学键理论之一。化学键的分子轨道理论的基本观点,在这里都是完全适用的。分析中心离子(原子)和配位体组成分子轨道,通常按下列步骤进行:(1)找出中心离子(原子)和配位体的价电子轨道,按所组成的分子轨道是σ轨道还是π轨道分组,分别称为σ轨道和π轨道。(2)将配位体中的σ轨道和π轨道分别重新组合成若干新轨道,这些新轨道称为群轨道,使得这些群轨道的对称性分别与中心离子(原子)的各原子轨道相匹配。(3)将对称性相同的中心离子(原子)的原子轨道和配位体的群轨道组合成分子轨道。络合物的分子轨道理论可以得到和晶体场理论一致的结果,同时又能解释光谱化学系列、有机烯络合物的形成、羰基络合物的稳定性等方面的问题。
[分散体系]即分散系。一种或几种物质分散在另一种物质里所组成的体系。分散体系中被分散的物质称为分散质或分散相;分散其它物质的物质称为分散剂或分散介质。按分散相微粒的大小,常把分散体系分为三种:真溶液、胶体、粗分散系。分散系的另一种分类法,是按聚集状态区分,可分为九类:

[分散剂]见分散体系条。
[分散介质]即分散剂。
[分散质]见分散体系条。
[分散相]即分散质。
[悬浊液]粗分散系的一种,是不溶性固体分散相以微小颗粒分散在液体物质中形成的分散体系。分散相微粒的线性大小在10-7-10-3米之间。悬浊液是不均一、不稳定的混和物。久置,固体分散相会沉淀下来,如泥水是悬浊液。
[乳浊液]粗分散系的一种,是互不相溶(或不完全相溶)的液体组成,液体分散相以微小珠滴分散在另一种液体物质中形成的分散体系。分散相的微粒的线性大小在10-7-10-3米之间。乳浊液通常分为两种类型:水包油型,以O/W表示;油包水型,以W/O表示。乳浊液是不均一、不稳定的混和物,久置会分层,如果加入乳化剂可增加其稳定性。
[溶液]物质以分子或离子的状态,均匀地分布在另一种物质中形成的分散体系。分散相的微粒是分子或离子,其线性大小在10-9-10-10米。溶液是均一、稳定的混和物,只要外界条件不发生变化(温度不变、溶剂没有蒸发),长久放置,溶质也不会析出。溶液又称分子溶液或真溶液。溶液有液态溶液(如蔗糖水、食盐水、碘酒等),固态溶液(如合金),气态溶液(如气体混和物)三种。
[溶质]溶液中被溶解的物质叫溶质。溶质可以是气体、液体、固体。通常当气体或固体溶解在液体中时,气体或固体是溶质。如液体溶于液体时,以量少者为溶质。
[溶剂]溶液中使其它物质溶解的物质叫溶剂。通常当气体或固体溶解在液体中时,液体为溶剂。如液体溶于液体,以量多者为溶剂。根据溶剂分子的特征,溶剂有极性溶剂(如水)和非极性溶剂(如汽油、苯、四氯化碳等)之分。
[溶解]溶质分散在溶剂中形成溶液的过程。物质溶解在水里,通常发生两种过程:一种是溶质分子(或离子)的扩散过程,这种过程吸收热量,是物理过程;另一种是溶质分子(或离子)和水分子作用,形成水合分子(或水合离子)的过程,这种过程放出热量,是化学过程。因此,在溶解过程中往往伴有热量、体积及颜色的改变。例如,硝酸铵溶于水吸热多于放热,溶液的温度降低;硫酸溶于水放热多于吸热,溶液的温度升高;白色的无水硫酸铜溶于水形成蓝色溶液;酒精和水混和溶液总体积减小。
[结晶]晶体从溶液(液态或气态)中析出的过程。结晶也是常用的提取或提纯物质的一种方法。结晶的方法主要有减少溶剂和降低温度两种。前者用于温度对溶解度影响不大的物质,如用蒸发的方法从海水中提取食盐;后者用于温度对溶解度影响较大的物质,如从氯化钠和硝酸钾的混和溶液中提取硝酸钾。
[母液]在化学结晶或沉淀的过程中,分离出结晶或沉淀后,残余的饱和溶液。
[晶种]在结晶过程中加入的预先制成的晶体微粒。
[相似相溶规律]当物质溶解在溶剂中时,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。例如碘分子I2是非极性分子,碘易溶于四氯化碳,因为CCl4分子也是非极性分子,碘在水中的溶解度就很小,因为H2O分子是极性分子。而氨在水中的溶解度就很大,因为NH3分子和H2O分子都是极性分子。相似相溶规律是从大量事实总结出来的经验规律,不能说明所有物质的溶解情况。这一规律可以由分子间作用力和化学热力学的原理加以说明。
[溶解平衡]一般指在一定条件(温度、压力)下,固体溶质在液体溶剂中溶解的速度与溶液中溶质结晶析出的速度相等时的状态。溶解平衡也是一种动态平衡。
[饱和溶液]在一定温度和压力下,达到溶解平衡时的溶液。饱和溶液中新加入的溶质不能继续溶解,已溶解的溶质也不会析出。
[不饱和溶液]在一定温度和压力下,小于该条件下饱和溶液浓度的溶液。在不饱和溶液中加入新的溶质能继续溶解。
[过饱和溶液]在一定温度和压力下,大于该条件下饱和溶液浓度的溶液。过饱和溶液是个不稳定体系。在过饱和溶液中加入溶质后,新加入的溶质不能溶解,已溶解的部分溶质也会析出。过饱和溶液被振荡或用玻璃棒摩擦器壁,溶液中过量的溶质也会结晶析出。通常,过饱和溶液是在较高温度下的饱和溶液中加过量溶质缓慢冷却后得到的,十水合硫酸钠、硼砂、硫代硫酸钠等易形成过饱和溶液。
[溶解度]在一定温度和压力下,物质在一定量溶剂中溶解的最高量(即达到饱和溶液状态时所溶解的量)。固体或液体物质的溶解度,通常以100克溶剂里所溶解溶质的最多克数来表示。气体物质的溶解度,则常用1体积(l毫升或1升)溶剂中所溶解溶质的最多体积数来表示。物质的溶解度除与溶质、溶剂的性质有关外,还与温度、压力有关。大多数固体或液体的溶解度随温度升高而增大,而气体溶解度随温度的升高而减小。压力一般对固体或液体的溶解度影响不大,而气体的溶解度却随压力增大而显著增大。
[溶液的浓度]一定量溶液或溶剂中所含溶质的量称为溶液的浓度。
[百分比浓度]即质量百分比浓度。用溶质的质量占全部溶液质量的百分比表示的溶液的浓度。溶液的百分比浓度用下式计算:

[体积比浓度]以液体试剂(原装)与溶剂体积之比来表示溶液浓度的方法。如将1体积原装的浓硫酸与5体积水混和得到的硫酸溶液浓度就是1:5,或记为(1:5)H2SO4。
[摩尔浓度]指体积摩尔浓度,以1升溶液里含有多少摩尔溶质来表示的溶液浓度。摩尔浓度的单位是摩尔/升或记成mol/l。摩尔浓度的计算公式是:
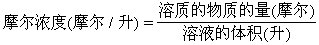
[质量摩尔浓度]以1千克溶剂中溶有多少摩尔溶质来表示的溶液的浓度,单位是摩尔/千克,或记成mol/kg。质量摩尔浓度的计算公式是:

如在1千克溶剂中溶有0.2摩尔的溶质,此溶液的浓度为0.2mol/kg。
[质量体积浓度]以每升溶液中含有多少克溶质来表示溶液浓度的一种方法。如某溶液的浓度为5克/升,表示1升此溶液中含有5克溶质。
[当量浓度]以1升溶液中所含某溶质的克当量数表示的浓度。当量浓度在分析化学计算中有一定的作用,常以N表示。
[ppm浓度]溶液的浓度用溶质质量占溶液质量的百万分之比来表示的叫ppm浓度,即每千克溶液中含溶质的毫克数。这种浓度表示方法常用于极稀的溶液(如植物生长刺激素溶液)或自然环境、食物中有害物质含量的表示。
[ppb浓度]溶液的浓度用溶质质量占溶液质量的十亿分之比来表示的叫ppb浓度,即每千克溶液中含溶质的微克数。这种浓度表示方法用于极稀的溶液和某些含量极低的物质。
[等渗溶液]指渗透压相等的两种溶液。如0.9%的生理盐水跟人体里的血液渗透压相等,它们是等渗溶液。
[胶体]即胶体分散系,指分散相微粒线性大小在10-3-10-7米的分散系,这时分散相微粒比单个分子大得多,是由许多分子或离子组成的集合体,分散相与分散介质存在着相界面。所以说,胶体分散系是一个高分散度的多相体系。
[液溶胶]又称溶胶或胶体溶液,指分散介质是液体的胶体。如Fe(OH)3胶体、AgI胶体、墨水等。
[气溶胶]指分散介质是气体的胶体。如雾、云、烟等。
[固溶胶]指分散介质是固体的胶体。如烟水晶、有色玻璃等。
[胶体粒子]指胶体中的分散相微粒,又称胶粒。以液溶胶的胶体粒子为例分析,胶粒由胶核和吸附层组成,如在KI过量时形成的AgI胶体,AgI是胶核;胶核吸附了I-离子,I-离子叫电位离子,溶液中的反号离子K+有一部分进入吸附层,称反离子;还有一部分反离子疏散地分布在胶粒周围形成扩散层,见下图:

胶粒与扩散层一起组成胶团。若在制备AgI胶体时,AgNO3过量则胶粒、胶团的构成是:

[高分子溶液]高分子化合物溶于适当的溶剂中可形成高分子溶液。高分子溶液具有双重性质,一方面由于这种分散相微粒大小与溶胶粒子相近,表现出溶胶的某些特性;另一方面高分子溶液是分子分散体系,又有某些真溶液的特点。高分子溶液和胶体溶液有许多不同之处:(1)高分子溶液是单相体系,胶体是多相体系。(2)高分子溶液分散相极易溶剂化,这是因为高分子化合物组成中,常含有大量亲水基团,如-OH、-COOH、-NH2等,而胶体微粒的溶剂化能力比高分子化合物弱得多。(3)高分子溶液中分散相微粒一般不带电荷,胶体微粒则是带电的,高分子溶液的稳定性是它的高度溶剂化起了决定性作用。(4)高分子化合物溶解的过程就是溶剂化过程,当用蒸发的方法除去溶剂后再加入溶剂仍能自动溶解,它的溶解过程是可逆的,而胶体中的胶粒一旦凝聚,一般很难或者不能用简单加入溶剂的方法使之复原。高分子溶液还有一项与真溶液和溶胶都不同的特性,就是有较大的粘度。
[丁达尔效应]当一束光线通过胶体溶液或高分子溶液时,因分散质微粒的散射作用,在入射光垂直方向,可看到一条明显的光柱,这种现象称丁达尔效应。由英国物理学家丁达尔(Tyndall)首先发现。
[布朗运动]1827年由英国生物学家布朗(Brown)发现,悬浮在水里的花粉小颗粒在不停地进行着不规则运动。这种现象叫布朗运动。溶胶中的胶体微粒也在进行布朗运动,这是由于周围分散剂的分子从各方面不均匀地撞击胶体微粒和胶体微粒本身的热运动造成的。布朗运动的速度取决于微粒大小、温度及介质的粘度,微粒越小、温度越高、介质粘度越小,布朗运动的速度越快。
[电泳]在外电场的作用下,胶体微粒向阳极(或阴极)作定向移动的现象。如三硫化二砷的胶体微粒带负电,会向阳极移动;氢氧化铁胶体微粒带正电会向阴极移动。电泳在工业生产、医疗诊断等方面都有重要的应用。
[渗析]又称透析。利用半透膜(膀胱膜、肠衣、羊皮纸、玻璃纸等)使溶胶和其中混有的离子或分子杂质分开的过程。将混有杂质的胶体放入有半透膜的装置内,并将此装置放在溶剂(如水)中,半透膜的细孔只能使离子或分子透过而不能使胶体微粒通过,这就可以使杂质离子和分子从溶胶中分离出来。应用渗析的方法可以精制某些胶体。
[半透膜]见渗析条。
[聚沉]又称胶体的凝聚。胶体具有一定的稳定性,在一定条件下,可以保存较长时间。但胶体是热力学不稳定体系,有自发聚结下沉的趋势,只要减弱或消除使胶体稳定的因素,胶体微粒就能聚集成较大颗粒而沉降。使胶体微粒聚集成较大的颗粒而沉降的过程叫聚沉。使胶体聚沉的方法主要有:加入电解质、加热、加入带相反电荷的胶体等。
[盐析]在大量电解质的作用下,使高分子化合物从溶液中析出的过程。例如往血清中加入(NH4)2SO4当浓度约为2.0摩尔/升时,其中球蛋白析出,当浓度为3-3.5摩尔/升时,血清蛋白析出。盐析可以看作是电解质对高分子溶液的聚沉作用,但盐析和溶胶聚沉有以下不同:(1)盐析时电解质的用量很大。(2)盐析结果生成的沉淀用溶剂加以冲淡仍可形成溶液。(3)离子的价数对盐析能力的影响程度不象溶胶聚沉那样显著。(4)盐析与离子电荷符号无关。
[胶凝]大分子溶液在一定条件下,粘度会逐渐变大,以致失去流动性而使整个体系变成一种弹性半固体的“冻”状,这个过程称胶凝。
[凝胶]胶凝过程中形成的“冻”状体系叫凝胶。
[高分子电解质]有些高分子化合物在溶液中可以离解成离子,称为高分子电解质。其中最重要的就是蛋白质。蛋白质的一个重要特点是,同时具有多个羧基-COOH(在水溶液中可以给出H+离子)和多个氨基-NH2(可接受H+离子),因此蛋白质是一种两性大分子电解质。如果蛋白质在水溶液中分子里的羧基给出的质子被氨基夺去,就形成同时带有正负电荷的两性离子。
[等电状态]蛋白质处于正、负电荷相等时的状态。
[等电点]蛋白质处于等电状态时的水溶液的pH值。一般蛋白质在等电点时pH都不等于7。蛋白质溶液的性质与pH有很大关系,在等电点时蛋白质最不稳定,因为等电状态时蛋白质微粒总电荷为零,水化程度低,容易合并,蛋白质的其它性质如渗透压、导电性、粘度等在等电点也表现得最低或最小。
[表面活性物质]能显著降低水的表面张力的物质称为表面活性物质或表面活性剂。表面活性剂的一般分类是分离子型和非离子型。离子型表面活性剂又有三种:(1)阴离子表面活性剂,如普通肥皂和洗衣粉(烷基磺酸盐)。(2)阳离子表面活性剂,如十八胺盐酸盐和十二烷基二甲基苄基氯化铵等。(3)两性表面活性剂,指同时具有阴离子和阳离子的表面活性剂,如氨基酸、氨基磺酸盐等。(4)非离子型表面活性剂指在溶液中不电离,不生成离子的表面活性剂,如聚乙二醇型表面活性剂。
[乳化剂]乳浊液(或称乳状液)的稳定剂。乳浊液是热力学不稳定体系,要使它稳定就必需加入乳化剂,其作用是在分散相液滴的表面上形成界面膜或双电层,可以阻止小液滴的相互凝结。很多乳化剂是表面活性物质,如各类肥皂;也有些乳化剂不是表面活性物质,如Al(OH)3、 SiO2、陶土及石墨等固体粉末,由于它们能在相界面形成较坚固的界面膜,也可以形成稳定的乳状液。
[土壤胶体]土壤中呈胶体状态的物体。土壤胶体分有机胶体(如腐植质)、无机胶体(粘土矿物,如铝硅酸盐及铁、铝的含水氧化物等)、有机无机复合胶体三种。土壤胶体具有很大的表面积、在溶液中带有电荷,并有吸收、膨胀、收缩、分散、凝聚、粘结、粘着和可塑等特点。有机胶体吸收性较强,无机胶体则粘结性、可塑性较强,各种胶体在土壤中的存在量,对土壤性状和肥力都有很大影响。
[电解质]溶于水或熔融状态下能导电的化合物。离子化合物和许多极性键化合物都是电解质。如酸、碱、盐等类物质。
[非电解质]一般系指在熔融状态或在水溶液中不能导电的化合物。非电解质都是共价化合物,大多数有机物及许多无机化合物,如非金属卤化物等。(但许多具有共价键的无机化合物溶于水则形成电解质溶液,如卤化氢。)
[电离]通常指电解质在水溶液中或熔融状态下,离解成阴、阳离子的过程。此外,气态分子或原子变为离子的过程也叫电离。
[强电解质]在水溶液中能完全电离的电解质。其水溶液具有较强的导电性,包括典型的离子键化合物及在水分子作用下能完全离子化的极性键化合物。强酸、强碱及大多数盐属于强电解质。
[弱电解质]在水溶液中只能部分电离的电解质称弱电解质。弱电解质在水溶液中,主要以分子状态存在,导电能力较弱,如弱酸、弱碱和几种汞盐及镉盐等。
[强酸]属于强电解质的酸类。如盐酸HCl、硝酸HNO3、硫酸H2SO4、高氯酸HClO4等。
[强碱]属于强电解质的碱类。如氢氧化钠NaOH、氢氧化钾KOH等。
[弱酸]属于弱电解质的酸类。如碳酸H2CO3、氢硫酸H2S、氢氰酸HCN等。
[弱碱]属于弱电解质的碱类。如一水合氨NH3·H2O、氢氧化铁Fe(OH)3等。
[电离平衡]在水溶液中弱电解质分子和离子间的平衡。例如醋酸的电离平衡:

[电离度]电离平衡时,在弱电解溶液中已电离的分子数占电离前分子总数的百分率。它可以表示弱电解质电离的程度,其算式如下:
电离度(a)=已电离的分子数电离前分子总数×100%不同的弱电解质,在相同浓度时,它们的电离度不同。电解质愈弱,电离度就愈小,因此,可用电离度表示弱电解质的相对强弱。同一电解质溶液,浓度愈小,电离度愈大。
[电离平衡常数]弱电解质在水溶液中存在电离平衡,跟化学平衡一样也可得到电离平衡常数,用Ki表示(弱酸的电离常数用Ka表示、弱碱的电离常数用Kb表示)。例如醋酸的电离平衡:

Ki的值与温度有关,而与浓度无关。一定温度下某弱电解质的Ki是定值,Ki越大表示电离程度越大。对同类型的弱酸或弱碱,比较其Ka或Kb值的大小,就可确定它们的相对强弱。如氢氟酸(HF)和氢氰酸(HCN)都是一元酸,前者电离常数Ka=6.5×10-4、后者的电离常数Ka=4.93×10-10,可知氢氟酸比氢氰酸强。
[阿累尼乌斯理论]即阿累尼乌斯电离学说。1887年由瑞典物理化学家阿累尼乌斯(Arrhenius)提出。其要点如下:电解质在水溶液中部分离解为自由移动的离子,即发生电离;溶液愈稀电离度愈大;电离过程是可逆的,分子电离成离子,离子又相互碰撞结合成分子,最后达到电离平衡。电离学说的提出揭示了电离平衡的实质,在此学说的基础上建立了酸碱理论。
[酸碱电离理论]阿累尼乌斯从他的电离学说的观点出发,把在水中能电离出氢离子的化合物称为酸,把在水中能电离出氢氧离子的化合物称为碱。如HCl、H2SO4、CH2COOH等都是酸;NaOH、KOH、Ca(OH)2等都是碱。根据这一理论,酸碱中和反应的实质就是酸电离产生的H+离子和碱电离产生的OH-离子,相互结合生成水的过程。如盐酸和氢氧化钠的中和
HCl+NaOH=NaCl+H2O
其离子方程式为:H++OH-=H2O
酸碱电离理论对化学科学的发展起了重大作用,但因把酸碱限制在水溶液中而有一定的局限性。以后酸碱理论又有了很大发展。
[稀释定律]对某弱电解质的稀溶液而言,此种弱电解质的电离度和溶液浓度的平方根成反比。其数学表达式为:

式中a为弱电解质的电离度,Ki为其电离常数,C为溶液的摩尔浓度。确切地说上式表达的只是一种近似关系。
[同离子效应]在弱电解质溶液中,加入与弱电解质具有相同离子的强电解质,而使弱电解质电离度减小的效应。例如浓度为0.1mol/l的醋酸(CH3COOH)溶液的电离度是1.33%,若加入醋酸钠(CH3COONa)晶体使溶液中醋酸钠浓度为0.1mol/l,此时醋酸的电离度降为0.018%。这是由于醋酸钠是强电解质在溶液中电离出大量的CH3COO-离子,使醋酸的电离平衡向形成醋酸分子一方移动的结果。在同离子效应发生的同时,也存在着盐效应(见盐效应),但盐效应对电离度的影响比同离子效应要小得多。
[盐效应]在弱电解质溶液中,加入其它强电解质盐时,使该弱电解质电离度增大的效应。例如0.1mol/l的醋酸溶液,醋酸的电离度为1.33%,若加入氯化钠,使溶液中NaCl的浓度为0.1mol/l,此时醋酸的电离度为1.68%。这是因为加入不含相同离子的强电解质,增大了溶液中离子的总浓度,使溶液中离子之间的相互牵制作用增强,离子结合为分子的机会减少,降低了分子化的速度,电离平衡向电离方向移动的结果。
在难溶电解质的沉淀溶解平衡体系中,加入可溶性强电解质而使沉淀进一步溶解的现象,也称为盐效应。
[水的离子积常数]简称水的离子积。纯水本身能够产生微弱的电离,存在着电离平衡:

对于纯净的水,其浓度为常数,因此Ki[H2O]也是常数,在298.15K时纯水中[H+]=[OH-]=1.004×10-7摩尔/升所以,在101325Pa,298.15K时
Kw=Ki[H2O]=[H+][OH-]=(1.004×10-7)2≈10-14
Kw即水的离子积。水的离子积反映了在一定温度下水中H+离子和OH-离子的浓度间的关系。在任何水溶液中,水和它的离子(H+,OH-)之间的平衡是一种非常重要的平衡。在稀溶液中水的浓度可近似地看成为常数(近似等于纯水的浓度55.55摩尔/升),故在任何一种稀溶液中H+离子和OH-离子的浓度关系都服从水的离子积常数公式,[H+][OH-]=10-14。通过Kw,已知H+离子(或OH-离子)的浓度,就可计算出OH-离子(或H+离子)的浓度。
[pH值]水溶液中H+离子浓度的负对数。即
pH=-lg[H+]
pH值在0-14之间。当[H+]=1摩尔/升时,pH=0;
[H+]=10-14摩尔/升时(此时[OH-]=1摩尔/升),pH=14;[H+]=[OH-]=10-7摩尔/升时,pH=7。根据pH值的大小可以判断溶液的酸碱性,pH=7是中性溶液,pH<7是酸性溶液,pH>7是碱性溶液。pH值通常用于表示浓度较小的溶液的酸碱度,当溶液中氢离子的浓度较大时,用pH值表示酸碱度反而不方便。
[缓冲作用]溶液能抵抗外加少量强酸、强碱或稀释的影响,而本身的pH值不发生显著变化的作用。
[缓冲溶液]能抵抗外加少量强酸、强碱或稀释的影响,而本身的pH值不发生显著变化的溶液。缓冲溶液有三种类型:弱酸及其盐(如HAc-NaAc)、弱碱及其盐(NH3·H2O-NH4Cl)、多元弱酸盐及其对应的次级盐(NaH2PO4-Na2HPO4),总之缓冲溶液由弱酸及其共轭碱组成(参见共轭酸碱条)。缓冲溶液具有缓冲能力的原因,以HAc-NaAc混和溶液为例:

NaAc=Na++Ac-
当加入少量酸时,体系中Ac-与加入的H+结合成HAc分子,而体系中[H+]无明显增加,Ac-为体系中抗酸部分;当加入少量碱时,体系中的HAc能与之中和,体系中[OH-]亦无明显增加,HAc为体系中的抗碱部份。缓冲溶液的pH值(或pOH值)可按下式计算:
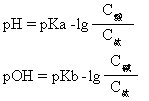
缓冲溶液的缓冲能力是有限的,一般说C酸(或C碱)和C盐的数值较大且浓度相近时能力最大,一般取C酸/C盐或C碱/C盐之值在0.1-10之间。缓冲溶液在工业、农业、医学、化学、生理学方面有重要用途,如土壤、人的血液中都有复杂的缓冲体系,从而保持一定的pH值,使植物正常生长,使人维持正常的生理活动。
[缓冲容量]衡量缓冲溶液缓冲能力的标准。通常指1升缓冲溶液的pH值改变1单位时所需加入强酸或强碱的摩尔数。缓冲容量的大小与缓冲溶液的总浓度及组分比有关,总浓度愈大,且缓冲组分的浓度比愈接近1∶1,缓冲容量愈大。
[盐类的水解]盐的离子与溶液中水电离出的H+离子或OH-离子作用产生弱电解质的反应。由于形成盐的酸和碱的强弱不同,各种盐类水解进行的程度也各有差别。强酸强碱盐不发生水解;弱酸强碱盐水解溶液显碱性;弱碱强酸盐水解溶液显酸性;弱酸弱碱盐水解程度较大,溶液的酸碱性取决于水解产物的相对强弱。
[水解度]在一定温度下,盐溶解在水中,已经水解的盐的浓度与盐的起始浓度的比值,算式如下(水解度用h表示):

水解度的大小,主要决定于盐的本性,同时也受浓度、温度等因素的影响。对于同一种盐的溶液,降低浓度或升高温度可增大水解度。水解平衡也服从化学平衡规律,因此在盐溶液中加入一种与水解产物相同的物质可抑制水解,降低水解度。
[水解常数]水解平衡也是一种化学平衡,其平衡常数即水解常数。例如:
NaAc(强碱弱酸盐)的水解常数:

NH4Cl(强酸弱碱盐)的水解常数:
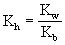
NH4Ac(弱酸弱碱盐)的水解常数:

以上各式中Kh为水解常数,Kw为水的离子积,Ka为弱酸电离常数,Kb为弱碱电离常数。
多元弱酸盐的水解,以Na2CO3为例,水解是分步进行的


(式中Kh1为第一步水解常数,K2为该酸的二级电离常数)


(式中Kh2为第二步水解常数,K1为碳酸的一级电离常数)。因为Kh2》Kh2,所以第一步水解是主要的。
水解常数与水解度有如下关系:弱酸强碱盐

弱碱强酸盐

弱酸弱碱盐
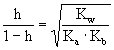
[酸碱质子理论]简称质子理论或质子论。1923年由丹麦的布朗斯特(Br nsted)和美国的劳莱(Lowry)提出。质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱。如HCl、NH+4、HSO-4等能给出质子,都是酸;Cl-、NH3、SO24-等能接受质子,都是碱。根据质子理论,酸和碱不是孤立的,它们存在着如下的关系:
nsted)和美国的劳莱(Lowry)提出。质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱。如HCl、NH+4、HSO-4等能给出质子,都是酸;Cl-、NH3、SO24-等能接受质子,都是碱。根据质子理论,酸和碱不是孤立的,它们存在着如下的关系:

这种对应关系叫共轭关系,称共轭酸碱对,右边的碱(B)是左边的酸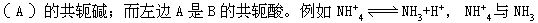 就是一对共轭酸碱。由此可见,质子论不是从组成上区分酸碱,而是看这种物质(分子或离子)在反应中对H+的授受关系。如HCO-3在HCO-3-CO23-的共轭关系中是酸,而在H2CO3-HCO-3共轭关系中是碱:
就是一对共轭酸碱。由此可见,质子论不是从组成上区分酸碱,而是看这种物质(分子或离子)在反应中对H+的授受关系。如HCO-3在HCO-3-CO23-的共轭关系中是酸,而在H2CO3-HCO-3共轭关系中是碱:

据质子理论,酸碱反应的实质就是两个共轭酸碱之间质子传递的反应,如HCl和NH3的反应:

酸碱质子理论,扩大了酸碱的范围,是酸碱理论的发展,可以把电离理论中的电离、中和、水解、同离子效应等都包括在酸碱反应的范围内,看作是质子传递的酸碱反应。
电离,酸碱在水溶液中的电离,可看成它们与水分子间的质子传递,例如:

在酸碱质子反应中,水既可以接受质子是碱,又可以给出质子是酸。
中和,电离理论中的酸碱中和也是质子传递作用:
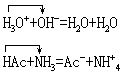
水解,质子理论中没有盐的概念,水解反应相当于质子理论中离子酸(或离子碱)与水之间的质子传递反应,例如:

[离子酸]酸碱质子理论中所说的酸(见酸碱质子理论),若是离子则称离子酸,若是分子则称分子酸。离子酸又分阳离子酸,如NH+4(NH+4=H++NH3);以及阴离子酸,如HCO-3(HCO-3=H++CO43)。
[离子碱]酸碱质子理论中所说的碱(见酸碱质子理论),若是离子则称离子碱,若是分子则称分子碱。离子碱又分阳离子碱,如Fe(OH)+2;以及阴离子碱,如CO23-。
[共轭酸碱]见酸碱质子理论条。
[路易斯酸碱理论]又称酸碱电子理论。1923年由美国化学家路易斯(G.N.Lewis)提出。其要点是:凡是可以接受电子对的物质称为酸,凡是可以给出电子对的物质称为碱。故酸又称为电子对接受体,碱又称电子对给予体。按照路易斯的观点,酸碱反应的实质是配位键的形成并生成酸碱络合物。例如:


路易斯酸、碱的范围非常广泛,酸碱络合物包含很多类物质。凡是金属离子及氢离子都是酸,与路易斯酸结合的物质不管是阴离子或中性分子都是碱。所以大多数无机化合物都可看成是酸碱络合物,许多有机化合物也是如此。酸碱电子理论以电子对的授受来说明酸碱反应,更能体现物质的本质属性。但由于对酸碱的认识过于笼统,没有统一的酸碱强度的标准,因而有一定的局限性。
[电子对接受体]见路易斯酸碱理论条。
[电子对给予体]见路易斯酸碱理论条。
[路易斯酸]见路易斯酸碱理论条。
[路易斯碱]见路易斯酸碱理论条。
[软酸]路易斯酸中具有体积大、正电荷少、易极化、易失去电子、易形成共价性较强的键的物质。如Cu+、Ag+、Hg22-、Cd2+等属于软酸。软酸易与软碱生成稳定的络合物,软酸不易与硬碱生成络合物,或生成的络合物不稳定。
[软碱]路易斯碱中,具有电负性小、易失去电子、其低能轨道不饱和、易形成共价性较强的键的物质,如I-、CN-、S2O23-等属于软碱。软碱易与软酸生成稳定的络合物,软碱与硬酸不易生成络合物,或生成的络合物不稳定。
[硬酸]路易斯酸中具有体积小、正电荷多、不易失去电子、不易极化、易形成离子性较强的键的物质,如Li+、Na+、Ca2+、Mg2+、Fe3+等属于硬酸。硬酸易与硬碱生成稳定络合物,硬酸与软碱不易生成络合物,或生成的络合物不稳定。
[硬碱]路易斯碱中具有电负性大、不易极化、不易失去电子,而且低能轨道已饱和、易形成离子性较强的键的物质,如H2O、Cl-、OH-等属于硬碱。硬碱易与硬酸生成稳定的络合物,硬碱与软酸不易生成络合物或生成的络合物不稳定。
[沉淀溶解平衡]在溶液中,难溶电解质的溶解过程与其相应的离子结合为沉淀的过程之间的动态平衡。此时溶液已达到饱和,这是难溶电解质的饱和溶液中离子与未溶固体物质间的多相平衡。如难溶电解质AgCl的沉淀溶解平衡:

[溶度积常数]即难溶电解质在水溶液中达到沉淀溶解平衡时的平衡常数。例如:
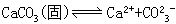
因CaCO3是固体,其浓度是一定值,平衡常数表达式为:
Ksp=[Ca2+][CO23-]
Ksp就是溶度积常数,简称溶度积,它表示在难溶电解质的饱和溶液中,有关离子浓度的乘积在一定温度下是个常数。根据溶度积常数值可比较同类型的难溶电解质溶解度的大小,溶度积越小溶解度也越小。
[溶度积规则]用溶度积概念判断在一定条件下,某难溶电解质在溶液中沉淀能否生成或溶解的规则。在某难溶电解质溶液中,其离子浓度的乘积称为离子积,用Qi表示。在给定的溶液中Qi可能有三种情况:
(1)Qi=Ksp是饱和溶液
(2)Qi<Ksp是不饱和溶液,无沉淀析出,若体系中已有固体存在,沉淀会溶解,直至饱和(Qi=Ksp)为止。
(3)Qi>Ksp是过饱和溶液,有沉淀析出,直至饱和。
以上就是溶度积规则。溶度积规则有一定的局限性,如形成的难溶固体很少(少于每毫升10-5克),或形成过饱和溶液以及产生副反应时,虽然Qi已大于Ksp,也观察不到沉淀的生成。
[分步沉淀]在含有几种离子的溶液中,加入一种沉淀剂,根据溶度积规则,对同类型的难溶化合物,Ksp小的先沉淀,Ksp大的后沉淀,这种先后沉淀作用叫分步沉淀。例如在0.1mol/l的Cl-和I-溶液中逐滴加入AgNO3溶液,先生成AgI沉淀,后生成AgCl沉淀。利用分步沉淀的原理可将两种离子分离。沉淀的先后顺序除跟溶度积有关外,还与被沉淀离子的起始浓度有关。
[强电解质理论]又称德拜-休格尔理论。是1923年由物理化学家德拜(Debye)和休格尔(Hückel)提出。其要点是:强电解质在溶液中是完全电离的,但溶液中离子间又存在着一定的静电相互作用,溶液中的离子都被具有相反电荷的离子所包围,形成“离子氛”,因而影响到离子的运动速度和溶液的性质。这一理论解释了强电解质完全电离而其表观电离度又不是100%的矛盾。
[德拜-休格尔理论]见强电解质理论条。
[离子互吸理论]见强电解质理论条。
[表观电离度]系指通过实验测得的强电解质的电离度。强电解质的电离度和弱电解质的电离度的意义不同,强电解质的电离度反映了溶液中离子间相互牵制作用的强弱程度。
[活度]指电解质溶液中表观上某离子的浓度,又称有效浓度或校正浓度。它与实际浓度的关系是:
a=r·c
式中a为某离子的活度,c为该离子的实际浓度,r为活度系数(也有用f表示的)。活度表明体系与理想状态的偏差。
[活度系数]溶液的实际浓度除活度所得之商。对于理想溶液,r=1,此时a=c,活度等于浓度。在一般情况下r<1,且随浓度而变化,溶液浓度愈大,离子之间的牵制作用愈强,活度与浓度之间的差距愈显著;溶液浓度愈小,离子之间的牵制作用愈弱,活度与浓度之间的差距愈不显著,当溶液极稀时,由于离子间的相互作用变得十分微弱,而r趋近于1,活度与浓度趋于相等。
[有效浓度]见活度条。
[无限稀释]有两种含义:(1)指溶液的浓度趋近于零的状态,在无限稀释时,所有的电解质全部电离,且离子间一切相互作用均可忽略。(2)指溶液稀释到再加溶剂时无热效应的状态。
[电导]描述物体导电性能的物理量,其值是电阻的倒数,单位是“西门子”,用S表示。某物体的电阻愈小它的电导就愈大。
[电导率]又称比电导。可用来衡量和比较物体的导电性能。当物体的长度为1厘米,截面积为1平方厘米时的电导,为该物体的电导率。对电解质溶液来说,当两电极面积各为1平方厘米,电极相距1厘米时为溶液的电导。电解质溶液的电导率与电解质的种类、溶液的浓度及温度等有关。
[离子淌度]又称离子迁移率。某种离子在一定的溶剂中,当电位梯度为每米1伏特时的迁移速率称为此种离子的淌度,单位是米2·秒-1·伏特-1。离子淌度是代表离子迁移速率特征的物理量。
[离子迁移率]见离子淌度条。
[离子强度]在电解质溶液中离子之间平均静电相互作用的一种量度,常用I表示,其定义式如下:
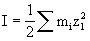
上式的含义是:某电解质溶液的离子强度等于每种离子的质量摩尔浓度mi与其价数Zi平方的乘积之和的一半。
[双电层]在两种不同物体的接触界面上,正负电荷分别排列成的一种面层,例如在金属和电解质溶液相接触的界面上,金属表面电荷层与液溶中的相反电荷的离子层就构成双电层,由于溶液中的离子的热运动,溶液中的一层又分为紧密层和扩散层。
[可逆电池]热力学意义上的可逆电池必须具备两个条件,即可逆电池在充电和放电时不仅物质的转变是可逆的,而且能量的转变也是可逆的。如果把放电时放出的电能全部储存起来并用它对电池充电,则能恰好使电池内化学反应体系及外界环境全部恢复原状。
一般意义的可逆电池就是指由于放电而被消耗的物质,可以通过充电使之再生的电池,此电池的充电反应恰好是放电反应的逆过程,如常用的铅蓄电池。
[可逆电极]构成可逆电池的电极。主要有以下三种类型:(1)金属电极、氢电极、氧电极、卤素电极。金属电极是将金属浸在含有该种金属离子的溶液中构成,以符号M|M2+表示;氢电极、氧电极、氯电极,分别是将被H2、O2、Cl2的气流冲击着的铂片浸入含有H+、OH-、Cl-的溶液中构成,分别用符号(Pt)H2|H+或(Pt)H2|OH-、(Pt)O2|OH-或(Pt)O2|H2O,H+以及(Pt)Cl2|Cl-表示。(2)微溶盐电极和微溶氧化物电极。微溶盐电极是将金属覆盖一薄层该金属的一种微溶盐,然后浸入含有该微溶盐负离子的溶液中构成,如银-氯化银电极,Ag-AgCl|Cl-;微溶氧化物电极是将金属覆盖一薄层该金属的氧化物,然后浸在含有H+或OH-的溶液中构成,如汞-氧化汞电极,Hg-HgO|OH-。(3)氧化还原电极,由惰性金属如铂片插入含有某种离子的两种不同氧化态的溶液中构成,如Fe2+-Fe3+电极,(Pt)|Fe2+,Fe3+。
[半电池]每个可逆电极都可看成是一个半电池。
[盐桥]如果在一个电池中存在着两个电解质溶液的接界面,则在界面处也产生一个电位差,这叫液体接界电位。盐桥是消除液体接界电位的一种装置。两个半电池在构成电池时,电解质溶液不直接接触,而用盐桥沟通,盐桥是用浓KCl溶液和3%琼脂凝聚而成,由于K+和Cl-的迁移数很相近,在盐桥两侧形成两个数值小又几乎相等且符号相反的液体接界电位,使净接界电位降低到只有1-2毫伏,可以忽略不计。如果电池中电解质溶液能与KCl反应(如含Ag+),可采用KNO3或NH4NO3代替KCl做盐桥。
[原电池]通过氧化还原反应而产生电流的装置,也可以说是把化学能转变成电能的装置。有的原电池可以构成可逆电池,有的原电池则不属于可逆电池。
[标准电池]是一种电动势比较稳定,能保持长期不变的可逆电池。标准电池用来测定或校正电池的电动势。常用的是韦斯登(Westone)标准电池,它的正极是汞(Hg)和硫酸亚汞(Hg2SO4)的糊状物,下方放少量汞为与引出的导线保持良好的接触;负极是镉汞齐(Cd-Hg),在糊状物和汞齐上方分别放有CdSO4·83H2O晶体和它的饱和溶液。电极反应和电池反应分别为

这种电池的电动势很稳定,20℃时Es=1.01865伏,温度对这种电池的电动势的影响很小。
[标准氢电极]把镀有铂黑的铂片放到氢离子浓度为1摩尔/升(严格地说应是活度aн+=1)的酸溶液中,在25℃(298.15K)时以pH2=101325帕(1大气压)的干燥氢气不断冲击到铂电极上,使铂黑上吸附的氢气达到饱和,这就构成了标准氢电极。规定在任何温度下标准氢电极的电极电位为零。标准氢电极是常用的参比电极,其它电极的电极电位是和标准氢电极相比较而得到的数值。
[电极电位]将标准氢电极作为发生氧化作用的负极,而将待定某电极作为发生还原作用的正极,组成一个电池。(Pt)H2(pH2=101325Pa)|H+(aH+=1)||待定电极这个电池电动势的数值和符号就是待定电极电位的数值和符号,可以看出,电极电位是一相对值。通常把电极-溶液界面的电位差称为绝对电极电位。
 作为负极,某给定电极为正极组成电池,若此给定电极处于标准状态,即组成电极的离子浓度为1摩尔/升(严格地说,应是活度为1),气体的分压为101325帕(1大气压),液体和固体为纯态,此时电池的电动势就是给定电极的标准电极电位。标准电极电位的数值越大(正值越大),说明该电对中的氧化态的氧化性越强,标准电极电位的数值越小(负数的绝对值越大),说明该电对中的还原态还原性越强。标准电极电位有广泛的应用,例如可以判断氧化-还原反应的方向和程度,可以求算水溶液中发生的氧化还原反应的化学平衡常数,可以求算难溶盐的溶度积等。
作为负极,某给定电极为正极组成电池,若此给定电极处于标准状态,即组成电极的离子浓度为1摩尔/升(严格地说,应是活度为1),气体的分压为101325帕(1大气压),液体和固体为纯态,此时电池的电动势就是给定电极的标准电极电位。标准电极电位的数值越大(正值越大),说明该电对中的氧化态的氧化性越强,标准电极电位的数值越小(负数的绝对值越大),说明该电对中的还原态还原性越强。标准电极电位有广泛的应用,例如可以判断氧化-还原反应的方向和程度,可以求算水溶液中发生的氧化还原反应的化学平衡常数,可以求算难溶盐的溶度积等。
[氧化-还原电对]氧化-还原反应可看成是两个半反应的总和,在每个半反应中氧化型物质和还原型物质组成一个氧化-还原电对。例如


在半反应(1)中,氧化型物质Zn2+和还原型物质Zn组成一个氧化-还原电对Zn2+/Zn;在半反应(2)中,氧化型物质Cu2+和还原型物质Cu组成一个氧化-还原电对Cu2+/Cu。实际上组成可逆电极的物质都是一个氧化-还原电对(见可逆电极)。
[参比电极]在测定某电极的电极电位时,必须与一个已知电极电位的电极构成一个电池,测定出此电池的电动势后,就可以计算出被测电极的电极电位。这种已知电极电位的电极,称为参比电极。如氢电极、甘汞电极、银-氯化银电极等。
[甘汞电极]是常用的一种参比电极。由汞和氯化亚汞(Hg2Cl2)在氯化钾水溶液中的饱和溶液相接触而成。常用的甘汞电极有三种:氯化钾溶液为饱和溶液的是饱和甘汞电极、氯化钾溶液浓度为1摩尔/升的是当量甘汞电极、氯化钾溶液浓度为0.1摩尔/升的是0.1摩尔/升甘汞电极。在298.15K时,当量甘汞电极的电极电位是0.2801伏。甘汞电极的制备和保存都很方便,电极电位很稳定,所以用途很广。
[氢醌电极]由铂(或金)电极和醌氢醌的水溶液构成。醌氢醌是醌和氢醌以等摩尔数相结合的物质,是墨绿色晶体,分子式为C6H4O2·C6H4(OH)2。这种电极用于测定溶液的pH值,其优点是操作简单,只需将少量醌氢醌加入pH待测液中(因醌氢醌溶解度很小),再插入一支光亮的铂电极,就构成了一个醌氢醌电极。这种电极在碱性溶液和浓盐溶液中不宜使用。
[玻璃电极]用于测定溶液pH值的电极。将一种特制的玻璃制成小球,球内盛pH值为定值的缓冲溶液,用铂丝做导线就构成玻璃电极。将玻璃电极浸入待测液中和一参比电极(通常用甘汞电极)组成电池,通过测定电池的电动势就可以算出待测液的pH值。用玻璃电极测定溶液pH值的装置叫pH计。玻璃电极具有不受溶液中氧化性物质及各种杂质影响的特点,所需待测液的数量也很少,操作简便,所以得到了广泛的应用。
[金属活动性顺序]目前中学化学教科书中按金属在水溶液中形成低价离子(指在水溶液中能比较稳定存在的简单离子)的标准电极电位顺序排列的。现行教材的金属活动性顺序是:
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg AgPt Au
金属活动性由强逐渐减弱
金属活动性顺序只是从热力学的角度指出了发生氧化-还原反应的可能性、趋势大小,而不能说明其反应的快慢。金属活动顺序是金属在标准状态下(金属为纯净的,金属离子在溶液中活度为1)的活动性顺序,是金属在水溶液中形成简单离子的活动性顺序,若介质改变活动性会有变化。在运用金属活动性顺序时,必须根据具体条件进行分析,才能得出正确的结论。
[能斯特方程]由德国物理化学家能斯特(Nernst)提出的对任何一种电池反应的电池电动势与电池本性和电解质浓度间的定量关系式,如:

电池电动势:
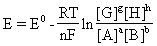
式中E为一定状态下电池的电动势,E0为该电池在标准状态下的电动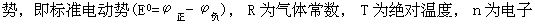 转移的摩尔数,F是法拉第常数96.487千焦/伏·摩尔。
转移的摩尔数,F是法拉第常数96.487千焦/伏·摩尔。
当温度为298.15K时,能斯特方程为:

对某电极的电极电位的能斯特方程为:

当温度为298.15K时为:

[电势-pH图]在许多电极反应(即氧化-还原反应)中,H+或OH-的氧化数虽然没有变化,却参与了电极反应,它们的浓度对电极电位也有影响。以pH值为横座标,以电极电位为纵坐标,绘出电极电位随pH值变化的关系图,称为电势-pH图。例如水的电势-pH图,有两条线,位于下方的一条线称为氢线,表示水被还原放出氢气时,电极电位随pH值的变化;与氢线平行位于上方的一条线称为氧线,表示水被氧化放出氧气时,电极电位随pH值的变化。
[元素标准电势图]表明某一元素的各种氧化态之间标准电极电势变化关系的图。不同的氧化态按由高向低顺


元素标准电势图有广泛的应用,主要有:(1)从已知电对求未知电对的标准电极电势,计算公式为

例如已知酸性介质中氯元素的标准电势图:



(2)判断某元素的中间价态能否发生歧化反应,如下列元素电势图中A为高价态,B为中间价态,C为低价态:

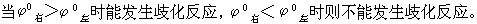
[电极的极化]在电流通过电极时,电极电位偏离平衡值的现象,称为电极的极化。电极极化在现实的电化学过程中是普遍存在的,主要有浓差极化和活化极化。
[过电位]为了表示出电极极化的状况,把在某一电流密度下极化电极电位与该电极的平衡电极电位之间的差值称为过电位(以η表示),η都取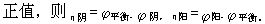
[分解电压]电解时能使电流继续稳定地通过电解质,并使之开始电解的最低电压。分解电压的大小和电极性质,电解液组成、温度、电流密度等因素有关。
[超电压]电解时,实际所需的分解电压超过理论值(指两电极的可逆电动势)的那部分电压称为超电压。在一般情况下,气体的超电压都比较大,金属的超电压(除Fe、Co、Ni外)都比较小。对同一析出物来说,超电压也不恒定,如氢气在铁电极上析出时超电压较小,而在镍电极上析出时超电压就较大。在电解中超电压的存在造成多耗电能,是不利因素,但有时也能加以利用,如在微酸性的锌盐溶液中镀锌时,由于氢气的超电压较大,实际上在镀件上析出的是锌而不是氢气。
[法拉第电解定律]1833年英国物理学家法拉第(Fara day)发现;其要点是:(1)电解时在电极上电解产物的量与溶液通过的电量成正比;(2)当以相同的电量分别通过不同的电解质溶液时,在各电极上析出或溶去的物质具有相同的当量值。现代关于电解定律的叙述是:1法拉第的电量(1摩尔电子的总电量是96487库仑,称为1法拉第,用F表示),可以析出或溶解相当于接受或给出1摩尔电子的物质。
[电解]即在直流电的作用下,电解质所发生的氧化-还原反应。电解池的阳极与电源的正极相连,电解池的阴极与电源的负极相连,通电时阳极发生氧化反应,阴极发生还原反应。电解有着重要的应用,许多基本化工产品的生产、稀有金属的冶炼、金属的精制、电镀等都要利用电解的方法。
[电镀]应用电解原理在金属制品或塑料制品表面镀上一层其它金属或合金的方法。电镀的目的主要是使金属增强抗腐蚀性、增加美观和制品表面硬度。镀层的金属或合金通常有:铬、锌、镍、银、铜锌合金等。电镀时,镀件为阴极,所镀的金属或合金为阳极,含有镀层金属离子的溶液为电解液。
[阳极氧化]利用电解方法使金属制品表面形成附着力很强的氧化物薄膜的过程。这层薄膜可防止金属的腐蚀,并可做金属着色的基底。此外,在电化学反应中,在阳极上发生的氧化反应有时也叫阳极氧化。
[化学电源]把化学能转变为电能并可做为电能来源的装置叫化学电源。日常使用的干电池、蓄电池等都是化学电源。
[干电池]指锌锰干电池,是常用的化学电源之一,是一次电池。负极是锌,正极是被二氧化锰包围着的石墨电极,电解质是氯化锌及氯化铵的糊状物。这种电池应用相当广泛,已有一百多年的历史,但对它的电极反应仍未彻底弄清楚,一般认为电极反应是:
负极 Zn+2NH4Cl-2e→Zn(NH3)2Cl2+2H+
正极 2MnO2+2H++2e→2MnOOH
Zn+2NH4Cl+2MnO2→Zn(NH3)2Cl2+2MnOOH这种电池在开路时电压为1.5伏。
[蓄电池]指铅蓄电池,也是常用的化学电源之一,是二次电池。负极是海棉状铅;正极是涂有二氧化铅的铅板,电解质是比重约为1.28的硫酸水溶液。电池表示式为Pb-PbSO4|H2SO4|PbSO4-PbO2-Pb
电极反应和电池反应是
负极 Pb+SO24--2e→PbSO4
正极 PbO2+H2SO4+2H++2e→PbSO4+2H2O

这种电池的电动势为2伏,电池内硫酸的浓度随着放电的进行而降低,当硫酸的相对密度降至约1.05时,电池电动势下降到约1.8伏,应暂停使用,以外加直流电源充电直至硫酸的相对密度恢复到约1.28时为止。蓄电池还有其它类型,如镍铁蓄电池,镍镉蓄电池等。
[银锌电池]一种高能化学电源,可做成蓄电池。负极是锌,正极是氧化银,电解质是40%的KOH溶液和K2ZnO2饱和溶液。电极反应和电池反应是:
负极 Zn+2OH--2e→Zn(OH)2
正极 Ag2O+H2O+2e→2Ag+2OH-

银锌电池具有高的比能量,能大电流放电,因此适用于火箭、导弹和人造卫星、宇航等方面。
[燃料电池]一种高能化学电源,是将燃料和氧气反应时的化学能直接转变成电能的装置。电池的正极和负极都是用微孔导电材料制成(镍、铁、氧化铁等)的。以氢一氧燃料电池为例说明,电池表示式可写成:
(Ni)H2(气)|KOH(20-40%)|O2(气)(Ni)电极反应和电池反应为:
负极 H2+2OH--2e→2H2O


该电池的电动势与氢气和氧气的分压有关。燃料电池的能量利用率很高,氢氧燃料电池已实际应用在宇宙航行和潜艇中,它不仅能大功率供电,而且还具有可靠性高,无噪声以及能供给饮水等优点。
[电化学腐蚀]金属腐蚀的一种普遍形式。由金属接触到电解质溶液构成微电池而发生的金属腐蚀过程叫电化学腐蚀。电化学腐蚀中的微电池,其负极一般都是金属被氧化形成离子进入溶液。
如钢铁在潮湿空气中的腐蚀,Fe-2e=Fe2+。
[析氢腐蚀]电化学腐蚀的一种形式。通常在酸性溶液中、在氢气过电位较小的材料上容易发生。此时在微电池的正极发生的是析出氢气的反应:2H++2e→H2↑。
[吸氧腐蚀]电化学腐蚀的一种形式。通常在中性或碱性溶液中,以及溶液里溶有足够的氧气时发生。此时微电池的正极发生溶解的氧气被还原的反应:
O2+2H2O+4e→4OH-。
[阳极保护]为防止金属腐蚀,将被保护的金属作为阳极,在一定条件下进行阳极氧化,使金属钝化(在金属表面形成金属氧化物组成的钝化膜),这种方法叫阳极保护。
[阴极保护]将被保护的金属变为阴极,以防止金属腐蚀的方法。阴极保护法有两种:(l)外加电流的阴极保护法。把要保护的金属设备作为阴极与外电源的负极相连,另外用不溶性电极作为辅助阳极,与外电源的正极相连,两电极都与电解质溶液接触。通电后,大量电子被强制流向阴极,使金属制品表面产负电荷(电子)积累,只要维持足够的外加电压,由金属腐蚀而产生的原电池的电流就不能被输送,因而金属就可不被腐蚀。这种方法是经济、有效的防腐方法之一,目前在保护闸门、地下贮槽、输油管、电缆及受海水或淡水腐蚀的设备、结晶槽、蒸发罐等多采用这种方法防腐。(2)牺牲阳极保护法。在要保护的金属设备上联结一种负电位更低的金属,作为更有效的阳极。这样,在发生电化学腐蚀时,被腐蚀的是作为阳极的金属,因此叫牺牲阳极保护法。这种方法可用来防止轮船船壳的腐蚀,通常在轮船的尾部和船壳水线以下部分装上一定数量的锌块作被牺牲的阳极。
[缓蚀剂保护法]是防止金属腐蚀应用得最广泛的方法之一,把少量的缓蚀剂加到腐蚀性介质中,就可使金属腐蚀的速度显著减慢,这种防腐方法叫缓蚀剂保护法。加入缓蚀剂可使微电池的阳极或者阴极(或二者)的极化增加,从而使腐蚀的速度减慢。缓蚀剂的种类很多,无机物有亚硝酸盐、铬酸盐、重铬酸盐、磷酸盐等,有机物有胺类、醛类、杂环化合物、咪唑啉类等。使用缓蚀剂时,要根据被保护的金属种类、腐蚀介质等条件来确定。
[反应速度]化学反应进行的快慢程度用反应速度表示。对于在恒容条件下进行的反应,通常用一种反应物或生成物的浓度在单位时间内的改变来表示反应速度。化学反应的速度是随时间而变化的,因此常用微商的形式表示反应速度。如下列化学反应:
aA+bB→gG+hH
 应的速度的数值为正值,而反应物A、B的浓度CA、CB随时间的变化率dCA/dt和dCB/dt本身是负值,所以在表示反应速度时前面应加“-”号。由于化学反应方程式中各化学式的系数之间有一定的关系,所以对同一个反应用不同物质所表示的反应速度应有下列关系:
应的速度的数值为正值,而反应物A、B的浓度CA、CB随时间的变化率dCA/dt和dCB/dt本身是负值,所以在表示反应速度时前面应加“-”号。由于化学反应方程式中各化学式的系数之间有一定的关系,所以对同一个反应用不同物质所表示的反应速度应有下列关系:
 反应物的性质外,其它条件,如温度、浓度、压力、催化剂、反应物颗粒的大小等都对反应速度有重要影响。
反应物的性质外,其它条件,如温度、浓度、压力、催化剂、反应物颗粒的大小等都对反应速度有重要影响。
[反应速度方程式]表示反应速度与浓度间的函数关系式叫做反应速度方程式,又称反应速度公式。某一反应的反应速度方程式只能通过实验找出其具体表达形式。
[基元反应]能代表反应机理的,由反应物微粒(分子、原子、离子、自由基等)一步直接实现的变化,称为基元反应或基元步骤。例如
NO2+CO→NO+CO2
大多数化学反应不是基元反应,有不少是由多个基元反应组成的,例如H2(气)与I2(气)化合的反应是由两个基元步骤完成的:
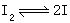
H2+2I→2HI
[简单反应]仅由一个基元步骤完成的反应叫简单反应。
[复杂反应]由多个基元步骤完成的反应叫复杂反应。
[质量作用定律]由挪威化学家葛尔德保(Guldberg)和威吉(Waage)首先提出。原意是:当温度恒定时,在均相系中,化学反应的速度和反应物的有效质量成正比(有效质量应理解为浓度)。现代对质量作用定律的认识是:在恒温下,对简单反应(或复杂反应中的任一基元反应)来说,化学反应的速度和反应物浓度的方次的乘积成正比(反应物浓度方次的数值等于反应式中各分子式前边的系数)。例如有一简单反应的反应式为aA+bB=C,该反应的反应速度方程式为:
v=k[A]a[B]b
式中k为比例常数,又称反应速度常数,在一定的条件下,当所有反应物的浓度都是1mol·1-1时,v=k。
[反应速度常数]反应速度方程式中的比例常数k叫做反应速度常数。例如有以下简单反应:
aA+bB→gG+hH
用A物质浓度变化率表示反应速度时:

用B物质浓度变化率表示反应速度时:

kA与kB有如下关系:kA/kB=a/b。
如果上述反应是气相反应,则反应速度方程式中各物质的浓度可以换成分压,那末式中的k值也要相应地改变。
对不同的反应,k值是不同的。对某指定的反应,k值与反应物的浓度无关而与反应温度及使用的催化剂有关。
[反应级数]反应速度方程式中浓度项的方次之和称为此反应的反应级数。例如对以下反应:
aA+bB→gG+hH
根据实验确定其反应速度方程式为:v=kCaACbB,此反应的反应级数为(a+b),也称该反应为(a+b)级反应。反应级数除有整数级数,如零级、一级、二级、三级等,还可以有分数甚至是负数。反应级数都是由实验测定的。
[反应分子数]指在基元反应过程中参加反应的微粒(分子、原子、离子、自由基等)数目。根据反应分子数可将化学反应区分为单分子反应、双分子反应和三分子反应。例如:
CH3COCH3→C2H4+CO+H2
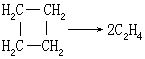
是单分子反应。
CH3COOH+C2H5OH→CH3COOC2H5+H2O
是双分子反应。
H2+2I→2HI
是三分子反应。
大多数反应是单分子反应或双分子反应,三分子反应很少见,至于四分子及四分子以上的反应,从理论上分析几乎是不可能存在的。应该注意,反应分子数和反应级数是两个不同的概念,反应分子数是为了说明反应机理而引出的概念,反应级数是根据实验得出的数值。一般说来,对同一个反应它们的数值是不同的,例如,有零级反应,但没有零分子反应;反应级数可以是分数,反应分子数却不可能是分数。
[可逆反应]又称对峙反应,指在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。严格地说,任何反应都是可逆反应。假若逆反应的速度远远小于正反应的速度,平衡点远远偏向产物一边,这种反应可认为是能进行到底的单向反应;假若逆反应的速度相当大,则不能忽略,这类反应就是对峙反应。
[平行反应]当反应物同时进行着两个或两个以上不同的反应时,称为平行反应。这在有机反应中比较普遍。例如甲苯的硝化反应,同时进行着产生邻位、对位、间位硝基甲苯的三个反应。
[连串反应]如果一个复杂反应要经过几个基元反应才能达到最终产物,其中前一个基元反应的产物为后一个基元反应的反应物,如此连续进行,这样的反应,称为连串反应。例如苯的液相氯化:

[链反应]这是一类比较特殊的反应。这类反应的特点是:反应一旦开始,如果不加控制,就可发生一系列的连串反应,使反应自动进行下去,故称为链反应。链反应一般分为三个阶段:链的引发、链的传递和链的终止。链的引发需要吸收能量,对反应条件也很敏感,反应一旦引发,通常都进行得非常迅速。例如氢气和氯气化合的反应就是链反应,其反应过程如下:
链的引发:在光照条件下产生自由基(或称活性质点),可表示为
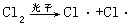
链的传递:自由基参加反应,同时又产生新的自由基,新的自由基又参加反应,再产生新的自由基……不断往下传递,其反应过程是:
Cl·+H2→HCl+H·
H·+Cl2→HCl+Cl·
…………
链的终止:是自由基本身结合为正常分子的步骤。若自由基与器壁或其它分子碰撞耗散了能量而使链终止。
Cl·+Cl·+M(器壁或其它分子)→Cl2+M
根据链反应中链传递的方式不同,又可分为直链反应和支链反应。
[有效碰撞理论]有关反应速度的理论,是在气体分子运动论的基础上提出的。此理论的要点是:在气体反应中,化学反应发生的先决条件是反应物分子必须发生碰撞;但不是任何两种反应物分子之间的碰撞都能发生反应,只有少数分子的碰撞能发生反应,这种能够发生反应的碰撞称为有效碰撞。能发生有效碰撞的分子所具有的能量比整个体系内分子的平均能量要高出很多,才能发生有效碰撞。因此化学反应的速度主要取决于单位时间内有效碰撞的次数。
[有效碰撞]见有效碰撞理论条。
[过渡状态理论]也是一种有关反应速度的理论,是在统计力学和量子力学的发展中建立起来的。该理论的大意是:由反应物到产物必须经过一种过渡状态,即具有足够能量的反应物分子形成活化络合物的中间状态,反应物和活化络合物之间很快达到平衡,化学反应的速度由活化络合物的分解速度来决定。例如A原子和BC分子间的简单反应:
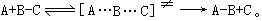
当A原子沿B-C轴线逐渐接近BC分子时,B-C间的化学键逐渐松弛,同时开始逐渐形成新的A-B键,在此过程中体系的位能增加,当形成过渡状态的活化络合物[A…B…C]≠时,体系的位能最高,活化络合物很不稳定,它可能分解变为产物,也可能重新变回反应物。由反应物变成活化络合物及由活化络合物变回反应物的速度都很快,在瞬间就能达到平衡,而由活化络合物分解变成产物的速度却是比较慢的,因此化学反应的速度取决于活化络合物分解的速度。
[活化分子]见有效碰撞理论条。
[活化能]活化能是化学动力学中的一种重要概念,1889年由瑞典物理化学家阿累尼乌斯(Arrhenius)首先提出。阿累尼乌斯总结了大量的实验数据,提出了经验公式
K=Ae-Ea'RT
式中K为速度常数,A为一常数通常称为“指前因子”或“频率因子”,R为气体常数,T为热力学温度,而Ea即为活化能。活化能的意义是:活化分子的平均能量与反应物分子平均能量之差。
在过渡状态理论中,活化能(能垒)是指反应物分子和活化络合物分子处于基态时的位能差,它不等于Ea。
[活化络合物]见过渡状态理论条。
[活化过程]在过渡状态理论中,由稳定的反应物分子过渡到活化络合物的过程叫活化过程。
[阿仑尼乌斯方程式]见活化能条。
[自由基]是一种具有未成对电子的原子或原子团,它们有很高的化学活性。自由基中的未成对电子用黑点“·”表示。例如原子氢H·、氢氧基HO·、甲基CH3·、乙酰基CH3CO·等。自由基是很不稳定的,它不能长期存在,很容易继续发生反应。某些稳定分子中也有不成对电子,如O2、NO、NO2等,但不称为“自由基”。
[催化剂]能改变化学反应速度而在反应前后本身的化学组成、化学性质及数量没有变化的物质称为催化剂。正催化剂能加快反应速度,负催化剂(阻化剂)能减慢反应速度。
[催化反应]有催化剂参加的反应。若催化剂和反应物同处于均匀的气相或液相中,称为均相催化。若催化剂和反应物不在同一相中,且反应仅在催化剂与反应物的界面上进行,则称为多相催化。还有一类催化反应叫生物催化,或称酶催化,它既不同于均相催化也不同于多相催化,而是兼有二者的某些特征。
[阻化剂]见催化剂条。
[均相催化]见催化反应条。
[多相催化]见催化反应条。
[载体]工业上常常将催化剂附着在一些多孔性物质上作为催化剂的骨架,这种物质就称为催化剂的载体。载体主要有以下的作用:(1)将催化剂附着在载体上可使催化剂有较大的表面,从而提高其催化活性。(2)附着在载体上的催化剂只是很薄的一层,因此可大大节省催化剂的用量,这对贵金属催化剂特别重要。(3)增强了催化剂的机械强度。(4)选择导热性较好的载体还可有助于催化剂散热,能延长催化剂的使用寿命。常用的载体有浮石、硅胶、硅藻土、活性炭等。
[助催化剂]本身没有催化作用或只有很小的催化活性,但将它和某种催化剂组合后能显著提高催化剂的活性、选择性并延长催化剂的使用寿命,这种物质叫助催化剂。例如合成氨所用的Fe催化剂中,加入少量的助催化剂K2O和Al2O3可使Fe的催化效率明显提高。
[自催化作用]不需外加催化剂,而由反应生成物起催化剂的作用,叫自催化作用。例如酸性高锰酸钾和草酸的反应中,反应生成物Mn2+离子就能起到该反应的催化作用:
2MnO-4+5C2O24-+16H+=2Mn2++10CO2↑+8H2O
这类反应开始时速度较慢,随后逐渐加快。
[催化剂的选择性]催化剂的选择性有两方面的含义:(1)不同类型的反应需要选择不同的催化剂;即便是同一类型的反应,使用的催化剂也不一定相同,如SO2的氧化用的是V2O5催化剂,而乙烯氧化却用金属Ag催化剂。(2)对相同的反应物,如果选用不同的催化剂,可以得到不同的产物,例如乙醇的分解:

从热力学观点分析,以上的反应都能自发地进行,某种催化剂只对某一特定反应有催化作用,并不能加速所有可能发生的反应。
[催化剂中毒]反应体系中含有少量杂质就能严重降低甚至完全破坏催化剂的活性,这种物质称为催化剂毒物,这种现象称为催化剂中毒。催化剂中毒现象有两类:(1)暂时性中毒(或称可逆性毒化),如合成氨生产中的O2、H2O(气)、CO、CO2等杂质引起的中毒。只要不断用纯净的原料气吹过中毒的催化剂表面,就可使毒物除去。(2)永久性中毒(或称不可逆毒化),如合成氨生产中的含硫化合物及PH3等属于永久毒物。这主要是因为这类毒物与催化剂表面形成了牢固的表面化合物。
[体系]作为研究对象的一定物质或空间所组成的整体,也称系统。体系以外的其他物质或空间则称作环境。例如研究硝酸银和氯化钠在水溶液中的反应,含有这两种物质的水溶液就是体系,而盛溶液的烧杯、溶液上方的空气等就是环境。热力学体系可分三种:孤立体系、封闭体系、敞开体系。
[环境]指所研究的物质体系以外的其它部分(见体系条)。关于生态环境详见“环境部分”。
[敞开体系]体系与环境之间既有物质交换,又有能量交换。
[封闭体系]体系与环境之间没有物质交换,只有能量交换。
[孤立体系]体系与环境之间既没有物质交换,又没有能量交换。
[状态]即体系的状态,在热力学中用体系的性质来规定其状态。决定体系状态的性质有温度、压力、体积、组成等,比如当研究的对象是一定量的纯净气体时,温度和压力一定时,体系的状态就定了。
[状态函数]用于规定体系的热力学状态的宏观性质,如体积、温度、压力、物质的量等都叫做状态函数。状态函数的变化只取决于体系的始态和终态,而与变化的途径无关。
[压力]物理学中压强的概念,在化学热力学中常称作压力。单位是帕斯卡(Pa),压力为1Pa的含义是:1平方米面积上受到的垂直作用力为1牛顿(1Pa=1Nm-2)。
[压强]见压力条。
[理想气体]忽略了分子本身的体积和分子间作用力的气体。这种气体是不存在的,这只是一种理想状态,当真实气体处在较高的温度和较低的压力的状态下可近似地看成是理想气体。
[理想气体状态方程]即PV=nRT。式中P为气体压力,V为气体体积,n为气体的摩尔数,R为气体常数,T为热力学温度。
[气态方程]见理想气体状态方程条。
[气体常数]理想气体状态方程中的一个常数,常用R表示,R=8.314J·mol-1·K-1。
[广度性质]也叫容量性质,是体系宏观性质的一类。广度性质的数值与体系中物质的数量成正比,例如体积、质量、内能等。
[强度性质]体系的宏观性质的另一类,其数值与体系中物质的数量无关,仅由体系本身的性质决定,没有加和性,整个体系的强度性质与体系各个部分的强度性质的数值都相同。例如温度、密度、比热、气体压强等。
[等温过程]在保持温度不变的情况下(指体系的始态温度与终态温度相同),体系所进行的各种化学或物理的过程。在这种过程中体系和环境间可能有热和功的交换。
[等压过程]在恒定压力下(指体系的始态压力与终态压力相同,并等于环境的压力),体系所进行的各种化学或物理的过程。在这种过程中体系和环境可能有热量和功的交换。
[等容过程]在保持体积不变的情况下,体系所进行的各种化学或物理的过程。在这种过程中,体系和环境间,可能有热量的交换。
[绝热过程]在体系跟环境间没有热量交换的情况下,体系所进行的各种化学或物理过程。例如在有良好的绝热壁的容器内发生的化学反应,可认为是个绝热过程。另外,某些过程进行极迅速,来不及和环境进行热交换,如气体向真空膨胀,也可视为绝热过程。
[热力学可逆过程]对体系发生变化时所进行的过程,能通过原来过程的反方向变化而使体系回复到原来状态,同时在环境中没有留下任何永久性变化的过程,称为热力学可逆过程。在这过程进行中的每一瞬间,体系和环境都非常接近于平衡态。在等温的可逆过程中,体系对环境所作的功为最大功,环境对体系所做的功为最小功。可逆过程是一种理想的极限过程。有些实际过程,例如液体在气-液平衡下等温蒸发;原电池在外加电压接近或等于原电池电动势的情况下放电或充电的过程等,都可以近似看成可逆过程。
[热力学温标]又称绝对温标或开氏温标,是最基本的温度标定方法。热力学温度用符号T表示,其单位是K(Kelvin的缩写),是国际单位制(SI)的基本单位之一。热力学温标的1度是水的三相点热力学温度的1/273.16。
[绝对温标]见热力学温标条。
[开氏温标]见热力学温标条。
[摄氏温标]规定在101325帕斯卡(1大气压)下水的冰点为0度,沸点为100度,中间分100等分,每等分代表1度。摄氏温标的符号为t,单位是摄氏度用℃表示,水的三相点温度为0.01℃。
[焦耳]是能量(功、热)的单位,是SI的导出单位,用“J”表示,1J=1N·m(1焦耳=1牛顿·米)。
[内能]体系的内能就是体系内部所包含的一切能量,它包括体系内分子运动的动能、分子间相互作用的位能,以及分子内各种粒子(原子、电子、原子核)所具有的能量。但体系本身的动能和位能不包括在内。内能是体系本身的性质,仅决定于体系的状态,在一定的状态下,体系的内能应有一定值,内能是体系的状态函数。内能的绝对值现在还无法测量,然而对热力学来说,重要的不是内能的绝对值而是内能的变化值,这是可以用实验测量的。
[焓]体系的状态函数,用符号H表示。焓的定义式是:H=U+pV。U是体系的内能,p是体系压力,V是体积。在一定状态下,体系的焓应有一定值,但现在无法测定焓的绝对值,对热力学来说重要的是焓的变化值,这是可以通过实验测量的。
[焓变]体系终态的焓(H2)与始态的焓(H1)的改变量,用△H表示,△H=H2-H1。
[热效应]体系在一定温度下(等温过程)发生物理或化学变化时(在变化过程中只做膨胀功而不做其它功),所放出或吸收的热量。化学反应中的热效应又称反应热。根据化学热力学的分析,恒压下的反应热(又称恒压反应热)等于体系的焓变:△H=Qp,△H=(∑H)产物-(∑H)反应物。
[放热反应]放出热量的化学反应叫放热反应。在等温等压条件下,放热反应的焓变为负值,△H<0。
[吸热反应]吸收热量的化学反应叫吸热反应。在等温等压条件下,吸热反应的焓变为正值,△H>0。
[反应热]见热效应条。
[中和热]在稀溶液中酸碱中和生成1摩尔水的反应热。一元强酸与强碱的中和热约为57千焦,与酸碱种类无关,因为这实际上是1摩尔H+与1摩尔OH-反应生成1摩尔H2O的反应热。弱酸、弱碱以及多元酸碱的中和热,因有电离热的影响,不是定值。
[生成热]在热力学标准态下,由稳定单质生成1摩尔化合物时的反应热,叫标准生成热,简称生成热。根据热力学规定,在所有温度下稳定单质的生成热为零,这样化合物的生成热就可通过实验测定。
[燃烧热]指1摩尔纯物质完全燃烧,生成稳定的氧化物时的反应热。
[盖斯定律]1840年,盖斯(Гecc)在大量实验的基础上提出:“在等容或等压条件下,一个化学反应不管是一步完成还是分几步完成,其热效应总是相同的。”也就是说,在等容或等压条件下,反应热只与反应的始态和终态有关,而为反应的途径无关。盖斯定律的提出奠定了热化学的基础,它的重要意义在于可根据已经准确测定的反应热来计算难于测量的反应热的热效应。
[升华热]由1摩尔固态物质生成气态分子或原子所需要的热量。如1摩尔固态金属钠升华成气态钠原子,升华热为108.37kJ·mol-1。
[气化热]在温度不变的条件下,单位质量的液体转化为气体时所吸收的热量。如100℃(373.15K)时水的气化热为2253千焦/千克(539千卡/千克)。当在温度不变的条件下,1摩尔液体转化为气体时所吸收的热量,则是该液体的摩尔气化热,如100℃(373.15K)时,水的摩尔气化热为40.55千焦/摩尔(9.702千卡/摩尔)。
[溶解热]指1摩尔物质在25℃(298K),101325Pa(1大气压)下形成无限稀的溶液(溶液稀到再加溶剂时无热效应)时的热效应。常用∞aq表示大量水或无限稀的溶液。1摩尔HCl气体的溶解热为:
HCl(g)+∞aq=HCl·∞aq
△H=-75.4千焦
[有用功]指非膨胀功。体系在发生变化的过程中,除膨胀功以外的其它功叫有用功。例如电池在恒温恒压下放电,所做的电功即有用功,而电池中的物质由于化学反应而引起体积变化所做的功叫膨胀功。
[熵]体系的状态函数,是体系内部质点混乱程度(或无序度)的量度,常用S表示。当体系内质点的聚集状态发生改变时,其熵值就会改变,体系终态熵值(SB)与体系始态熵值(SA)之差为体系的熵变,用△S表示,△S=SB-SA。当体系的状态改变时,体系的熵变等于由始态到终态的任一可逆过程的热温商之和,其数学表达式为:
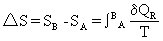
化学反应的熵变等于生成物的熵值与反应物的熵值之差,△S=(ΣS)生成物-(ΣS)反应物。
[熵变]见熵条。
[熵增大原理]见热力学第二定律(3)条。
[自由能]体系的状态函数,常用符号G表示,G=H-TS,自由能也称自由焓或吉氏函数。体系的自由能改变△G,为体系终态的自由能与始态的自由能之差。在等温等压条件下,体系的自由能减少等于体系所做的最大有用功。对等温等压条件下发生的化学反应,可以根据反应的自由能变[△G=(ΣG)产物-(ΣG)反应物],判断反应能否自发进行:当△G<0,反应发生时会放出自由能,可被利用来对环境做有用功,这个反应就能自发进行;当△G>0,必须由环境提供有用功反应才能发生,这个反应就是非自发的;当△G=0,则反应体系处于平衡状态。
[自由焓]见自由能条。
[吉氏函数]见自由能条。
[功函]体系的状态函数,常用符号F表示,F=U-TS,功函又称赫氏函数。在等温等容的条件下,体系功函的减少等于体系所做的最大有用功。
[赫氏函数]见功函条。
[热力学第零定律]两个热力学体系中每一个都和第三个热力学体系处于热平衡,那么它们彼此也必然处于热平衡。这就是热力学第零定律。
[热力学第一定律]即能量守恒和转换定律。可以这样表述:(1)不供给能量而可连续不断产生能量的机器叫第一类永动机,第一类永动机是不可能存在的。(2)在体系状态变化过程中,它的内能改变等于在这个过程中所做的功和所传递的热量的总和。当某体系的状态改变时,假设体系吸收的热量为Q焦耳,同时对环境做了W焦耳的功,根据热力学第一定律,应有下面的公式:△U=Q-W。
[热力学第二定律]是热力学的基本定律之一,有多种表述方式:(1)热量总是从高温物体(体系)传到低温物体,不能自发地进行相反的传递。(2)功可以全部转化为热,但任何热机不能全部地、连续地把所获得的热量转变为功。(3)在任何自发过程中,体系和环境的总熵值是增加的。热力学第二定律所要解决的中心问题是自发过程的方向和限度。
[热力学第三定律]当体系的热力学温度趋于零时,混乱度为最小,此时体系的熵值也趋于零。也可以说,在绝对零度时,任何纯物质的完美晶体的熵值都等于零。有了热力学第三定律,从原理上说,纯物质的绝对熵值的求算问题就可以认为是解决了。
[分压]即分压力。恒温时混和气体中某组分气体单独占有与混和气相同的体积时,对容器所产生的压力。混和气的总压就等于各组分气体的分压之和。
[道尔顿分压定律]1807年由道尔顿(Dalton)首先提出。内容是:混和气体的总压力等于各组分气体的分压力之和。由此可进一步得出:某组分气体分压的大小和它在混和气中的体积分数(或摩尔分数)成正比,等于混和气体的总压乘以该组分的摩尔分数。这个定律的数学表达式为:
P总=P1+P2+P3+……+Pi
Pi=p总Xi
(Pi为某组分的分压,Xi为该组分的摩尔分数)。
[物态]当大量的微观粒子在一定的温度和压力下相互集聚为一种稳定的结构状态时,叫做物质的一种状态,简称物态。若只从物体的宏观特征看,物质有三态,即固态、液态、气态。
[相]体系中具有相同组成、物理性质和化学性质完全均匀的部分。相与相之间存在着界面,越过此界面,性质就有一个突变。不仅限于固、液、气三相之间。两种不同结晶的晶体,虽都是固体,也是两个相。
[相律]在平衡体系中,联系体系内相数(Φ)、组分数(K)、自由度数(f)及影响物质性质的外界因素(如温度、压力、重力场、磁场、表面能等)之间关系的规律。若只考虑温度和压力,而不考虑其它因素的影响,平衡体系中相数、组分数和自由度之间的关系为:
f=K-Φ+2
由上式可以看出,体系每增加一个组分数,则体系的自由度数就增加一个;如果体系增加了一个相数,则自由度就要减少一个。
[自由度]欲表明一体系在某状态时的强度性质所必需的独立变量数,称为该体系的自由度。例如,要表明一定量水所处的状态,需要指定水所处的温度和压力;若只指定温度时,则水的状态还不能确定,当指定了温度和压力,则水的状态就确定了,不能再任意指定其它性质(如密度等),由此可知,当体系中只有水存在时,体系的自由度等于2。在一定范围内,同时改变温度和压力这两个因素,仍能保持水的液相而不产生新相。
[相图]当体系中有多相存在时,把体系的相平衡规律用几何图形展现出来就成为相图。它能直观地表明体系的状态与温度、压力、组成的关系。
下页图为水的相图。图中OA线是液-气平衡线(即水的蒸气压曲线),OB线是固-汽平衡线(即冰的蒸气压曲线),OC线是固-液平衡线,O点是冰-水-气三相平衡的三相点。此单组分体系相图上,有三个单相面,三条两相平衡线,一个三相点,与相律完全一致。

[相变]在某一体系中,各相之间的相互转变称作相变。例如,物质的气、液、固三态间的转变;固态物质的不同晶型间转变等。
[相平衡]指在某一体系中,由两个相或多个相形成的平衡状态。
[均相体系]又称单相体系,即只有一个相的体系。如二氧化氮NO2和四氧化二氮N2O4两种气体共存的体系。
[单相体系]见均相体系条。
[均相反应]参加化学反应的物质都在同一相中,这种反应叫均相反应。此类反应又称单相反应。
[均相平衡]又称单相平衡。指某一体系中由一个相组成的平衡状态,就是在一个相-气相组成的平衡。例如,合成氨的反应:N2(气)+3H2(气)2NH3(气)
[单相平衡]见均相平衡条。
[多相体系]又称非均相系,指含有两个或多个相的体系。
[非均相体系]见多相体系条。
[多相反应]参加化学反应的物质不是在同一相中,这种反应叫多相反应。例如,在固体催化剂表面进行的反应;金属固体在酸溶液中发生的反应等。此类反应又称非均相反应。
[多相平衡]又称非均相平衡。某一体系中由两个或多个相组成的平衡状态。例如,由冰、水、水蒸气形成的多相物理平衡;又如在封闭容器中碳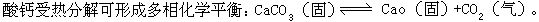
[三相点]指单组分体系中三相(一般指气、液、固三相)处于平衡共存时的温度和压力。在单组分体系中最多只能三相共存,这在相图中为一个点。例如,固相的冰、液相的水和气相的水蒸气三相平衡共存在温度为0.01℃(273.16K)、压力为610帕(4.6mmHg),这就是水的三相点(见图1)。
[恒沸混和物]又称共沸混和物。若某二组分溶液的组成与其蒸气的组成相同,在此浓度的溶液用分馏方法分离出纯组分是不可能的。这种溶液与一般溶液不同,由开始沸腾到蒸发终了,蒸气的组分与溶液的组成始终相同,其沸点不变。这种溶液称为恒沸混和物。
[共沸混和物]见恒沸混和物条。
[最低恒沸点]当恒沸混和物的沸点低于任一纯组分的沸点时,称为“最低恒沸点”。
[最高恒沸点]当恒沸混和物的沸点高于任一纯组分的沸点时,称为“最高恒沸点”。
[低共熔物]又称低共熔混和物。两种或两种以上的物质组成的熔体,当其组成达到一定值时,可在一最低凝固温度,以比较均匀的形式共同析出固体,该固体若加热,仍在此最低温度共同熔融成熔体。该固体称低共熔物,此温度称低共熔点。
[低共熔混和物]见低共熔物条。
[低共熔点]见底共熔物条。
[饱和蒸气压]在一定温度下,在密闭容器中,当液体的蒸发速度与蒸气的凝聚速度相等时,液体和它的蒸气处于平衡状态。该液态平衡的蒸气称为饱和蒸气,饱和蒸气所产生的压力称为饱和蒸气压。饱和蒸气压简称蒸气压,是所有液体和某些固体的特有性质。
[蒸气压]见饱和蒸气压条。
[蒸气压降低]在一定温度下,溶液的蒸气压总是低于纯溶剂的蒸气压。对难挥发非电解质的稀溶液,蒸气压降低的数值只与溶液中溶质的摩尔分数有关,而与溶质的本性无关,溶液浓度越大,蒸气压下降的数值就越大。由于溶液蒸气压降低导致溶液的沸点高于纯溶剂的沸点。
[沸点升高]溶液蒸气压的下降导致了溶液沸点的升高。溶液沸点升高的程度只与溶液的浓度有关,难挥发非电解质稀溶液的沸点升高数值和溶液的质量摩尔浓度成正比,可用公式表示:△Tb=Kbm。式中△Tb是沸点上升的度数,Kb是溶剂的沸点上升常数,m是溶液的质量摩尔浓度。
[凝固点]晶体物质凝固时的温度,即该物质的液态和固态平衡共存时的温度。凝固点决定于晶体的种类和所受的压强。在一定压力下,任何晶体的凝固点和它的熔点相同。而非晶体则无一定的凝固点。
[冰点]即水的凝固点。冰点与压力的大小有关,在101325帕斯卡(1大气压)的压力下,冰点为273.15K。水的冰点随外压增大而降低。
[凝固点降低]溶液的凝固点①2t000099_0142_0低于纯溶剂的凝固点的性质。溶液凝固点降低的程度只与溶液的浓度有关,而与溶质的本性无关。可用公式表示:△Tf=Kfm。式中△Tf是凝固点降低的度数,Kf是溶剂的凝固点降低常数,m是溶液的质量摩尔浓度。
[渗透压]当溶液与纯溶剂(或两种浓度不同的溶液)用半透膜隔开时,溶剂分子能通过半透膜从纯溶剂一边进入溶液,或从稀溶液一边进入浓溶液,这种现象叫渗透现象。在溶液与纯溶剂组成的体系中,欲阻止渗透现象发生,必须增大溶液的压力,刚刚足以阻止渗透过程进行所外加的压力叫渗透压。对于非电解质稀溶液来说,溶液的渗透压与溶液的浓度成正比,而与溶质的本性无关,渗透压的计算公式为:π=RTC。式中π为溶液渗透压,R为气体常数,T为绝对温度,C为溶液的摩尔浓度。
[拉乌尔定律]1887年由拉乌尔(Roult)提出。内容是:在一定温度下,稀溶液中溶剂的饱和蒸气压等于纯溶剂的饱和蒸气压乘以溶剂的摩尔分数。可用公式表示:
pA=p0AxA
式中pA代表稀溶液中溶剂的饱和蒸气压,p0A代表纯溶剂的饱和蒸气压,xA代表溶液中溶剂的摩尔分数。
[亨利定律]1803年由亨利(Henry)指出。内容是:在一定温度下,当液面上的一种气体与溶液中所溶解的该气体达到平衡时,气体的平衡分压与被溶解的气体在溶液中的浓度成正比。可用公式表示:
p=Kxx
式中p为所溶解的气体在溶液液面上的平衡分压,Kx为比例常数,x为溶液中溶解的气体的摩尔分数。如果气体在溶液中的浓度以质量摩尔浓度(m)或体积摩尔浓度(c)表示,则亨利定律相应的数学表达式为:
p=Kmm
p=KCC
应注意以上三个式子中Kx≠Km≠Kc。亨利定律适用于稀溶液和气体分压不太大,且溶质在气相中和溶液中分子状态相同的情况。
[摩尔热容]使1摩尔物质温度升高1度所需要的热量,是该物质的摩尔热容。摩尔热容的单位是焦耳每摩尔开尔文,记作焦/摩·开,国际通用符号是J·mol-1·K-1。
[热力学标准态]化学热力学中,为计算各种物系的热力学函数而规定的特定状态,简称标准状态。指在一定温度下(一般是25℃(298.15K)),纯净物质处于101325帕斯卡(1大气压)时,若是多组分体系,所指定的组分活度应等于1,气体物质的分压应等于101325帕斯卡(1大气压)时的状态。
[标准状态]见热力学标准态条。
[化学平衡]可逆反应中正、逆反应速度相等,在温度和压力不变的情况下,反应物和生成物的浓度不再随时间而改态的状态。化学平衡是动态平衡,它受温度、压力和浓度的影响。
[化学平衡常数]系在一定温度下,可逆反应达到化学平衡状态时,生成物浓度的反应系数次幂的乘积与反应物浓度的反应系数次幂的乘积之比值,这个比值在一定温度下是个定值。例如对可逆反应:

用浓度表示的平衡常数为:

式中[A]、[B]、[C]、[D]代表平衡体系中各组分的浓度。
也可用各组分的摩尔分数计算平衡常数,以Kx表示(X代表组分的摩尔分数):
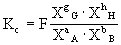
对于有气体参加和生成的反应,也可用各组分的分压计算平衡常数,以Kp表示:
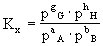
以上三种平衡常数可以进行如下换算:

式中R为气体常数、T为绝对温度、p为体系总压、△n=(g+h)-(a+b)。
[勒沙特列原理]又称平衡移动原理。1887年由法国化学家勒沙特列(Le chatelier)提出。其内容是:如果改变影响平衡的一个条件(如浓度、压力、温度等),平衡就向能够减弱这种改变的方向移动。比如,在温度、压力不变的条件下增加反应物的浓度或减少生成物的浓度,平衡朝正反应方向移动;在温度不变的情况下,对反应前后分子数有变化的气体反应,增大压力,平衡朝分子数减少的方向移动;在其它条件不变时,升高温度,平衡就朝吸热反应方向移动。勒沙特列原理在生产上有广泛的应用,利用这一原理选择适当的反应条件,可以提高产率、降低成本。
[范特荷甫等温方程]又称化学反应等温方程式。由荷兰物理化学家范特荷甫(Van′t Hoff)提出,假设有一理想气体的化学反应是:

此体系的自由能变为:
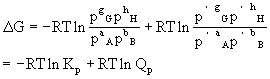
式中P代表该反应达到化学平衡状态时体系中各组分的分压,Kp代表平衡常数;而p′代表任意状态时反应体系中各组分的分压,Qp不是平衡常数,为区别起见,称Qp为“分压商”。用范特荷甫等温方程式可以判断在一定条件下,某化学反应进行的方向和限度。在等温等压除膨胀功不做其它功的情况下:
当Qp<Kp时,△G<0,正反应能自发进行。
当Qp>Kp时,△G>0,正反应不能自发进行,而逆反应能自发进行。
当Qp=Kp时,△G=0,反应达到平衡状态。
若反应体系中的气体不遵守理想气体规律,则应当用逸度(f)来代替压力,则化学反应等温方程式为:
△G=-RTlnKf+RTlnQf
如果反应是在稀溶液中进行,则化学反应等温方程式为:
△G=-RTlnKc+RTlnQc
式中Kc为浓度平衡常数,Qc为“浓度商”。
对在非理想溶液中进行的化学反应,应以活度(a)来代替浓度,即:
△G=-RTlnka+RTlnQa
[玻恩-哈伯循环法]由玻恩(Born)和哈伯(Haber)提出的求某一过程能量变化的方法。此法建立在热力学第一定律的基础上,根据某过程总的能量变化等于各个分过程能量变化的总和的原理,把某个变化过程设计成由若干个分过成组成的热力学循环,即玻恩-哈伯循环。这样,就可以根据已知的一些能量变化求出其中某一过程的能量变化。以求NaCl的晶格能为例,设计出生成氯化钠晶体的热力学循环:

其中各个过程的能量变化是:△H生成=411.0kJ·mol-1,为NaCl晶体的生成热;S=108.8kJ·mol-1为晶体钠的升华热;I=493.29kJ·mol-1为
E=-361.9kJ·mol-1为氯原子的电子亲和能;U晶格能为NaCl的晶格能是未知量。根据热力学第一定律可得出关系式:
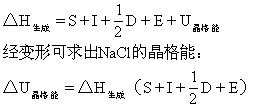
=-411.0-(108.8+493.29+119.7-361.9)
=-770.9kJ·mol-1
[晶格能]在298.15K和101325Pa(1大气压)下,由相互分离的气态阳离子和气态阴离子,生成1摩尔离子晶体时所释放的能量。晶格能可以衡量离子晶体中离子键的强弱和晶体的热稳定性。晶格能可以通过热化学实验间接测定,还可以通过热化学循环计算(见玻恩-哈伯循环法)以及根据静电吸引理论计算。
[转化率]某反应体系达到化学平衡状态时,其中某个指定反应物的转化率是该物质在达到平衡时已转化的量占反应起始时该物质总量的百分率。可用下式进行计算:

(式中“量”可用质量,也可用物质的量。)
[原子]由希腊词义“不可分”衍化来的。原子是元素能够存在的最小单位,是化学变化中的最小微粒。原子是由原子核和核外电子组成的。原子核由质子和中子组成。在化学反应中,只是核外电子发生了变化,原子核的组成并没有改变。在核反应中,原子核发生了变化,原子变成了其它元素的原子。
[原子核]由质子和中子组成的带正电荷的微粒。原子核所带的正电荷数(核电荷数)等于核内质子数。原子的质量主要集中在原子核上,原子核的体积只占原子体积的几千亿分之一。原子核内的质子和中子由结合能结合在一起。
[质子]原子核的组成部分,是原子核中带正电荷的基本粒子。元素的原子序数就是核内的质子数。质子的质量是1.67265×10-27千克,即1.00728原子质量单位。
[中子]原子核中不带电的基本粒子。质量是1.67495×10-27千克,即
[电子]原子中带负电的微粒。质量是9.11×10-31千克,半径是2.82×10-15米。原子由原子核和核外电子组成,核外电子数与质子数相等。原子中的电子受到外来能量的激发能脱离原子核的束缚,以电流形式通过导体、电子管或半导体。放射性核如镭能以β-粒子的形式放出电子。
[基本粒子]泛指比原子核还小的物质单元。包括光子、电子、质子、中子以及在宇宙射线和高能物理实验中发现的一系列粒子。现已发现的基本粒子有几百种,并分为轻子(如电子、正电子、中微子等)和强子(如质子、中子、介子等)两大类。许多基本粒子都有对应的反粒子。
[反粒子]许多基本粒子如电子、质子、中子、中微子、介子、超子等,都有对应的正电子、反质子、反中子、反中微子、反介子、反超子等,这些对应的粒子总称为反粒子。
[亚原子粒子]指小于原子的粒子,即基本粒子或原子核。
[原子实]原子中,原子核及除价电子以外的内层电子组成原子实。例如,钠Na的核外电子排布为:1s22s22p63s1,其中第1、2电子层与原子核组成原子实,此原子实与氖Ne(1s22s22p6)的结构相同,钠的核外电子排布也可写作[Ne]3s1。钾K的电子排布为:1s22s22p63s23p64s1,也可写作[Ar]4s1。铜Cu为:1s22s22p63s23p63d104s1,也可写作[Ar]3d104s1。
[原子半径]通常指以实验方法测定的相邻两同种原子的核间距离的一半。原子的大小无严格边界,无法精确测定一个单独原子的半径。目前所使用的原子半径数据只有相对的、近似的意义。根据测定的方法不同,有三种原子半径数据:(1)共价半径:同种元素的两原子以共价键结合时,两核间距离的一半,称该元素原子的共价半径。(2)金属半径:金属晶体中,相邻两原子核间距离的一半,称该元素原子的金属半径。(3)范德华半径(简称范氏半径):在分子型晶体中,不属于同一分子的两个最接近的相同原子核间距离的一半,称该元素原子的范氏半径。一般说来,各元素的金属半径比共价半径略大,而范德华半径则比共价半径大得多。
[氢光谱]指氢原子的线状光谱。装有氢气的放电管,通过高压电流,氢分子分解为原子并受到激发,激发态氢原子中的电子,由高能级跃迁回低能级时,以发光形式释放能量。这种光通过棱镜时,可以看到几条分立的波长不同的谱线,即氢光谱。1913年丹麦物理学家玻尔(Bohr)首先用量子概念解释了这一现象。
[玻尔理论]由丹麦物理学家玻尔在1913年提出的阐明原子结构的初步理论。它的基础是两个基本假设:(1)核外电子沿一定轨道绕核运转,在稳定轨道上运动的电子不放出能量,也不吸收能量;(2)在一定轨道上运动的电子都具有一定的能量,这些能量具有量子化的特征,只能取某些由量子化条件决定的分立数值。这些不连续的能量状态称为电子的能级。玻尔理论冲破了经典物理学中能量连续变化的束缚,大胆地把量子概念引进原子结构理论,解释了用经典物理学无法解释的氢原子结构与氢光谱的关系。但玻尔理论未能认识电子运动的另一重要特征--玻粒二象性,未能完全摆脱经典物理学的束缚,以致认为核外电子运动也象宏观物体那样具有固定的轨道,在解释多电子原子的光谱时,遇到了难以解决的困难。这些问题直到量子力学建立后,才得到解决。
[玻尔轨道]玻尔理论中电子绕核运行的许多分立的轨道。在一定轨道上运动的电子都具有一定的能量,也称作能级。电子从外层轨道向内层轨道跃迁时,以发光形式释放能量,其能量变化具有量子化的特征。
[玻尔半径]在玻尔理论中,它是氢原子处于基态时,电子沿圆形轨道绕核运行的半径,其值为5.29177×10-11米,常用a0表示。在原子物理学中,a0也是一种长度单位。
[基态]微观粒子系统(如原子、原子核、或其它多粒子体系等)所具有的各种状态中能量最低的状态。此种状态为最稳定的状态。
[激发态]微观粒子系统当其内部能量高于基态能量时所处的运动状态。原子获得能量(如吸收光子)可处于激发态。激发态原子是不稳定的,一般将通过发射光子或与其它粒子发生作用而回复到基态。
[测不准原理]由德国物理学家海森堡(Heisenberg)提出。他认为微观粒子的某些成对的物理量不可能同时具有确定的数值,如位置和动量之间有以下测不准关系:

式中△x是确定位置的测不准量,△px是确定动量的测不准量,h是普朗克常数。上式表明,微观粒子位置测定得愈准确(△x愈小),则动量测 时间和能量也服从测不准关系,它的意义是微观粒子存在于某一能量状态的时间愈短,则这一能量的确定程度愈差。
时间和能量也服从测不准关系,它的意义是微观粒子存在于某一能量状态的时间愈短,则这一能量的确定程度愈差。
[测不准关系]见测不准原理条。
[波粒二象性]微观粒子的基本属性之一。它们有时显示出波动性(这时微粒性不显著),有时又显示出微粒性(这时波动性不显著),这种在不同条件下分别表现为波动性和微粒性的特征称为波粒二象性。1905年爱因斯坦(Einstein)提出的光子学说阐明了光的这一特征。1924年德布罗意(deBroglie)提出电子和其它实物粒子也具有波粒二象性的假说,这在1927年被实验证实。从此,在科学上就认为一切微观粒子都具有波粒二象性。粒子的质量或能量愈大,波动性愈不显著。所以,可认为宏观物体不具有波动性。[德布罗意波]由法国物理学家德布罗意(Louis Vi-ctor de Broglie)在1924年首先提出。他把当时已发现的光具有波粒二象性这一事实加以推广,预言一切微观粒子都具有波粒二象性,并提出著名的德布罗意公式:
λ=h/mv
式中λ为与质量为m,运动速度为v的实物微粒相应的波长。德布罗意波又称物质波。
[德布罗意公式]见德布罗意波条。
[量子]微观世界的某些物理量不能连续变化,只能以某一最小单位的整数倍发生变化,这个最小单位就称为该物理量的量子。例如,物质吸收或发射的能量只能是某一最小能量单位的整数倍,其能量量子的大小为hv(v为幅射频率,h为普朗克常数)。光的能量变化也具有量子化的特征,光的能量量子(光子或光量子)的大小也是hv。
[量子化]见量子条。
[量子论]量子力学的先驱,又称旧量子论。从普朗克在物理学中提出量子概念(1900年)开始,特别是在玻尔提出氢原子结构理论(1913年)后发展起来的。它在解释微观粒子运动中,引进了运动具有量子特征的条件,但未能完全摆脱经典物理学的束缚。它是探索微观粒子运动的初步理论,它的进一步发展导致量子力学的建立。
[量子力学]研究微观粒子(电子、质子、中子、原子、分子等)运动规律的理论,是现代物理学的基础理论之一。它是法国物理学家德布罗意、奥地利物理学家薛定谔(Erwin Schr dinger)、德国物理学家海森堡等人逐步建立和发展起来的。薛定谔方程是量子力学中描述微观粒子运动规律的基本方程,量子力学的建立对科学的发展有重要意义,它标志着人类对物质的认识从宏观世界进入到微观世界。
dinger)、德国物理学家海森堡等人逐步建立和发展起来的。薛定谔方程是量子力学中描述微观粒子运动规律的基本方程,量子力学的建立对科学的发展有重要意义,它标志着人类对物质的认识从宏观世界进入到微观世界。
[薛定谔方程]量子力学中研究微观粒子的基本方程,由奥地利物理学家薛定谔(Erwin Schr dinger)提出:
dinger)提出:

式中x、y、z为微观粒子(如电子等)的空间坐标,E是总能量,即电子的动能和势能之和,V为总势能,m是微观粒子的质量,h是普朗克常数,ψ是波函数。这一方程在量子力学中的地位就好象牛顿定律在经典力学中的地位同样重要。
[波函数]量子力学中表征微观粒子或其体系运动状态的函数。在原子中核外电子的运动状态就是用波函数ψ来描述的。ψ是薛定谔方程的解,是一个函数式。微观粒子(如电子)在空间某点出现的几率密度,跟波函数绝对值的平方│ψ│2成正比。
[原子轨道]在量子力学中是波函数的同义词。是指n、l、m(见主量子数、角量子数、磁量子数)具有一定值的波函数。每一个原子轨道都有一个相应的波函数。原子轨道又称原子轨道函数或原子轨函。
[原子轨函]见原子轨道条。
[几率]在数学上也称为“概率”、“或然率”。用来表示随机事件发生的可能性大小的一个量。必然发生的事件的几率为1,不可能发生的事件的几率为0,而一般随机事件发生的几率是在0与1之间(或0与100%之间)的一个数。因此,几率也可理解为“机会”的百分数。在现代原子结构理论中,常用来说明原子中核外电子在空间某处出现机会的多少。
[几率密度]指空间某处单位体积中出现的几率。在空间某一点,微观粒子(如电子等)出现的几率密度正比于波函数的绝对值的平方。在原子结构理论中,常用来说明原子中的电子在核外空间某处单位体积里出现机会的多少。
[电子云]是电子在核外空间出现几率密度分布的形象化描述法。也就是波函数的绝对值的平方│ψ│2在空间的分布的描述。电子云用小黑点表示,小黑点稠密的地方表示几率密度大,小黑点稀疏的地方表示几率密度小。电子云有时也用界面图表示,电子云的界面是一个等密度面,电子在界面以内的几率很大,而在界面以外的几率可以忽略不计。
[主量子数]表示电子在原子中运动状态的四个量子数之一,符号是n,是确定电子能量的主要量子数。它的取值是1、2、3、……等正整数,一般随着n值的增大,电子的能量随着增加,离核的平均距离也相应增大。在一个原子内,具有相同主量子数的电子,差不多在同样的空间范围内运动,所以,习惯上称主量子数相同的电子为一个电子层(或处于同一电子层)。常用K、L、M、N、O、P等符号分别表示n=1,2,3,4,5,6等电子层。
[电子层]见主量子数条。
[角量子数]表示电子在原子中运动状态的四个量子数之一,符号是l,是代表角动量的量子数,确定电子云的形状。当n值一定时,l只能取0,1,2,3……(n-1)等值。当l=0时,电子云的形状是球形对称的,用符号s表示,也称s亚层;当l=1时,电子云呈哑铃形,用符号p表示,也称p亚层;当l=2时,电子云常呈四瓣形,用符号d表示,也称d亚层;当l=3时,用符号f表示,也称f亚层,电子云形状更为复杂。在n=1的电子层中,l=0,只有一个亚层即1s亚层; n=2时, l=0,1,这时有两个亚层,即2s, 2p亚层;n=3时,l=0,1,2,这时有三个亚层,即3s,3p,3d。依此类推可知各电子层具有的亚层数目和种类。
[电子亚层]见角量子数条。
[磁量子数]表示电子在原子中运动状态的四个量子数之一,符号为m,确定电子云在空间的取向,是代表角动量在磁场方向的分量的量子数。当角量子数l值一定时,磁量子数m的取值为0,±1,±2,±3……±l,即有(2l+1)个数值。磁量子数有几个取值,就代表电子云在空间有几种取向,或者说有几个不同的轨道。例如,l=0时,m=0,表示s电子云无方向性,在空间只有一种取向,即只有一个轨道;l=1时,m=+1,0,-1,表示p电子云在空间有三种取向,即有三个轨道;l=2时,m=+2,+1.0,-1,-2,表示d电子云在空间有五种取向,即有五个轨道;余类推。
[等价轨道]又称简并轨道,指能量相等的原子轨道。例如n=2时的三个p轨道,2px,2py,2pz;其它如在主量子数相同时的五个d轨道,七个f轨道等,都是等价轨道。
[简并轨道]见等价轨道条。
[自旋量子数]表示电子在原子中运动状态的四个量子数之一,符号为ms,确定电子的自旋方向,是代表电子自身相反的两种运动的量子数。它仅
[能级]微观粒子系统在定态中只能处于一系列不连续的、分立的能量状态。按这些状态的能量由低到高加以排列即组成能级。在原子体系中,能级的高低主要由主量子数决定,但在多电子原子中又会出现能级交错现象(见能级交错)。在分子轨道理论中,认为原子轨道组成分子轨道,分子轨道也按能量分为若干能级。
[屏蔽效应]在多电子原子中,将其它电子对某个指定电子的排斥作用归结为,核电荷吸引电子的作用受到抵消,这种效应叫屏蔽效应。这样,对指定电子来说,它所受到核的作用,可以看成是具有核电荷(Z-σ)的核的作用。Z是核电荷,σ是屏蔽常数,(Z-σ)是有效核电荷。一般说来,内层电子对外层电子的屏蔽效应较大,同一层电子之间屏蔽效应较小;外层电子对内层电子的屏蔽效应很小,可忽略不计。
[有效核电荷]见屏蔽效应条。
[钻穿效应]在多电子原子中,在核附近出现几率较大的电子,可以较好地避免其他电子的屏蔽作用,受到较大的有效核电荷的吸引,因而能量较低。这种现象称为钻穿效应。钻穿效应主要是由于电子出现的几率径向分布不同形成的。钻穿效应不仅能解释n相同,l不同时轨道能量的高低;而且可以解释当n和l都不同时,有的轨道发生的能级顺序交错的现象。
[能级交错]在多电子原子中,当原子处于基态时,主量子数较大的某些轨道的能量反而低于主量子数较小的某些轨道的能量的现象。例如,从第4周期开始,4s轨道能量反比3d轨道能量低,按能量最低原理,电子应先填充4s轨道,然后再填充3d轨道。产生能级交错的原因比较复杂,可能跟屏蔽效应、钻穿效应及其它影响轨道能量的因素有关。
[泡利不相容原理]1925年由奥地利物理学家泡利(Pauli)提出。原理指出,在同一原子中不可能有四个量子数完全相同的电子,即每个原子轨道最多只能容纳两个电子,并且这两个电子的自旋必须相反。从而可得出,第n层电子最多能容纳的电子数是2n2个。
[能量最低原理]在不违背泡利原理的情况下,核外电子总是尽先排布在能量最低的轨道上,只有当这些轨道占满后,电子才依次进入能量较高的轨道。在多电子原子中,电子能量的高低与主量子数n和角量子数l有关。当n≥3时,出现能级交错现象(见能级交错)。
[洪特规则]也称等价轨道原则。由德国物理学家洪特(Hund)提出。在同一亚层的各个轨道上排布的电子,总是尽先分占不同的轨道,并且自旋方向相同。这样,整个原子的能量最低。洪特规则也有特例,等价轨道在全充满(P6、d10、f14)、半充满(p3、d5、f7)、全空(p0、d0、f0)时,原子结构比较稳定。例如,24Cr的电子排布式是1s22s22p63s23p63d54s1;29Cu的电子排布式是1s22s22p63s23p63d104s1。
[电子排布式]表示原子核外电子排布的式子。可清楚地表明各亚层中的电子数目。例如17Cl的电子排布式是1s22s22p63s23p5。
[轨道表示式]表示原子核外电子在各亚层、各轨道中排布的式子。能清楚地反映核外电子排布的规律。例如,7N的轨道表示式是:

[电离能]指从基态的气态原子、离子或分子,失去一个电子所需要的能量叫电离能,以千焦·摩尔-1为度量单位。元素的第一电离能指元素的基态的气态原子失去一个电子变为气态+1价阳离子所需要的能量。元素第一电离能的数值随原子序数的递增呈现周期性的变化。
[电子亲合能]指基态的气态原子、离子或分子得到一个电子所释放的能量。元素的电子亲合能指元素的气态原子得到一个电子变为气态-1价阴离子所释放的能量。从电子亲合能数据可以判断元素的原子得电子的难易。非金属元素一般具有比较大的电子亲合能。因此,非金属元素的原子比金属元素的原子容易得电子。
[电负性]分子中原子对成键电子吸引能力的相对大小的量度。目前有三套电负性数据:鲍林(Linus Pauling)电负性,用xp表示;密立根(Mulliken)电负性,用xM表示;阿莱-罗周(Allred-Rochow)电负性,用xA表示。三套电负性数据,是在不同的基础上计算出来的,因此它们的数值不完全相同,但都能反映元素的原子在化合物中吸引电子的能力。
[质能关系式]物质的质量m,与其能量E之间的关系式:E=mc2,式中c为真空中的光速。这是20世纪初爱因斯坦(Einstein)提出的狭义相对论的一个重要结论。由质能关系式可以看出,当物体的能量发生改变时,其质量也有相应的变化。运用这一关系可以解释原子核的质量亏损现象,认识到在原子核内蕴藏着巨大的能量,可以通过核反应加以利用。
[质量亏损]原子核的质量小于它所含各核子独自存在时的总质量,这两种质量的差额称为质量亏损。质量亏损说明,当核子集合组成原子核时要释放出结合能(即使核分解为质子和中子时所需要的能量)。它的数值越大,原子核就越稳定。
[离子]带电荷的原子或原子团。由原子、原子团或分子失去或得到电子时形成的。失去电子时形成带正电荷的阳离子(正离子),如H+、Na+、 等。离子存在于离子化合物中,也存在于溶液中(和溶剂分子相结合),还存在于气体中。离子的性质与电中性的原子、原子团、分子的性质完全不同。
等。离子存在于离子化合物中,也存在于溶液中(和溶剂分子相结合),还存在于气体中。离子的性质与电中性的原子、原子团、分子的性质完全不同。
[阳离子]见离子条。
[正离子]见离子条。
[阴离子]见离子条。
[负离子]见离子条。
[离子半径]又称离子有效半径,是通过实验测定的。一般认为的离子半径是:离子晶体中相邻的两个正负离子的核间距是正负离子的半径之和。若核间距为d,则d=r++r-(r+,r-分别代表正负离子的半径)。已知一个离子的半径和核间距,就可以求出另一离子的半径。原子失去电子形成的阳离子的半径比其原子半径小,如Na原子半径为 1.537×10-10米,而Na+离子半径为0.95×10-10米。原子得到电子形成的阴离子的半径比其原子半径大,如Cl原子半径为0.99×10-10米,而Cl-离子的半径为1.81×10-10米。
[离子构型]指离子的外围电子构型。是离子的重要特征。离子构型主要可分为以下几种类型:(1)惰气型,即与惰性元素原子的核外电子排布相同。其中有He型,如Li+(ls2)、Be2+(is2)等;Ne型,如F-(2s22p6)、Na+(2s22p6)、Mg2+(2s22p6)等;Ar型,如Cl-(3s23p6)、K+(3s23p6)等。(2)18电子型,最外层为18个电子的离子,如Zn2+(3s23p63d10)、Ag+(4s24p64d10)等。(3)18+2电子型,次外层为18个电子,最外层为2个电子的离子,如Sn2+(4s24p64d105s2)、Pb2+(5s25p65d106s2)等。(4)不规则型,最外层有9-17个电子的离子,如Fe3+(3s23p63d5)、Cu2+(3s23p63d9)等。
[离子的极化作用]电荷相反的离子相互接近时就有可能发生极化,即它们在相反电荷的电场的影响下电子云发生变形。离子使异号离子极化而变形的作用称为该离子的极化作用。离子极化作用的大小跟离子所带电荷的多少、离子半径大小及离子构型有关。一般离子所带电荷数越大,半径越小,外层电子的屏蔽作用越小,离子的极化作用就越大。通常阳离子的极化作用较强,因此在多数情况下应考虑阳离子对阴离子的极化作用。有的阴离子对阳离子也有显著的极化作用,而阳离子被极化后又对阴离子产生更强的极化作用。这样反复作用叫做离子的相互极化作用或附加极化作用。离子的极化对化合物的键型、溶解度、熔点、颜色及化学稳定性都有一定的影响。
[离子的变形性]离子被异号离子极化而发生电子云变形的性能称为该离子的变形性或可极化性。离子变形性的大小主要和离子半径、离子的电子构型有关。最容易变形的是半径较大的阴离子和18电子外壳或不规则电子外壳的带电荷少的阳离子,如Ag+、Hg2+等。最不容易变形的是离子半径小,带电荷多的惰气型阳离子,如Be2+、Al3+等。
[相互极化作用]见离子的极化作用条。
[化学键]在分子、原子团或晶体中,相邻的两个或多个原子之间的强烈的相互作用叫做化学键。化学键有三种基本类型:离子键、共价键(包含配位键)、金属键。化学键的强度可用键能表示,一般约在125-840千焦·摩尔-1之间。
[离子键]又称电价键,系由原子得失电子后生成的阴阳离子之间通过静电作用所形成的化学键。例如氯化钠晶体中Na+和Cl-之间就是靠离子键结合在一起的。由于离子的电荷分布是球形对称的,只要空间条件许可,就可以从不同方向同时吸引几个带相反电荷的离子。离子键的特征是既没有方向性又没有饱和性。
[电价键]见离子键条。
[离子化合物]以离子键相结合而形成的化合物。如氯化钾KCl、氧化钙CaO等。离子化合物一般以离子晶体的形式存在。
[离子型分子]当离子键存在于气态分子中,这种独立的分子称做离子型分子。例如在氯化钠蒸气中,就存在着由一个Na+和一个Cl-组成的氯化钠分子NaCl。这种情况较为少见。
[共价键]原子间通过共用电子对(电子云重叠)所形成的化学键。例如,两个氢原子共用一对电子形成氢分子H2:H:H;两个氮原子共用三对
[共价单键]原子间共用一对电子形成共价单键。例如H2分子中的共价键。
[共价双键]原子间共用两对电子形成共价双键。例如CO2分子中,碳原子和氧原子之间以共价双键结合:

[共价叁键]原子间共用三对电子形成共价叁键。例如N2分子中的共价键。
[共价化合物]元素的原子以共价键相结合而形成的化合物。例如:水
[配位键]两原子间的共用电子对是由一个原子单独提供而形成的共价键。它和一般的共价键的区别仅在于提供电子对的方式不同。在形成配位键时电子给予体具有孤对电子,而电子接受体具有空轨道。例如氨分子NH3中N原子有一对孤对电子,而氢离子H+有空轨道,它们可以通过配位键结合形成
[键长]表征价键性质的参数之一,是分子中两个成键原子的核间矩。一般键长越短,键就越强。
[键角]表征价键性质的参数之一,系分子中键和键之间的夹角。键角是决定分子几何构型的重要因素。例如在水分子H2O中,两个O-H键的键角是104°45′,这就决定了水分子的折线形结构。
[键能]表征价键性质的参数之一,在给定条件下,对气态物质断开1摩尔键,使成键原子变为气态原子时所需的能量。键能表示化学键的强度,键能越大,键越牢固,含有该键的分子越稳定。
[键矩]将极性键(见极性共价键)的正电荷重心作为正电中心,负电荷重心作为负电中心,所带电荷分别为+q和-q,两中心间的距离为d,则q和d的乘积就是键矩μ,用下式表示:
μ=qd
键矩是矢量,其方向定为从正电中心到负电中心,单位为德拜(Debye),用D表示。键的极性可用键矩来量度,μ愈大键的极性愈强。
[键级]分子轨道法中表示相邻的两个原子成键强度的一种数值。对双原子分子来说,把成键电子数与反键电子数的差值的一半,称为键级。在形成共价键时,成键轨道上的电子称为成键电子,它使体系的能量降低,有利于形成稳定的键;反键轨道上的电子称作反键电子,它使体系的能量升高,不利于形成稳定的键。可见,键级是衡量化学键相对强强的参数,键级愈大,键愈稳定,若键级为零,则不能成键。
[极性共价键]简称极性键。由于成键的两个原子的电负性不同,共用电子对必然偏向电负性较大的一方,使键具有极性,因此,这种键叫极性键。例如,在氯化氢HCl分子中,H-Cl键是极性键,共用电子对偏向氯原子。极性键极性的大小可用键矩来量度(见键矩条)。
[非极性共价键]简称非极性键。存在于单质分子中。由于成键的两个原子的电负性相同,共用电子对处于两核之间,没有偏移,电子云均匀分布。这种两个原子间共用电子对无偏向的共价键叫非极性共价键。例如,在H2分子、Cl2分子中的H-H键、Cl-Cl键都是非极性键。
[金属键]在金属晶体中,金属原子容易丢失电子,形成正离子,因此金属晶体中,晶格结点上存在着大量金属正离子,而在晶格中还存在着大量的“自由电子”,金属离子和自由电子之间存在的较强作用,叫金属键。金属键又称改性共价键,因为它可以看成许多原子共用许多电子的一种特殊形式的共价键,但又和共价键不同,金属键不具有饱和性和方向性。
[分子间作用力]又称范德华(Van der Waals)力。是物质分子间存在着的作用力,无方向性,无饱和性。是短程作用力,其范围约3-5×10-10米。分子间作用力比化学键的键能要弱得多,比化学键的键能小一、二个数量级。分子间作用力有取向力、诱导力和色散力三种,一般以色散力为主。分子间作用力是决定分子型物质的熔点、沸点、气化热、熔化热以及溶解度、表面张力、粘度等物理化学性质的主要因素。
[色散力]分子间作用力的主要成分。色散力普遍存在于各种分子之间。由于分子中电子不断运动和原子核的不断振动,经常发生电子云和原子核之间的瞬时相对位移,因而产生了瞬时偶极。瞬时偶极虽然存在的时间极短,但总是不断地出现。这种由瞬时偶极产生的分子间作用力叫色散力。色散力的大小和分子的变形性、电离势以及分子间的距离有关。
[取向力]分子间作用力的一种。存在于极性分子和极性分子之间。当两个极性分子相互接近时,一个分子带负电的一端要和另一个分子带正电的一端接近,使极性分子有按一定方向排列的趋势。这种由极性分子的取向而产生的分子间作用力叫取向力。取向力的本质是静电引力,取向力的大小和分子的偶极矩(见偶极矩)的大小、温度及分子间的距离有关。
[诱导力]分子间作用力的一种。存在于极性分子与非极性分子之间以及极性分子和极性分子之间;离子和分子以及离子和离子之间。当极性分子和非极性分子接近时,极性分子的偶极使非极性分子极化而产生诱导偶极,这种由于诱导偶极而产生的作用力叫诱导力。极性分子之间,离子和分子以及离子和离子之间也会产生诱导力。诱导力的大小和分子的偶极矩、变形性及分子间距离有关。
[氢键]在含氢化合物中,由一个与电负性极强的元素(如F、O、N)相结合的氢原子和另一个电负性极强带孤电子对且原子半径小的原子(F、O、N等)间产生的引力形成的。氢键的键能比化学键的键能小得多,但和范德华力相近,也可以说氢键是另一种分子间作用力,它具有饱和性和方向性。氢键可分为分子间氢键,如水中的氢键以及分子内氢键,如硝酸分子内的氢键:
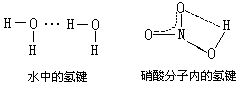
[分子的极化]在外电场作用下,分子中正、负电荷中心发生分化的过程。由于外电场影响了分子中电荷的分布,使电子云与核发生了相对位移,分子发生变形,从而造成分子中正、负电荷中心的分化。非极性分子由于极化可产生极性,极性分子由于极化可使极性增强。
[偶极矩]是衡量分子极性大小的物理量。物理学中,把大小相等、符号相反、彼此相距为d的两个电荷(+q和-q)组成的体系称为偶极子,其电量与距离之积就是偶极矩(μ)。
μ=qd
偶极矩是矢量,其方向系沿两电荷连线由正到负。极性分子就是偶极子,对分子中正负电荷,可以设想它们分别集中于一点,叫正电荷中心和负电荷中心。极性分子的偶极矩等于正负电荷中心的距离乘以正电中心(或负电中心)的电量,其方向由正到负。
[永久偶极]又称固有偶极。指极性分子本身具有的偶极。这是由于极性分子中电荷分布不均匀,正电荷重心与负电荷重心不重合造成的。每个极性分子就是一个偶极子。
[固有偶极]见永久偶极条。
[诱导偶极]分子在外电场的作用下,正、负电荷重心分化而产生的偶极叫做诱导偶极。
[瞬时偶极]由于分子中电子和原子核的不断运动,经常发生电子云与核之间的瞬时位移而产生的偶极,称作瞬时偶极。这种现象是不断消失又不断发生的,时间虽短暂,但经常存在。
[八隅规则]1916年由美国物理化学家G.N.路易斯(G.N.Lewis)提出。原子相互作用形成离子或分子时,趋于形成外层为8个电子的惰性元素的构型,这通常称作八隅规则。例如,氯和钠通过得失电子形成离子化合物氯化钠,其中Na+离子和Cl-的电子排布都是惰性元素的构型。此外,在两个氯原子形成的氯气分子或一个氢原子和一个氯原子形成的氯化氢分子中原子之间通过共用电子对而形成惰性元素的电子构型。
[现代价键理论]又称电子配对理论或电子配对法,简称VB法(Valence Bond Theory)。基本要点如下:(1)原子带有未成对且自旋相反的电子相互接近时,核间电子云密度较大,可形成稳定的化学键。(2)共价键有饱和性,一个原子有几个未成对电子,就能和几个自旋相反的电子配对成键,未成对电子都配对成键就达到饱和。(3)共价键有方向性,即共价键尽可能沿着原子轨道最大重叠的方向形成,这也叫做“最大重叠”原理。轨道重叠越多,电子在两核间出现的几率就越大,形成的共价键就越稳定。现代价 等)遇到了困难。这些问题由于分子轨道理论的建立才得以解决。
等)遇到了困难。这些问题由于分子轨道理论的建立才得以解决。
[电子配对法]见现代价键理论条。
[杂化轨道理论]由美国化学家鲍林(L.Pauling)及斯莱脱(J.C.Slater)在电子配对法的基础上提出。它的要点是:同一原子中能量相近的原子轨道,在成键时重新组合成一系列能量相等,成键能力更强的新轨道。这就叫原子轨道的杂化,形成的新轨道称做杂化轨道。杂化轨道理论解释了许多用电子配对法不能解释的分子的几何构型和稳定性的事实(详见有机部分)。
[分子轨道理论]又称分子轨道法(Molecular OrbitalTheory)或MO法,1932年由美国化学家密立根(R.S.Mul-liken)及德国物理学家洪特(F.Hund)提出。是现代共价键理论之一。它的要点是:从分子的整体性来讨论分子的结构,认为原子形成分子后,电子不再属于个别的原子轨道,而是属于整个分子的分子轨道,分子轨道是多中心的;分子轨道由原子轨道组合而成,形成分子轨道时遵从能量近似原则、对称性一致(匹配)原则、最大重叠原则,即通常说的“成键三原则”;在分子中电子填充分子轨道的原则也服从能量最低原理、泡利不相容原理和洪特规则。
[分子轨道]分子中描述单电子运动状态的波函数即为分子轨道,分子轨道由原子轨道线性组合而成,原子轨道形成分子轨道时遵从“成键三原则”。
[成键分子轨道]能量相近的原子轨道组合形成的分子轨道中,比原子轨道的能量有所降低的叫做成键分子轨道。在成键分子轨道中,两核间电子出现的几率增大,其能量比原子轨道中能量较低的还低,因此有利于化学键的形成。
[反键分子轨道]能量相近的原子轨道组合形成的分子轨道中,比原子轨道的能量有所升高的称反键分子轨道。在反键分子轨道中,两核间电子出现的几率减小,甚至为零,其能量比原子轨道中能量较高的还高,因此不利于化学键的形成。反键轨道通常以“*”号标记。
[成键三原则]指原子轨道组合形成分子轨道时所遵从的能量近似原则、对称性匹配原则和轨道最大重叠原则。
[单电子键]只有一个电子的共价键。如氢分子离子H+2中,两个氢原子间共用一个电子而形成的共价键。H+2中虽然没有电子配对,但却有明显的键能DH+2=269kJ·mol-1。
[三电子π键]O2分子中电子在分子轨道中的排布如下,O2[KK(σ2s)2(σ2s*)2(σ2p)2(π2p)4(π2p*)2]。除已充满的低能级的成键轨道和反键轨道基本抵消外,成键的(σ2p)2构成一个σ键;因成键的π轨道和反键的π轨道在空间方位一致,因此成键的(π2pv)2和反键的(π2p*)1构成一个“三电子π键”,成键的(π2p)2和反键的(π2p*z)1构成另一个“三电子π键”。O2的结构又可表示为:

O2分子中每个三电子π键中仍各有一个未成对电子,所以O2是顺磁性
[缺电子原子]具有共价性的原子,若其价电子(见价电子条)数少于价电子层的轨道数时,称这种原子为缺电子原子。例如,硼B原子,因半径较小,电负性较大,而表现出共价性;其价电子为2s2p1,共3个,但第二电子层有4个原子轨道2s、2px、2py、2pz,硼原子就是缺电子原子。
[缺电子化合物]缺电子原子以共价键形成的不具有八隅体结构的化合物,称作缺电子化合物。例如,硼的一些化合物就是缺电子化合物,卤化硼BX3、硼烷B2H6、硼酸H3BO3等就是缺电子化合物,缺电子化合物一般可做电子接受体。
[价电子]指原子在参加化学反应时能够用于成键的电子。主族元素的价电子就是最外层电子,对过渡元素来说,价电子指最外层的s电子和次外层的d电子,甚至还有倒数第三层的f电子。
[等电子原子]在价电子层中,价轨道数等于价电子数的原子。例如,H、C、Si等原子。
[多电子原子]在价电子层中,价电子数多于价轨道数的原子。例如,N、O、S、Cl等原子。
[孤电子对]也称孤对电子。指分子或离子中某原子的最外层未共用的电子对。例如,NH3分子中,N原子有一个孤电子对;H2O分子中,O原子上有两个孤电子对:

N、O原子都是多电子原子,H原子是等电子原子,因此在NH3分子和H2 O分子中都有孤电子对。
[孤对电子]见孤电子对条。
[价电子对互斥(VSEPR)理论]该理论最初由西奇威克(Sidgwiek)和鲍威尔(Powell)提出,以后吉林斯比(Gil-lespie)和宁荷姆(Nyholm)发展了这一理论。它的概念非常简单,不需要用原子轨道的概念,就能较好地判断许多共价分子的几何构型。价电子对互斥理论认为在一个共价分子中,中心原子周围电子对排布的几何构型主要决定于中心原子的价电子层中的电子对数,价电子对包括成键的σ电子对和孤电子对。分子的几何构型总是采取彼此间排斥力最小的结构,因为这样能量最低。根据价电子对互斥理论,得出理想的几何构型如下:
电子对数 几何构型
2 直线型
3 平面三角形
4 四面体
5 三角双锥
6 八面体
在分子中,孤对电子和成键电子之间静电排斥作用大小的顺序如下:
孤对-孤对>孤对-成键对>成键对-成键对
例如,在CH4 、NH3 、H2 O分子中:CH4 无孤对电子,而C-H键是相同的,所以CH4 分子是正四面体形;NH3 分子中N有一对孤对电子,它对N-H键有较大的排斥作用,所以NH3分子中N-H键之间的夹角为107°18′;H2O分子中O有两对孤对电子,它们对O-H键的排斥力更大,所以H2O分子中O-H键间的夹角是104°45′。由此可见,对简单分子AXn Er(A代表中心原子,X代表以共价键和A结合的配位体、n代表配位体的数目,E代表孤对电子,r代表孤对电子数)的几何构型就能简便地作出判断:AX4 一定是正四面体形,AX3 E一定是三角锥形,AX2 E2 一定是折线型。此外,根据具有最少数目的、角度最小的孤电子对-孤电子对排斥作用的构型最稳定的原则,还可判断其它分子的几何构型,例如,在XeF4 分子中,有六对价电子,所有价电子呈八面体形,而中心原子Xe与四个氟原子处于同一平面形成平面正方形的构型是最稳定的。
[特征电子构型]表示原子的电子层结构特性的式子,也称外围电子。根据元素原子的特征电子构型,元素周期表可划分为四个区:s区、p区、d区、f区(见周期表的分区条)。
[晶体]具有一定几何多面体形状的固体。以分子、离子或原子为质点在三维空间有规则地排列而成。晶体具有固定的熔点和各向异性。根据构成晶格质点的不同,晶体分为离子晶体、原子晶体、分子晶体和金属晶体四种类型。根据晶粒的取向不同,晶体又分为单晶体和多晶体。
[晶格]构成晶体的质点(分子、原子、离子)在空间的确定点上有规律地重复排列所构成的点阵结构。
[晶胞]晶格中含有晶体结构中具有代表性的最小部分。晶胞在空间无限地周期性的重复就成为晶格。
[晶系]根据晶胞的几何构型对晶体进行分类,晶体划分为七大晶系,一种晶系的性质用晶胞的边长(a、b、c)及夹角(α、β、γ)描述。七大晶系是:立方晶系、四方晶系、正交晶系、单斜晶系、三斜晶系、菱形晶系和六方晶系。在同一晶系中又有不同的晶格类型,共十四种晶格类型:简单立方、体心立方、面心立方、简单四方、体心四方、简单斜方、底心斜方、体心斜方、面心斜方、简单单斜、底心单斜、三斜、菱形、六方。
[无定形体]无晶体结构,内部质点在三维空间不规则排列,不具有一定几何多面体形状的固体。它和晶体不同,没有固定的熔点和各向异性。如石蜡、玻璃等。有的固体,因其结晶的取向是无序的,也称无定形态,如无定形碳,若用X-射线研究其结构可以发现它是由许多微小的石墨晶体构成的。
[离子型晶体]晶体的一种,组成晶格的质点是正、负离子。正、负离子间以离子键结合,每个离子周围被异号离子包围,它们有一定的比例关系和一定的排列顺序。例如,在氯化钠晶体中,每个钠离子被六个氯离子包围,每个氯离子被六个钠离子包围,交替延伸为整个晶体,在氯化钠晶体中不存在单个分子。离子型晶体有较高的熔点、沸点;有一定的硬度但较脆;易溶于极性溶剂,特别是水中;在熔化状态或极性溶剂中发生电离,因而具有导电性,晶体不导电。
[原子型晶体]也称共价型晶体,晶体的一种。组成晶格的质点是原子。原子间以共价键结合,结合力很强且形成空间网状结构。例如,金刚石中,碳原子形成sp3 杂化轨道,以共价键彼此相连,每个碳原子都处于正四面体的中心,组成整块晶体。在原子晶体中不存在单个小分子。原子晶体的熔点、沸点、硬度都比离子晶体高,不导电,在大多数常见的溶剂中不溶解,无延展性。常见的原子型晶体有金刚石、晶体硅、灰锡、锗、硼等单质。有一些化合物,如碳化硅SiC、氮化铝AlN、二氧化硅SiO2 等也是原子型晶体。
[金属型晶体]晶体的一种。组成晶格的质点是金属原子、金属离子和自由电子。质点间的作用力是金属键。金属晶体有三种特有的坚实结构:面心立方紧密堆积晶格、配位数是12;体心立方紧密堆积晶格,配位数是8;六方紧密堆积晶格,配位数是12。金属型晶体一般熔点、沸点高(部分低熔点金属除外,如汞Hg、镉Cd等),硬度较大,有金属光泽、良好的导热性、导电性和机械加工性能。
[分子型晶体]晶体的一种。组成晶格的质点是分子。例如,固态氧O2 、干冰CO2 ,固态氩Ar、冰H2 O等。在分子晶体内,分子间以范德华力相结合,由于结合力弱,分子晶体一般熔点、沸点低、硬度小、易挥发,通常状况下是电的不良导体。
[过渡型晶体]指介于原子晶体、金属晶体、分子晶体之间的一种过渡型。例如,石墨晶体,在晶体内碳原子以sp2 杂化形成共价键,每个碳原子与另外三个碳原子以共价键相连,六个碳原子在同一平面上形成正六边形的环,伸展形成层状结构,在同一平面的碳原子各剩一个p轨道,上有一个电子,这个电子比较自由,相当于金属中的自由电子。石墨晶体中层与层之间以范德华力结合。属于过渡型晶体的还有黑磷、云母(一种天然硅酸盐)等。
[同质多晶]同一种物质在不同条件下形成不同的结晶,称同质多晶现象。例如,单质硫在不同条件下可以形成不同的晶型。
[异质同晶]不同的物质,具有相同的晶体结构,称异质同晶现象。如氯化钾KCl、氧化镁MgO晶体都是NaCl型晶体。
[类质同晶]有一些组成不同,但化学性质类似的物质能够生成外形完全相同的晶体,称类质同晶现象,例如,明矾[KAl(SO4 )2 ·12H2 O]和铬矾[KCr(SO4 )2 ·12H2 O]都形成八面体结晶,硫酸镁(MgSO4 ·7H2 O)和硫酸镍也是类质同晶物质。
[能带]晶体中的电子,在一定能量范围内的许多能级(用彼此相隔很近的一条条水平横线表示)形成的一条带,形象地称为能带。各种晶体的能带数目和宽度都不相同。完全被电子占据的能带称作“满带”(其中的电子不能导电);部分被电子占据的能带称作“导带”(其中的电子能导电);完全未被占据的能带称作“空带”。价电子所占据的能带称作“价带”。能量比价带低的各能带一般是满带,价带可以是满带,也可以是导带。如在金属中价带是导带,故金属能导电;在绝缘体和半导体中,价带是满带,所以它们不能导电,但半导体很容易受其它因素的影响,使价带中的电子数目减少,或使空带中出现一些电子而成为导带,因而也能导电。
[等电子体]具有相同电子数的分子或离子称等电子体。例如,都含有14个电子的CO和N2 两种分子,就是等电子体。在一般情况下,等电子体在分子轨道中的电子排布和成键情况是相似的,这一规律称作等电子原理。由于等电子体具有相似的结构,所以在性质上也有许多相似之处。如:
CO N2
分子量 28 28
熔点(K) 73 63
沸点(K) 83 77
液体密度(g·cm-3 ) 0.793 0.796
另外,如NO-3 和CO23- 也是等电子体或称等电子离子,它们的几何构型都是平面三角形;PO34- 、SO24-、ClO-4 三种等电子离子的几何构型都是正四面体。
[等电子原理]见等电子体条。
[等离子体]亦称等离子态。气体被加热到很高的温度或被辐射后,使原子呈电离态,整个气体将成为带正电的离子和带负电的电子所组成的集合体,而且正负电量相等,这就叫做等离子体。象火焰和电弧中的高温部分,太阳和其它恒星的表面气层等都是等离子体。
[元素周期律]指元素性质随原子序数的递增呈周期性变化的规律。元素性质的周期性变化实质上是由原子的电子层结构的周期性变化决定的。元素周期律是1869年俄国化学家门捷列夫(Meндeлeeв)在前人研究成果的基础上提出的,当时认为,元素的性质随着原子量的递增而呈周期性变化。现在,根据现代原子结构理论对元素周期律的本质有了更深刻的认识,这样才把元素周期律修正为现在的形式,同时对元素周期表也作了许多改进。
[元素周期系]根据元素周期律把化学元素组织在一起所形成的完整体系,叫做化学元素周期系。
[元素周期表]根据元素周期律,把现在已知的107种元素中电子层数目相同的各种元素,按原子序数递增的顺序从左到右排成横行,再把不同横行中最外电子层的电子数相同的元素(或外围电子构型相似的元素)按电子层数递增的顺序由上而下排成纵行。这样得到的表,叫元素周期表。元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
[原子序数]元素周期表中按元素核电荷数由小到大的顺序给元素编号,这种序号叫做元素的原子序数。原子序数在数值上等于元素的核电荷数(即质子数)。
[周期]在元素周期表中,具有相同电子层数又按照原子序数递增的顺序排列的每一横行中的一系列元素。元素周期表中共分7个周期,第1周期,含两种元素;第2、3周期各含八种元素;第4、5周期各含18种元素;第6周期有32种元素;其中,含元素较少的第1、2、3周期叫短周期;含元素较多的第4、5、6周期叫长周期;第7周期到现在只发现了21种元素,还没有填满,叫不完全周期。
[短周期]见周期条。
[长周期]见周期条。
[不完全周期]见周期条。
[族]元素周期表中的纵行。周期表中有18个纵行。除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。周期表中有七个主族、七个副族,一个零族和第Ⅷ族。族序号习惯用罗马数字表示。由短周期元素和长周期元素共同组成的族叫主族,族序号后面标一A字;只由长周期元素构成的族叫副族,族序号后面标一B字;惰性元素叫做0族。
[主族]见族条。
[副族]见族条。
[零族]见族条。
[第Ⅷ族]周期表中第8、9、10三个纵行的元素为第Ⅷ族,其中包括铁Fe、钴Co、镍Ni、钌Ru、铑Rh、钯Pd、锇Os、铱Ir、铂Pt,共九种元素。
[铁系元素]第Ⅷ族元素中铁、钻、镍这三种元素的性质很相似,称为铁系元素。
[铂系元素]第Ⅷ族中钌、铑、钯、锇、铱、铂六种元素性质相似,称为铂系元素。
[镧系元素]周期表中第六周期ⅢB族中57-71号的15种元素称作镧系元素。其中包括镧La、铈Ce、镨Pr、钕Nd、钷Pm、钐Sm、铕Eu、钆Gd、铽Tb、镝Dy、钬Ho、铒Er、铥Tm、镱Yb、镥Lu,共十五种元素。
[锕系元素]周期表中第七周期ⅢB族中89-103号的15种元素称作锕系元素。其中包括锕Ac、钍Th、镤Pa、铀U、镎Np、钚Pu、镅Am、锔Cm、锫Bk、锎Cf、锿Es、镄Fm、钔Md、锘No、铹Lr,共十五种元素。它们都是放射性元素。其中只有锕、钍、镤、铀四种元素存在于自然界,在铀以后的元素称为超铀元素,它们都是用人工核反应合成的,极微量的镎Np和钚Pu也存在于自然界中。
[超铀元素]见锕系元素条。
[稀土元素]周期表中第ⅢB族中钪Sc、钇Y和镧系元素在性质上都非常相似,并在矿物中共生。18世纪时,人们习惯上把不溶于水的固体氧化物叫做“土”。19世纪初,稀土元素被发现时,它们很象“土”。又因是在很稀有的矿物中发现的,因此把它们叫“稀土”。稀土元素并不稀有,在自然界中约有250多种稀土矿。稀土元素主要应用于玻璃制造、陶瓷工业、冶金工业、原子能工业、电子技术以及用作催化剂等。
[过渡元素]广义的过渡元素包括周期表中所有副族元素和第Ⅷ族元素。也有的将ⅠB、ⅡB两个副族除外。过渡元素都是金属,在现代科学技术中有重要应用。
[内过渡元素]镧系和锕系元素的总称。
[元素周期表的分区]根据原子的电子层结构特征,元素周期表可划分为四个区。S区:包括ⅠA和ⅡA两个主族,特征电子构型分别为ns1 和ns2 ;p区:包括ⅢA-ⅦA五个主族和0族,除He以外,特征电子构型为ns2 np1-6;d区:包括ⅠB-ⅦB七个副族和第Ⅷ族,最外层有两个电子,次外层有1-10个d电子,特征电子构型为(n-1)d1-10 ns2;f区:包括镧系和锕系,最外层有2个s电子;次外层电子排布基本相同,有2个s电子和6个p电子(个别有d电子),倒数第三层有 1-14个f电子,特征电子构型一般是(n-2)f1-14 ns2 。其中,d区元素和f区元素都是过渡元素。
[同位素]原子核内质子数相同而中子数不同的同一种元素的不同原子互称同位素。同位素中有的是稳定的,称稳定同位素,在天然元素中多数都有稳定同位素,也有一些元素尚未发现稳定同位素,如氦、氟、钠、铝、磷、金等;有的同位素具有放射性,称放射性同位素,放射性同位素中除天然放射性同位素外,还有人工放射性同位素。天然存在的同一元素的各种同位素均匀地分布在自然界各种物质中。同一元素的各种同位素的原子核虽有差别,但核外电子排布相同,化学性质基本相同。
[核素]具有一定质子和中子数目的一种原子称为核素。例如,氧有三种核素,它们核内的质子数都是8,而中子数分别是8、9、10,质量数分别是16、17、18,氧的这三种核素就是氧的同位素:168O、178 O、188O。
[同量素]又称同量异序素。质量数相同而核内质子数不同的各种不同元素的原子互为同量素。例如,4018Ar、4019 K、4020Ca互为同量素。
[道尔顿原子学说]1803年由英国化学家道尔顿(JohnDalton,1766-1844)提出,其要点如下:一切物质都是由极小的微粒--原子所组成,原子不能自生自灭,也不可再分;同种物质含有同种原子,不同物质含有不同种原子,不同种原子具有不同的大小、性质和质量(即原子量);单质由简单原子组成,化合物则由复杂原子所组成(为数不多的简单原子可组成复杂原子)。1808年道尔顿在其著作《化学哲学新体系》中全面阐明了这一学说,在化学发展史上是一个重要的里程牌。这一学说的不完善之处在于,没有提出分子概念,未把原子与分子加以区别,并认为原子是不可再分的微粒。这些问题在分子学说提出后以及进入20世纪以后关于原子结构的一系列新发现和原子结构理论建立后才得到解决。
[原子分子学说]又称原子分子论,是在道尔顿原子论和阿佛加德罗分子论的基础上,经意大利化学家康尼查罗(Stanislao Cannizzaro,1826-1910)的实验论证,于1860年建立的。其要点是:一切物质都是由分子组成的,分子是由原子组成的;分子是保持物质化学性质的最小单位,原子则是化学反应中不可再分的最小微粒;单质分子由同种原子组成,化合物分子由不同原子组成,分子质量等于组成它的原子质量的总和。原子分子学说的建立,是化学发展史上的重要阶段。
[X-射线]又称伦琴射线,1895年由德国物理学家伦琴(Roentgen)  大致介于紫外线和γ射线之间。X-射线有一定的穿透能力,还能使荧光物质发光、照相底片感光、气体电离等。X-射线应用很广,在科学研究中用于研究晶体结构,工业上用于金属探伤,医疗上用于人体透视。
大致介于紫外线和γ射线之间。X-射线有一定的穿透能力,还能使荧光物质发光、照相底片感光、气体电离等。X-射线应用很广,在科学研究中用于研究晶体结构,工业上用于金属探伤,医疗上用于人体透视。
[α-射线]放射性原子核所发出的α粒子流(α粒子即氦原子核)。α-射线中,α粒子的动能很大,可达几兆电子伏特以上;但由于α粒子的质量比电子大得多,通过物质时极易使其中的原子电离而损失能量,所以它的穿透物质的本领比β射线弱得多,容易被薄层物质阻挡。
[β-射线]放射性原子核所发出的电子流(或正电子流)。电子的动能可达几兆电子伏特以上,由于电子的质量小,速度大,通过物质时不易使其中的原子电离,所以它的能量损失较慢,穿透物质的本领比α射线强得多。
 子核在衰变过程中能放出γ-射线。
子核在衰变过程中能放出γ-射线。
[d-pπ键]是一种特殊形式的π键。指某元素的原子用d轨道与另一原子具有相同对称性的p轨道形成的π键。如第三周期的一些元素在和O、F、Cl等原子结合时就可能形成这种形式的键。现代研究表明,在SiF4、PF3、PO34-、SO24-、ClO-4 等分子和原子团中都存在d-pπ键,其中做为中心原子的 Si、P、S、Cl等原子用空的3d轨道和 F、O等原子的充满电子的p轨道成键。
[非极性分子]指没有偶极的分子,即分子的固有偶极为零的分子。这种分子里负电荷中心与正电荷中心是相重合的。如H2分子、Cl2分子、CO2分子、CH4分子、CCl4分子等。
[极性分子]指具有固有偶极的分子。这种分子里负电荷中心与正电核中心不重合,而显示出极性,如HCl分子、H2O分子、NH3分子、CHCl3分子等。分子极性的大小用偶极矩来度量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com