
0.02mol 0.02mol
根据反应耗用盐酸的量列方程求解
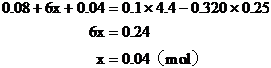
Fe2O3的质量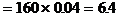 (g)
(g)
Fe的质量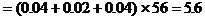 (g)
(g)
答案:Fe的质量为5.6g; CuO的质量为1.6g; Fe2O3的质量为6.4g。
[例5]已知NO2与NaOH溶液反应:
3NO2+2NaOH=2NaNO3+NO+H2O,NO和NO2可一起与NaOH溶液作用
NO2+NO+2NaOH= 2NaNO2+H2O现欲用V L某烧碱溶液使由nmol NO和m mol NO2组成的混合气体中的氮全部进入溶液中,NaOH溶液的物质的量浓度至少为多少?
解析:NO和NO2的混合气体与NaOH溶液反应,产物为NaNO2,产物中Na+与NO2-的物质的量比为1∶1,根据反应中Na+与N原子的物质的量守恒,可列出方程。
设NaOH溶液的物质的量浓度为x。
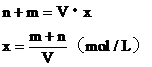
答案:(m+n)/v
[例6]把2.56g纯铜放入盛有一定量浓HNO3的大试管中,立即发生化学反应,当铜反应完毕后,共生成气体1.12L(标况),计算此反应中耗用HNO3的物质的量是多少?
解析:铜跟一定量浓HNO3反应,开始生成的还原产物是NO2,后期生成的还原产物是NO,把两个不同反应所生成的还原产物作为整体考虑,而不区分有多少NO2和NO,每生成1mol NOx都耗用1mol HNO3,根据以应前后氮原子守恒,可列方程求解
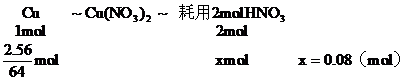

答案:0.13 moL
[例7]将7.28g Fe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+,待反应完全后,剩余Fe2+还需0.4mol/L KMnO4溶液25mL才能完全氧化,已知其反应方程式为:5Fe2++MnO4-+8H+=Mn2++5 Fe3++4H2O。通过计算、确定KNO3的还原产物是什么?(还原产物为氧化物)并写出其离子方程式。
解析:该题中Fe已全部被转化为Fe2+,因此Fe2+与KNO3、KMnO4的氧化还原反应中,还原剂为Fe2+,氧化剂为KNO3、KMnO4,根据电子得失守恒列方程。
Fe2+失去电子的物质的量= KMnO4得到电子的物质的量+KNO3得到电子的物质的量
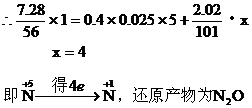
离子方程式:2 NO3-+8 Fe2++10H+=N2O+8 Fe3++5H2O
答案:KNO3的还原产物是N2O 离子方程式:2 NO3-+8 Fe2++10H+=N2O+8 Fe3++5H2O
[例8]镁条在空气中燃烧生成氧化镁和氮化镁。将燃烧后的产物溶解在60毫升浓度为2.0mol/升的盐酸中,再用20毫升0.5mol/升NaOH溶液中和多余的盐酸,然后在此溶液中加过量的碱,把氨全部蒸出来,用稀HCl吸收,稀HCl增重0.17g,求镁带的质量。
解析:此题涉及反应较多,如按常规计算非常复杂,如巧用电荷守恒法可使计算大为简化。
该题反应变化的图式:
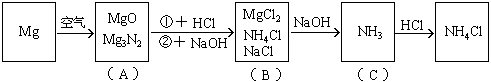
在图(B)中,根据电荷守恒,有下列关系:
2n(Mg2+) + n(NH4+) + n(Na+) = n(Cl-)
把数据代入 解得n(Mg2+) =0.05moL
则镁带的质量=1.2g
答案:镁带的质量为1.2g
2.守恒法的最基本原理为-----质量守恒定律,并由此衍生出来:
一切化学变化中都存在的-----微粒守恒
氧化还原反应中存在的-----得失电子守恒
化合物的化学式存在的-----正、负化合价总数相等
电解质溶液中存在的-----阴、阳离子电荷守恒
试题枚举
[例1]例题5某烃0.1mol,与在标准状况下为20 L的氧气(过量)充分反应后,迅速将混合气体通入足量Na2O2粉末中,在一定设备中使气体完全反应,此时粉末增重15 g。经处理后得到气体14.4 L(标准状况)。该烃能使溴水褪色,试通过计算求出该烃的分子式,并写出可能的结构简式。
解析:设该烃的分子量为M
经分析可推断14.4 L气体均为氧气。根据质量守恒:
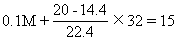
解得M=70 由估算法70/12=5 余10
所以该烃化学式为C5H10。因为该烃能使溴水褪色,故为烯烃。戊烯共有5种可能的结构简式:①CH2=CH-CH2-CH2-CH3
②CH3-CH=CH-CH2-CH3
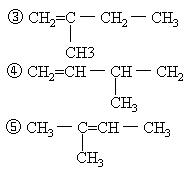
[例2]酸雨是因为过度燃烧煤和石油,生成的硫的氧化物与氮的氧化物溶于水生成硫酸和硝酸的缘故。某次雨水的分析数据如下:
c(NH4+)=2.0×10-6mol/L c(Cl-)=6.0×10-6mol/L
c(Na+)=3.0×10-6mol/L c(NO3-)=2.3×10-5mol/L
c(SO42-)=2.8×10-5mol/L
则此次雨水的pH大约为 ( )
A.3 B.4 C.5 D.6
解析:此题应根据雨水中阴、阳离子所带负、正电荷守恒(溶液呈电中性)解析,根据电荷守恒:
c(H+)+ c(NH4+)+ c(Na+)= c(Cl-)+ c(NO3-)+2 c(SO42-)
计算出c(H+) 再代入pH=-lg c(H+) =5-lg8≈4
答案:B。
[例3]在30mL量筒中充满NO2和O2的混合气体,倒立于水中使气体充分反应,最后剩余5mL气体,求原混合气中氧气的体积是多少毫升?
解析:解法(一)
设原混合气中氧气的体积为y(mL)
(1)设O2过量:根据4NO2+O2+2H2O=4HNO3,则O2得电子数等于NO2失电子数。
(y-5)×4=(30-y)×1
解得y=10(mL)
(2)若NO2过量:
4NO2+O2+2H2O=4HNO3
4y y
3NO2+H2O=2HNO3+NO
5
因为在全部(30-y)mLNO2中,有5mLNO2得电子转变为NO,其余(30-y-5)mLNO2都失电子转变为HNO3。
O2得电子数(NO2→NO)时得电子数等于(NO2→HNO3)时失电子数。
解法(二)根据得失电子守恒,利用阿伏加德罗定律转化信息,将体积数转化为物质的量简化计算。凡氧化还原反应,一般均可利用电子得失守恒法进行计算。
4y+5×2=(30-y-5)×1
解得y=3(mL)
答案:原氧气体积可能为10mL或3mL
[例4]将Wg铁、氧化铁和氧化铜组成的混合物粉未放入100mL 4.4mol/L盐酸中,反应完全后得氢气896mL(标况),生成的溶液中只有FeCl2、HCl和1.28g固体。把溶液稀释到320mL时,盐酸的物质的量浓度为0.25mol/L,求混合物中各物质是多少g?
解析:解答此题的关键,是审清题意,找出等量关系,选准突破口。首先确定由生成溶液中的盐酸可知反应后的1.28g固体沉淀物为铜,因此可首先确定CuO的质量。再根据各反应化学方程式中诸物质的量的关系和耗用盐酸的物质的量列方程求解,或寻求题中“隐含”的电子守恒和Cl-守恒条件,求得Fe和Fe2O3的质量。
Cu的物质的量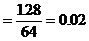 mol
mol
CuO的质量=0.02×80=1.6(g)
设混合物中Fe2O3的物质的量为x。
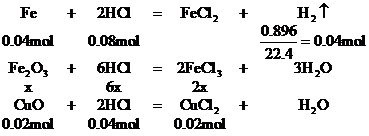
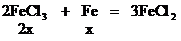
 CuCl2 +
Fe = FeCl2 +Cu
CuCl2 +
Fe = FeCl2 +Cu
1.所谓“守恒”就是以化学反应过程中存在的某些守恒关系如_________守恒、元素守恒、得失__________守恒等作为依据,寻找化学式中__________总数绝对值相等;复分解反应中阴阳离子________________总量相等;氧化还原反应中氧化剂与还原剂_________________________相等。几个连续或平行反应前后某种微粒的_________________相等作为解题的基本思路。运用守恒法解题既可避免书写繁琐的化学方程式,提高解题的速度,又可避免在纷纭复杂的解题背景中寻找关系式,提高解题的准确度。
24、下列离子方程式中正确的是
A、向硝酸银溶液中加入过量氨水:Ag+ + 2NH3·H2O = [Ag(NH4)2]+ + 2H2O
B、苯酚钠溶液中充入少量CO2: C6H5O- + CO2 + H2O → C6H5OH + HCO3-
C、0.5L0.4mol/LFeBr2溶液中标况下的Cl24.48L:2Fe2+ + 2Br- + 2Cl2 = 2Fe3+ + Br2 + 4Cl-
D、铝粉溶于浓氢氧化钡溶液: 2Al + 4OH- = 2AlO2- + 2H2↑
23、下列说法中正确的是
A、核外电子排布完全相同的两种微粒,其化学性质一定相同
B、具有固定熔点或沸点的物质一定是纯净物
C、一种离子和一种分子的质子数和电子数不可能同时相等;
D、共价化合物溶于水电离过程中,共价键被破坏。
22、A、B两个烧杯中分别盛有100mL3.0mol/L的盐酸和烧碱溶液,向两个烧杯中分别加入等质量的Al粉,在相同条件下产生气体的体积比A : B=2 : 5,则加入铝粉的质量为
A、8.1g B、6.75g C、5.4g D、2.7 g
21、下列每组各有三种物质,它们都能用分液漏斗分离的是
A、乙酸乙酯和水,酒精和水,苯酚和水; B、二溴乙烷和水、溴苯和水、硝基苯和苯
C、甘油和水、乙醛和水、乙酸和乙醇; D、油酸和水,甲苯和水,已烷和水。
20、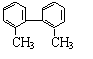 已知“C-C”单键可以绕轴旋转,结构式为
的烃,含苯环表处于同一平面的碳原子个数至少有
已知“C-C”单键可以绕轴旋转,结构式为
的烃,含苯环表处于同一平面的碳原子个数至少有
A、6 B、8 C、9 D、14

19、
 a molCH2=C-C=CH2和bmolCH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成 CH3 CH3 水蒸气、CO2、N2,在相同条件下,它们的体积比依次为8:12:1,则a:b为
a molCH2=C-C=CH2和bmolCH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成 CH3 CH3 水蒸气、CO2、N2,在相同条件下,它们的体积比依次为8:12:1,则a:b为
A、1:1 B、3:2 C、2:3 D、1:2
18、为了使氯化钠、硫化钠、氢氧化钠混合溶液中的Cl-、S2-、OH-转变成沉淀形式,需加入适量的①硝酸铜、②硝酸银、③硝酸镁,若要求每加入一种试剂只使一种离子沉淀,则加入试剂的顺序是
A、②③① B、①③② C、③①② D、③②①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com