
5、(14分)已知某混合金属粉末,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1 mol/L硫酸、2 mol/L硝酸、2 mol/L NaOH溶液、20% KSCN溶液。
完成以下实验探究过程:
(1)提出假设:假设1:该混合金属粉末中除铝外还含有_______ __元素;
假设2:该混合金属粉末中除铝外还含有_________ 元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案:基于假设3,设计出实验方案(不需要作答)。
(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
|
|
|
4.(13分)某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们
展示两个方案,并提出下列问题:
 方案甲:
方案甲:
方案乙:

⑴两个方案哪个符合当前的绿色理念: ;
⑵写出方案甲中步骤②、⑧反应的离子方程式:_____________、______________;
⑶无论是甲还是乙方案,在“加铁屑”时,都加入稍过量的铁屑,你认为这么做的道理是:___________________________________________________________________________;
⑷①用简便的方法检验红色粉末中含有过量的铁屑:_________________________; ②如何除去红色粉末中所含过量的Fe得干燥的红色粉末:______________________。
3.(12分)某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是___________。(填序号)
A.铝与Cl-反应,铝与SO42-不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是 。
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是 。
(4)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是_____________________。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
(5)除去氧化膜的铝片与镁片为电极,在X电解质溶液中构成原电池,列表如下:
|
选项 |
铝电极 |
电解质 |
负极反应 |
正极反应 |
|
A |
负极 |
NaOH |
2Al-6e-+8OH-=2AlO2-+4H2O |
6H2O+6e-=6OH-+3H2↑ |
|
B |
负极 |
稀盐酸 |
2Al-6e-=2Al3+ |
6H++6e-=3H2↑ |
|
C |
正极 |
浓硝酸 |
Mg+2e-=Mg2+ |
2NO3-+4H+-4e-=2NO2↑+2H2O |
其中正确的是__ __(填序号),由此推知,金属作电极不仅与本身性质相关,而且与 __ 有关。
2.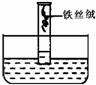 (4分)某同学设计和进行了如右图试验:
(4分)某同学设计和进行了如右图试验:
⑴步骤:
①将约0.4g表面光亮的铁丝绒,绕成团,用水浸湿后,放进量筒中;
②将量筒倒置在装有蒸馏水的水槽中,开始量筒
内的水面调至10.0mL的刻度处,固定;
③当量筒内的水面不再上升时,停止试验。
⑵请回答:
①铁丝绒表面的变化是 ;
②上述①变化的条件是 ;
③量筒内水面最后约在 mL刻度处(忽略铁丝体积和上升水柱压强的影响)
④如果你的自行车被雨淋湿后,你采取的防锈措施是 。
1.(5分)金属镁可与热水反应生成氢氧化镁,所得溶液成碱性,可使酚酞试液显红色。某同学将镁条放在热水中煮沸,趁热取出部分溶液,滴加酚酞试液,溶液变成红色,放置在空气中一段时间后,发现溶液的红色褪去了。
⑴溶液红色褪去说明溶液的碱性 ;
⑵据你推测,导致溶液碱性变化的原因可能是:
① ② ;
⑶设计一个实验来证明你的一种推测,简要说明操作、现象、结论:
11.⑴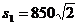 m ⑵
m ⑵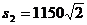 m 12.⑴A球 ⑵无 ⑶
m 12.⑴A球 ⑵无 ⑶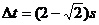 ⑷1:
⑷1: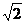 13.2000m 14.
13.2000m 14.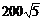 m/s 15.
m/s 15.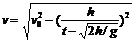 16.
16.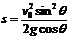 17.首先撞到第三级台阶上
17.首先撞到第三级台阶上
1.B 2.AB 3. BCD 4.B 5.C 6.C 7.C 8.1:4:9 ,1:2:3 9.3 ,等于 10.22.4m/s
1.C D 2.C 3.C 4.C 5.C 6.C 7.D 8.B 9.37.5 3.2 10.45° 20 11.(1)420 m (2)17.65 s ,124.9m/s (3)1497.7m
12.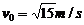 ,
,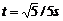
第四节 抛体运动的规律综合评价答案
1.初速度 水平方向 重力 匀变速曲线运动 重力加速度 2.匀速直线运动 自由落体运动 3.斜向上方,斜向下方,斜抛,仍不受力,0 ;仍只受重力,g,v0cosθ,v0sinθ 4.为了研究问题的方便,应该沿水平向右和竖直向下建立坐标系,并取小球刚被水平抛出的瞬间位置作为坐标原点。
第四节 抛体运动的规律同步检测答案
17.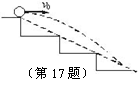 如图所示,一个小球从楼梯顶部以v0=2 m/s的水平速度抛出,所有的台阶都是高0.2 m、宽0.25 m,问小球从楼梯顶部抛出后首先撞到哪一级台阶上?
如图所示,一个小球从楼梯顶部以v0=2 m/s的水平速度抛出,所有的台阶都是高0.2 m、宽0.25 m,问小球从楼梯顶部抛出后首先撞到哪一级台阶上?
第四节 抛体运动的规律知能准备答案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com