
1.(12分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
|
指标 项目 |
优等品 |
一等品 |
合格品 |
|
外观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0% |
≥21.0% |
≥20. 5% |
 某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观] 该硫酸铵化肥无可见机械性杂质。
[实验探究]
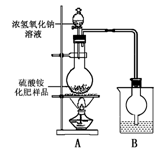
按右图所示装置进行实验。
(1)烧瓶内发生反应的离子方程式为:
烧杯中盛放的试剂最好是 (填“浓硫酸”、“稀硫酸”或“水”)
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是
[交流讨论]
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:
乙同学:实验装置中还存在另一个明显缺陷是:
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论]
称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥 (填“是”或“不是”)一等品

6. (12分)
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1NaOH溶液。所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示:

(1)和铝粉和铁粉的混合物反应时,HNO3对应还原产物为---------------------------(填化学式)。
(2)完成下列过程中的离子反应方程式:
O→C_______________________________________________________________;
D→E________________________________________________________________;
E→F_______________________________________________________________;
5.(14分)
根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)反应温度控制在30-35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为
。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(3)过滤所得的母液中含有 (以化学式表示),需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=
4.(10分)
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
写出其中涉及到的化学方程式:
;
。
(2)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式 。
②反应中生成的氧化产物与还原产物的物质的量之比是 ,
每分解1mol高氯酸铵,转移的电子数目是 。
3.(12分)工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:
2FeSO4  Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
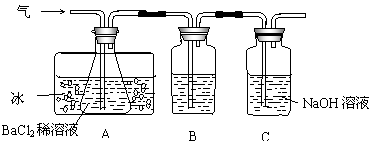 (SO2沸点为-10.02℃)
(SO2沸点为-10.02℃)
请回答相关问题:
(1)A瓶所盛试剂的作用是 ;B瓶所盛的试剂是 ;C瓶所盛试剂的作用是 。
(2)A瓶要用冷水冷却的原因是 。
(3)将此反应生成的气体通入A瓶BaCl2溶液中,则 。(填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
理由是 。
(4)反应后若用A瓶内的混合物来测定已分解的FeSO4的质量,其实验操作的第一步是(简述操作步骤) 。
2.(10分)实验室用下图的装置将CO2和CO进行分离和干燥.已知a、b均为活塞,试回答
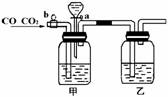
(1)甲瓶中装的是 溶液,乙瓶中装的是 溶液,分液漏斗中装的是 .
(2)当CO2与CO的混和气体通过该装置时,先分离得到的是 ,活塞操作是 ;然后得到 ,活塞操作是 .
1.(10分)
(1)下列有关实验的基本操作及安全知识的叙述,正确的是 (填序号)。
A.附着于试管内壁的苯酚,可用碱液洗涤
B.用结晶法可以除去硝酸钾中混有的少量氯化钠
C.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
D.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
E.浓硫酸不小心沾到皮肤上,立刻用稀烧碱溶液洗涤
F.在氢氧化铁胶体中滴加少量稀硫酸会产生沉淀
(2)下表是某种常见金属的部分性质:
|
颜色状态 |
硬度 |
密度 |
熔点 |
导电性 |
导热性 |
延展性 |
|
银白色固体 |
较软 |
2.70g/cm3 |
660.40C |
良好 |
良好 |
良好 |
将该金属投入冷水中无变化,投人稀盐酸中可产生大量的无色气体。试回答:
①推断该金属可能的一种用途 ,该金属的活动性比铜 (填“强”或“弱”)。
②请自选试剂,设计不同的实验探究该金属与铁的活动性强弱,并完成下表:
|
猜想 |
验证方法 |
预测实验现象 |
|
该金属比铁活泼 |
|
|
|
该金属活泼性比铁弱 |
|
|
4.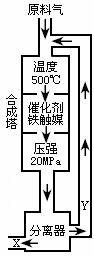 合成氨工业的反应为:N2(g) + 3H 2(g)
合成氨工业的反应为:N2(g) + 3H 2(g)  2NH3(g); △H<0
2NH3(g); △H<0
工业合成氨生产示意图如右图所示。
(1)写出该反应的化学平衡常数表达式:
K= ________________________________________。
随着温度升高,K值_________(填增大、减小、不变)
(2)Y的主要成分为__________________;
(3)化工生产条件选定的主要原因是(选填字母序号)__________;
A.温度、压强对化学平衡的影响;
B.铁触媒在该温度时活性大;
C.工业生产受动力、材料、设备等条件的限制。
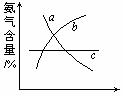
(4)改变反应条件,会使平衡发生移动。如下图像表示随条件改变,
氨气的百分含量的变化趋势。
当横坐标为压强时,变化趋势正确的是(选填字母序号)____________,
当横坐标为温度时,变化趋势正确的是(选填字母序号)_________。
(5)合成氨工厂常通过测定反应前后的混合气体密度来确定氮的转化率。某工厂测得合成塔中N2、H2的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体密度为0.693g/L。则该合成氨厂N2的转化率为多少?
3.(8分)
某厂为综合利用生产废料石膏(CaSO4·2H2O),设计如下工艺流程制备硫酸和生石灰。
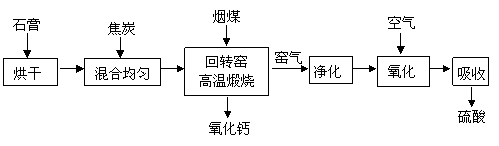
回答下列问题:
(1)窑气中除含有CO2外,还含有的主要物质是 。
(2)窑气经净化后在氧化、吸收过程中发生反应的化学方程式为
。
(3)回转窑内焦炭与硫酸钙反应的化学方程式为
。
(4)此硫酸产品经处理后得到的超纯硫酸是一种非常有效的清洗剂。一定条件下,它几乎可以除去硅晶片上所有的无机残留物与金属颗粒,除去硅晶片上铜颗粒的化学方程式为
。
2.(10分)
硅藻土由无定形的SiO2组成,含有少量Fe2O3、Al2O3及有机物等杂质。通常呈浅黄色或浅灰色,质软多孔。工业上可按如下流程,用硅藻土制备纳米二氧化硅。

(1)煅烧硅藻土的目的是 。
(2)在加热条件下加入烧碱时反应的化学方程式为
。
(3)加入过量硫酸后生成沉淀的反应方程式为
。
(4)上述流程中,有助于控制二氧化硅粒子直径的措施有
(至少写出一个)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com