
2.把0.05molNaOH晶体分别加入到下列100mL液体中,溶液导电性变化较大的是( )
A.自来水 B.0.5mol·L-1盐酸
C.0.5mol·L-1H2SO4 D.0.5mol·L-1NaNO3
1.下列物质中,导电性能最差的是( )
A.熔融的氢氧化钠 B.石墨棒
C.盐酸溶液 D.固态氯化钾
16.(1)①2H2SO3+O2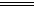 2H2SO4②小
2H2SO4②小
(2)C
(3)不可取。因SO2的排放总量没有减少,所以进一步形成的酸雨仍会造成对全球的危害。
解析:酸雨放置时pH变化,其原因是雨水中的H2SO3被空气中氧气氧化所致。雨水和自来水混合,应考虑H2SO3与Cl2(或HClO)的反应。
点评:接触和认识化学与环境的关系,强化环保意识,是化学学习的一项重要内容。因而有关环境保护的内容,如环境污染、环境监测、污染物的处理及防治污染的措施等,都应引起重视。
15.(1)稀氨水和酚酞;稀氨水中的NH3逸出,所以溶液的颜色变浅;(2)溶有SO2的品红;SO2气体逸出,品红溶液恢复红色。
解析:(1)原溶液是红色溶液,受热颜色变浅,是因那种物质以气态挥发所引起,常见的具有碱性的气体是氨气,氨气在水中呈碱性,可使酚酞变红,氨气减少,颜色变浅;(2)原溶液是无色溶液,受热反而显红色,同上小题分析,这里挥发的是SO2气体,指示剂是品红。
14.(1)②④⑦⑧ (2)①③⑥A
(3)①③⑤ (4)①②③④⑥⑧B
解析:由B口进入适宜于比空气重的气体,由A口进入适宜于比空气轻的气体。
13.6NO+4NH3 5N2+6H2O
5N2+6H2O
解析:根据氧化还原反应的原理分析,用NH3将NO还原成无毒气体,该气体只能是N2。NO中N(+2)的氮元素;被NH3中N(-3)还原为N(0),剩下的氢、氧元素只能结合成水。
12.①Hg+S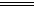 HgS②下
HgS②下
11.B解析:此题涉及两个知识点:①NO与O2迅速反应生成NO2。②NO2与O2混合气与水发生反应:4NO2+O2+2H2O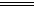 4HNO3。
4HNO3。
设O2为3mol,NO为4mol。根据2NO+O2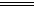 2NO2,烧瓶内实际存在的是4molNO2和1molO2,与水作用后,恰好生成4molHNO3,溶液的体积为5×22.4L。故硝酸溶液的浓度为4/(5×22.4)=0.036(mol·L-1)。
2NO2,烧瓶内实际存在的是4molNO2和1molO2,与水作用后,恰好生成4molHNO3,溶液的体积为5×22.4L。故硝酸溶液的浓度为4/(5×22.4)=0.036(mol·L-1)。
点评:解答本题容易出现下列错误:设O2为3L,NO为4L,恰好反应生成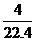 molHNO3,烧瓶容积等于气体体积,为3+4=7L,故HNO3的物质的量浓度为
molHNO3,烧瓶容积等于气体体积,为3+4=7L,故HNO3的物质的量浓度为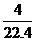 /7=0.026mol·L-1,选C。错误的根本原因在于忽视了3LO2和4LNO充入烧瓶即发生反应:2NO+O2
/7=0.026mol·L-1,选C。错误的根本原因在于忽视了3LO2和4LNO充入烧瓶即发生反应:2NO+O2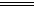 2NO2,气体实际体积为5L(4LNO2和1LO2),故烧瓶容积应为5L而不是7L。
2NO2,气体实际体积为5L(4LNO2和1LO2),故烧瓶容积应为5L而不是7L。
10.AB解析:NO与CO一样,都能与Fe2+结合,使血红蛋白失去输氧能力。
9.B解析:饱和烧碱与饱和纯碱溶液既吸收SO2吸收CO2;浓硫酸不能吸收SO2,故不可能。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com