
6. 高温下,某反应达到平衡,平衡常数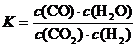 。恒容时,温度升高,H2浓度减小。下列说法正确的是A
。恒容时,温度升高,H2浓度减小。下列说法正确的是A
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
5. 在相同温度和压强下,对反应 CO2 ( g ) +
H2 ( g ) CO(g ) +
H2O( g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO(g ) +
H2O( g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
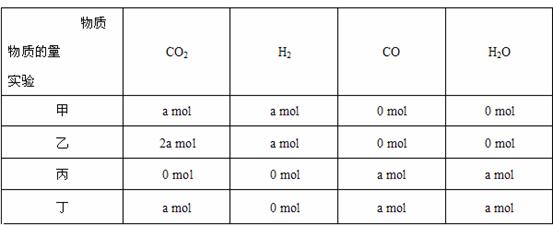
上述四种情况达到平衡后, n ( CO )的大小顺序是 A
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
4. 如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是
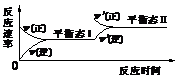
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
D.同一种反应物在平衡态I和平衡态II时浓度不相等
2.X、Y、Z为三种气体,把a molX和b molY克入一密闭容器中,发生反应X+2Y  2Z.达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( B )
2Z.达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( B )
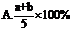
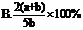
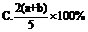
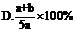 3. 一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)
3. 一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的DH>0
1. 一真空密闭容器中盛有a molA,加热到200℃时发生如下反应nA(气)  B(气)+C(气),反应平衡时,A所占体积分数为M%。若在同一温度和同一容器中,最初放入的是2a molA,反应平衡时,A所占体积分数为N%。则M和N的正确关系是 ( )
B(气)+C(气),反应平衡时,A所占体积分数为M%。若在同一温度和同一容器中,最初放入的是2a molA,反应平衡时,A所占体积分数为N%。则M和N的正确关系是 ( )
A.M>N B.M<N C.M=N D.无法比较
21. ⑴ > < ⑵ 如下图 ⑶ +236
20. (1)放热 (2)减小 该反应正反应为放热反应,升高温度使平衡向逆反应方向移动 (3)不影响 催化剂不改变平衡的移动 (4)减小 减小
19. (1)S2-
+ H2O HS- +OH- HS- + H2O
HS- +OH- HS- + H2O H2S +OH-(可不写)
H2S +OH-(可不写)
(2)2.7×10-3 (3)172.5
(4)使BaSO4得到充分的还原(或提高BaS的产量) ①②为吸热反应,炭和氧气反应放热维持反应所需高温
18. (1)2P(s) + 3Cl2(g)===2PCl3(g);△H == -612 kJ·mol-1
(2)PCl5(g)===PCl3(g) + Cl2(g);△H== +93kJ·mol-1 25% 大于
(3)两步反应都是放热反应,降温有利于提高产率,防止产物分解
(4)-399 kJ·mol-1 等于
(5)PCl5 + 4H2O===H3PO4 + 5HCl
21.(05江苏21)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/ KJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
 请回答下列问题:
请回答下列问题:
⑴ 比较下列两组物质的熔点高低 (填>或<)
SiC______ Si; SiCl4 ______ SiO2
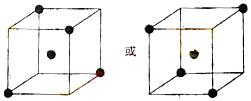
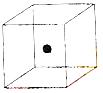
⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4 (g) + 2H2(g)  Si(s) +
4HCl(g)
Si(s) +
4HCl(g)
该反应的反应热△H = ___________ KJ/mol
Ⅱ卷非选择题答案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com