
3. 下列各组中的离子因发生氧化还原反应而不能大量共存的是C
A.H+、Na+、SO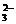 、Cl- B.Ca2+、K+、S2-、CO
、Cl- B.Ca2+、K+、S2-、CO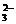
C.Fe2+、H+、Cl-、NO D.HCO
D.HCO 、Br-、OH-、SO
、Br-、OH-、SO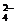
2. 在酸性或碱性较强的溶液中均能大量共存的是B
A. HCO3- 、Na+ 、S2-、Mg2+ B. K+ 、Cl- 、Na+ 、SO42-
C. Cu2+、Al3+、Cl- 、NO3- D. CH3COO-、NH4+、K+ 、Fe3+
1.下列物质既不是电解质,又不是非电解质的是 C
A. NaHSO4 B. Cu(OH)2 C.O2 D. HCl
3.(08四川卷)某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4Ba(NO3)2、AgNO3和CuSO4,将该混合物进行如下实验,根据所给实验现象完成表格(对于可能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”)。
(1)将少许固体放入水中得到无色溶液和白色沉淀。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(2)取溶液进行焰色反应,火焰呈黄色。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(4)通过上述实验仍无法确定的物质是__________________。
解析:(1)由于溶液无色,所以CuSO4就一定不存在,因为CuSO4溶液为蓝色,MgCO3微溶于水,Al2(SO4)3、Na2SO4和Ba(NO3)2、AgNO3中的任意一种反应均可产生白色沉淀,具体物质不能确定。
(2)进行焰色反应,火焰呈黄色,说明一定有Na+存在,即一定有Na2SO4,其它物质不能确定。
(3)白色沉淀加入稀盐酸,沉淀完全溶解,且放出气体,说明沉淀为MgCO3,由于有Na2SO4存在,所以Ba(NO3)2和AgNO3均不能存在,溶液中是否有Al2(SO4)3不能肯定。
|
无 |
CuSO4 |
溶液无色,而CuSO4为蓝色 |
答案:(1)
|
Na2SO4 |
无 |
Na的焰色反应呈黄色 |
(2)
|
MgCO3 |
Ba(NO3)2 AgNO3 |
MgCO3溶于HCl,生成CO2;如有Ba(NO3)2和AgNO3均与Na2SO3反应, 生成BaSO4和Ag2SO4均不溶于HCl。 |
(3)
(4)Al2(SO4)3。
[基础达标]
2. (09江苏卷
(09江苏卷 11) 下列离子方程式与所述事实相符且正确的是
11) 下列离子方程式与所述事实相符且正确的是
 A.漂白粉溶液在空气中失效:
A.漂白粉溶液在空气中失效: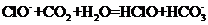
 B.用浓盐酸与
B.用浓盐酸与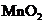 反应制取少量氯气:
反应制取少量氯气: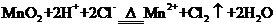
 C.向
C.向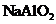 溶液中通入过量
溶液中通入过量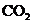 制
制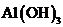 :
:

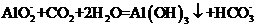
 D.在强碱溶液中次氯酸钠与
D.在强碱溶液中次氯酸钠与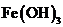 反应生成
反应生成 :
:

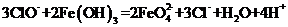

 答案:C
答案:C
 解析:
解析:
漂白粉失效的化学方程式为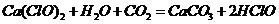 ,那么该反应的离子方程式是
,那么该反应的离子方程式是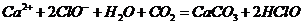 ,A项错;
,A项错;
实验室制取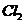 的原理是浓盐酸和二氧化锰反应,离子方程式为
的原理是浓盐酸和二氧化锰反应,离子方程式为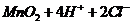

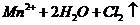 ,所以B项错;
,所以B项错;
D项,在强碱溶液中,不可能生成 ,所以D错。
,所以D错。
几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存.
(1)有气体产生。如CO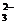 、S0
、S0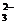 、S2-、HCO
、S2-、HCO 、HSO
、HSO 、HS-等易挥发的弱酸的酸根与H+不能大量共存。
、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。如Ba2+、Ca2+、Ag+等不能与SO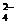 、CO
、CO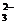 等大量共存;Mg2+、Fe2+、Ag+、Al3+、Cu2+、Fe3+等不能与OH-大量共存; Ag与I-等不能大量共存。
等大量共存;Mg2+、Fe2+、Ag+、Al3+、Cu2+、Fe3+等不能与OH-大量共存; Ag与I-等不能大量共存。
(3)有弱电解质生成。如OH-、CH3COO-、C1O-、A1O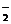 、SiO
、SiO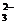 、等与H+不能大量共存;一些酸式弱酸根如HCO
、等与H+不能大量共存;一些酸式弱酸根如HCO 、HSO
、HSO 不能与OH-、H+存;NH
不能与OH-、H+存;NH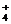 与OH-不能大量共存。
与OH-不能大量共存。
(4)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如MnO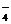 、NO
、NO 、ClO-与S2-、HS-、S0
、ClO-与S2-、HS-、S0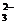 、I-、Fe2+等不能大量共存;
、I-、Fe2+等不能大量共存;
(5)溶液中能发生络合反应的离子不能大量共存。如Fe2+、Fe3+与SCN-不能大量共存;
(6)多元弱酸的酸式酸根离子不能与H+、OH-大量共存
HCO3- 、HSO3-、
附加隐含条件的应用规律:
(1)溶液无色透明时,则溶液中肯定没有有色离子.常见的有色离子是Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)等离子。
(2)强碱性溶液中肯定不存在与OH-起反应的离子.
(3)强酸性溶液中肯定不存在与H+起反应的离子.
典型例题:
1.(09江苏卷 7)在下列各溶液中,离子一定能大量共存的是
7)在下列各溶液中,离子一定能大量共存的是
 A.强碱性溶液中:
A.强碱性溶液中: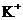 、
、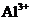 、
、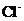 、
、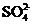
 B. 含有0.1 mol·L-1
B. 含有0.1 mol·L-1 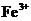 的溶液中:
的溶液中: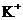 、
、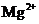 、
、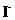 、
、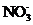
 C. 含有0.1 mol·L-1
C. 含有0.1 mol·L-1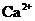 溶液在中:
溶液在中: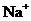 、
、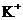 、
、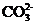 、
、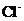
 D. 室温下,pH=1的溶液中:
D. 室温下,pH=1的溶液中: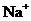 、
、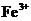 、
、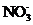 、
、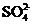

 答案:D
答案:D
 解析:
解析:
A项,强碱性溶液意味着存在大量的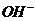 ,所以
,所以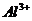 不能共存
不能共存
(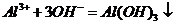 );
);
B项,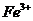 和
和 因发生氧化还原反应而不能共存(
因发生氧化还原反应而不能共存( );
);
C项,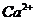 和
和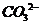 因发生复分解反应而不能共存
因发生复分解反应而不能共存
4.离子方程式的正误判断:(1)看是否符合客观事实。(2)看物质化学式的拆分是否正确。(3)看是否漏掉了隐含反应。(4)看电荷和质量是否守恒。(5)看反应是否与量或滴加顺序有关。
3、与量有关的复杂的离子方程式
① NaOH溶液与少量Ca(HCO3)2溶液反应:
2OH- + Ca2+ + 2HCO3- === CaCO3↓+2H2O + CO32-
NaOH溶液加入过量Ca(HCO3)2溶液反应:
OH- + Ca2+ + HCO3- === CaCO3↓ + 2H2O
② NaHSO4 溶液中加入过量的Ba(OH)2溶液
H+ + OH- + Ba2++ SO42 === BaSO4↓+H2O
NaHSO4 溶液中加入少量的Ba(OH)2溶液
2H+ + SO42 + 2OH- + Ba2+ === BaSO4↓+ 2H2O
③ FeBr2溶液通入过量氯水
2Fe2++ 4Br- + 3Cl2 === 2 Fe3++ 2Br2 + 6Cl -
FeBr2溶液通入少量氯水
2Fe2++ Cl2 === 2Fe3++ 2Cl-
2.书写离子方程式的步骤
写:写出正确的化学方程式;
拆:将化学方程式中易溶解于水且能完全电离的物质拆写成阴、阳离子符号;而难溶于水的物质、气态物质和水仍用化学式表示;
删:删去方程式等号两边重复的离子;
查:检查是否满足元素原子守恒、反应前后电荷守恒等。
1.电解质在水溶液中反应的实质
① 离子反应的实质:多种电解质在水溶液中发生电离,产生能够自由移动的离子,不同离子之间发生反应生成沉淀、气体、水等使某些离子的浓度减少。
② 离子反应发生的条件 (离子不能大量共存的规律)-- 物质之间能发生复分解反应
生成难溶物或微溶物:如Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-、Ca2+与OH-、Mg2+与CO32-、OH-等之间发生离子反应。
生成气体或挥发性物质:如NH4+与OH-,H+与OH-、CO32-、HCO3-、S2-、HS-、HSO3-、SO32-等之间发生离子反应。
生成弱电解质:如H+与CH3COO-、CO32-、S2-、SO32-、F-等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱;H+与OH-生成水(水也是种弱电解质)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com