
4.下列反应的离子方程式正确的是A
①亚硫酸钠溶液中加入硝酸: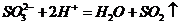
②石灰水跟稀硝酸反应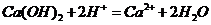
③向稀氨水中加入稀盐酸
④碳酸钙溶于醋酸中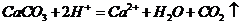
⑤向氢氧化钙溶液中加入少量碳酸氢钙溶液:
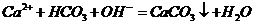
⑥硫化钠的水解:
A.③⑤ B.①③ C.①③④ D.②④⑥
3、已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入2molSO2、1molO2, 初始时两容器的温度、体积相同。一段时间后反应达到平衡。为使两容器中的SO2在平衡混合物中的物质的量分数相同,下列措施中不可行的是B
A. 向乙容器中充入一定量的SO3气体 B. 增大甲容器的压强
C. 向甲容器中充入一定量的氦气 D. 降低乙容器的温度
2.下列有关除杂的叙述正确的是A
①除去苯中的苯酚:加入浓溴水后,过滤
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去CO2中少量的SO2:气体通过盛有NaOH溶液的洗气瓶
④除去碳酸钠中少量的碳酸氢钠:将混合物灼热
A.②④ B.③④ C.①② D.只有②
1.下列关于化学学习和研究的说法错误的是C
A.化学模型有助于解释一些化学现象
B.质量守恒定律是大量试验事实的总结
C.化学家提出的假设都能被试验证明
D.化学基本原理的应用是有一定条件的
当然,引用名句、谚语或典籍中的话组织在自己的语句中时,还可以在内容或形式上作适当改造。而这种活用,往往带有特殊的修辞色彩,这里就不再赘述了。
例文1
吉林 考生
作文话题像一叶小舟,负载着心灵在诗海游渡。关于“选择”的名句珍珠,是这般感人至深、璀璨夺目!
--题记
屈原:亦余心之所善兮,虽九死其犹未悔。
“路漫漫其修远兮,吾将上下而求索。”爱国诗人屈原,一生都在为富国强民而探索着,然而怀王昏庸、奸佞当道,屈原的种种努力都因为“忠不被用”而无济于世。是随波逐流、从俗偷生,还是宁为放逐也不苟且?这两句诗如实地表达了屈原毅然决然的人生抉择;坚持我的追求,执著我的所爱,继续我的奋斗,即使为此九死一生也决不后悔!正因为屈原有此伟大的选择,他才能深思高举、正道正行,成为伟大的爱国诗人,其英名业绩“与天地比寿,日月齐光”。
李白:安能摧眉折腰事权贵,使我不得开心颜!
大诗人李白虽自信“天生我材必有用”,“我辈岂是蓬蒿人?”但他并未得到朝廷的重用。长安3年,不过是供统治者“歌舞升平”、“浅吟低唱”的御用文人。“大济苍生”成泡影,满腹经论无所用。然而,李白毕竟是李白,他不为高官而奉迎,不图厚禄而谄媚,在去留、穷达的十字路口上,毅然选择了不“摧眉折腰”;宁为玉碎,不为瓦全,以其正直、伟岸、潇洒,成就了他那豪放、脱俗、飘逸的伟大品格。
于谦:粉骨碎身全不怕,要留清白在人间。
此诗题为《石灰吟》,但远远不止吟咏石灰。作者托物言志、设喻抒怀,充分体现了他的人生观、价值观,是作者理想的追求、人生的选择。于谦少有大志,23岁中第入仕,直至担任兵部尚书之重职,如果他不能握好“选择”这把双刃剑,势必为剑所伤,成为罪恶的俘虏。正因为他有“要留清白在人间”的崇高选择,才能具备“粉骨碎身全不怕”的志节,才能秉持“清风两袖朝天去”的廉洁,才能成为忠勇如岳飞的民族英雄,德高似包拯、海瑞的一代清官。
林则徐:苟利国家生死以,岂因祸福避趋之?
面对列强入侵、朝廷昏庸、民族危亡,林则徐果断地选择了“虎门销烟”,何以有此决心和行动?这两句诗就是其人生追求、人格理念 、价值取向的具体写照:只要有利于国家民族,我就尽志而为,虽死不辞,怎能因为是祸就躲避,是福就争取呢?或许有人会说:“此诗写于‘销烟’之后。”不错,时间上的确如此,但这种伟大的情志早已根植于心胸、融会于血液,成为他人生的准则、行为的指南,并与其联语“海纳百川,有容乃大;壁立千仞,无欲则刚”相辅相成,共同铸就了他人生的伟大与不朽。
简评:本文构思别具一格,在选材上既不讲生动的故事,也不发长篇的议论,而是精选几个自己曾背诵过的名句作解释,谈体会,巧妙引用到文中。屈原选择正直爱国,李白选择高傲豪放,于谦选择清廉执著,林则徐选择忠诚勇敢,他们的选择成就了他们崇高的人格和辉煌的人生。四则材料直接证明了“人生重在选择”。
例文2
山东 考生
栀子花开的时节,空气中有浓郁的花香和泥土的气息。这一夜花开得太纵情,似乎就要“一朝春尽红颜老”,惹得些惜花之人捶胸顿足祈雨降临。
一夜的春风恣肆。一夜酝酿,雨却半滴未降,却将栀子刮得满地枝丫,“零落成泥碾作尘”。当天空透出曙色,那雨却不知回头地打在了窗玻璃上,撕碎了赏花之人怜香惜玉之心。
昨夜雨,今朝下。
却是憔悴损,满地黄花堆积。李商隐诗曰:“此情可待成追忆,只是当时已惘然。”多多少少带此韵味吧。人所怜惜爱花的美,倾注了感情的全部。甚或人世的经历,孤独和理想、压抑和激情、坎坷和智慧、劳碌和责任,一路牵绊,人无可自拔地沉溺其间,不可更改地在心头打下了“情结”,任谁也不能动摇。可恨那雨,却不知时节地降临,怎不叫人恨得牙痒痒?
都是雨。昨夜与今朝,白驹过隙。却因着人心深处的“亲疏”,认知全然迥异,感情全然偏颇。
很多时候,人就活在自设的感情樊笼里。
遥想夜泊秦淮的亡国商女,隔江犹唱《后庭》遗曲。那桨声灯影里的秦淮人,细数秦砖汉瓦,停舟暂相问,却是柯烂斧锈,几度沧桑。他们无一例外地抱着深切的亡国之痛,恨透“宫阙万间都作了土”,亦会像怨妇悲夫,慈亲哭儿般记起“雕栏玉砌应犹在,只是朱颜改”。问居异国的南唐后主李煜,悲切吟叹“流水落花春去也,天上人间”。
然而他们,都因着自身感情的囚笼作囚兽之斗,永远没能走出去。他们都沉溺于感情的自定认知而丧失了对生活的追求。
言及此,想到一词。明日黄花。
惊心一颤,唯有摆脱狭隘的情感桎梏,才能发现新的花朵。过去的已淡远。
留着的,仅是可成追忆的惘然。
君不见,那挂满露珠的栀子枝头,重又结出了剔透的芽儿?
简评:这是一篇内容深刻、语言优美的议论性散文。与一般的议论文相比在说理手段上它更具文学色彩。这主要得力于作者饱含深情的语言和大量诗词的运用。从开头“一朝春尽红颜老”到后面陆游、李商隐、李煜等人名句的引用,使抽象的哲理变得形象可感。
例文3
湖北 考生
古人云:“感时花溅泪,恨别鸟惊心。”其实这句诗正说明了景随情迁的道理。对事物的认识和一个人的感情有很大关系。
对于常人来说,一粒沙子就是沙子,而在诗人的眼里,一粒沙子可以弥漫整个世界,一滴水珠在诗人眼里便可折射出整个世界。因为诗人富于感情,对事物的认识便不同于一般人。“一千个人眼中有一千个哈姆雷特。”也可能是由于人们对事物感情的亲疏不同造成的。
在“人比黄花瘦”的女词人李清照眼里,她前期的生活安定、幸福,且少受战乱之苦,因此她才会“兴尽晚回舟,争渡,争渡,惊起一滩鸥鹭”;然而世事沧桑,后期的她饱受战争流离之苦、丧夫之恨,对于她来说,这时的舟已是“载不动许多愁”。前一舟是幸福愉快的载体,后一舟却成为愁绪与痛苦的寄托。难道是舟变了吗?不,是她的感情变了--物是人非事事休。她对事物的认识或对或错其实本无定论,答案是丰富多彩的。
有人说,中国人缔造了月。这话其实并未夸大,在科学上,月只是一块毫无生命和感情的矿石,但由于中国无数诗人美丽的诗篇却赋予了月亮以不朽的生命。在王维的诗中有云:“明月松间照,清泉石上流。”张继诗云:“月落乌啼霜满天,江枫渔火对愁眠。”李白的诗:“人生得意须尽欢,莫使金樽空对月。”苏轼的词:“明月几时有,把酒问青天。”这些优美的诗句,至今细细品味,仍给人口有余香、不绝于耳的感觉。但我们同时也会发现诗人的感情却不尽相同:王维的安逸,张继的失意,李白的狂放不羁,苏轼的入世旷远。也正是如此,对于同一事物--月的认识也不尽相同。同样,对于其他事物,诗人们也同样有不同的认识:有人喜春,有人悲春,有人伤时,更有人感时。感情却是对事物认识的一个基点,一个发散源。
千百年后,我国伟大的领袖毛泽东的“天若有情天亦老,人间正道是沧桑”则抒发了一代伟人豁达的胸襟和壮志豪情。他对于“天”这一事物的认识也正是与他宏大的志向和博大的胸怀联系在一起的。
因此,人的感情亲疏不同,对事物的认识便也不同。所谓“情人眼里出西施”,感情亲则对事物爱好,感情疏则对事物厌倦。其实,这本是见仁见智的。
简评:入题的巧妙,众多的名诗名句是本文的突出特色。开篇以杜甫诗句作引子,开门见山提出了“景随情迁的道理”。接着以李清照、王维、张继、李白、苏轼、毛泽东等名人名句为例,从不同角度,不同侧面分析了情感和意象的关系。最后,水到渠成,揭示了主旨“人的感情亲疏不同,对事物的认识便也不同。”
例文4
四川 考生
一个圆,有人看来是一轮红日,有人看来是一轮满月,有人看来是一个封闭不与外界沟通的思想,有人看来是一个永远走不出的迷宫。多样的人, 多样的思维,多样的答案,无限的多样性
构成了一个如此丰富多姿的世界。
秦砖汉瓦,唐风宋雨,古人们在诗词的浩浩海洋中给我们塑造了一个全新的艺术境界,同是送别,王维“劝君更进一杯酒,西出阳关无故人”;李太白“桃花潭水深千尺,不及汪伦送我情”;王子安“无为在歧路,儿女共沾巾”;高适“莫愁前路无知己,天下谁人不识君”。同是惜时,李太白“生者为过客,死者为归人,天地一逆旅,同悲万古尘”;曹孟德“人生几何?去日苦多”。同是咏梅,陆游“零落成泥碾作尘,只有香如故”;王安石“遥知不是雪,为有暗香来”;而毛泽东则“风雨送春归,飞雪迎春到,已是悬崖百丈冰,犹有花枝俏,俏也不争春,只把春来报,待到山花烂漫时,她在丛中笑!”同是黄昏日落,李商隐“夕阳无限好,只是近黄昏”;而毛泽东则“雄关漫道真如铁,而今迈步从头越,从头越,苍山如海,残阳如血”。同是战争残酷,曹孟德慨叹“千里无鸡鸣”;而毛泽东则“战地黄花分外香”。你能说,谁人更佳,谁人更出色?不不不,不同的人,不同的个性,不同的思维,谁都不可以对之妄加否定!
前日偶读一文《我们究竟在考什么》,文中阐述了这样一个故事,一个物理系的高才生面对用一个气压计如何测楼高的简单物理问题,坚持用十多种不同于标准答案的方法予以解决,最妙的一种是轻敲守门人的房间,再问:“请问这座楼楼高多少?”哑然失笑之余,给了我们无尽的思考:在面对一个实际问题时,究竟是一个标准答案好呢?还是鼓励多种多样的思维方式呢?
近日偶看一画展,画的是幼儿园的小朋友眼中的太阳,有的是红色的太阳,名曰《光明》,有的是蓝色的太阳,名日《地球的颜色》,有的是黑色的太阳,名曰《灰尘满天的可怜的太阳》,惊奇之余,我愕然,看着这些稚气未脱的字迹,我惊叹于那无限的想像力。
无限的多样性归根于个性的多样性,在这个崇尚创造的世界里,在这个崇尚创新的时代里,它是最最不可忽视的。很难想像,没有创造,我们很可能还生活在茹毛饮血,混沌未开的原始社会,我们很可能还在黑暗中挣扎,我们很可能还在大自然的淫威下不知所措。
崇尚创造,接纳并鼓励这种无限的多样性吧!记住,“第一个形容女人是花的是天才,第二个这样形容的是庸才,第三个这样形容的是大大的蠢才!”
简评:本文的成功主要得力于恰到好处地引用诗词名句。特别是第二段最为出彩,作者以“送别”、“惜时”、“咏梅”、“黄昏日落”、“战争残酷”为例,将众多诗句相互对照,不仅有力地表现了“答案是丰富多彩的”这一主旨,而且使文章文采斐然、韵味无穷。
①不能与H+共存的离子有 、
②不能与OH-共存的离子有 、
③不能与HCO3-共存的离子有 、
④不能与Al3+共存的离子有 、
⑤不能与AlO2-共存的离子有 、
⑥不能与Fe3+共存的离子有 、
⑦不能与Fe2+共存的离子有 、
⑧不能与ClO-共存的离子有 、
试题枚举
[例1] (2006江苏,13)下列叙述正确的是
A.0.1mol·L-1氨水中,c(OH-)==c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)==c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)==2c(A2-)+c(HA-)+c(H2A)
解析:NH3·H2O是弱电解质,它本身电离所产生的两种离子浓度相等,得氨水中的部分OH-来自于H2O的电离,所以c(OH-)>c(NH4+),A错;B项中酸碱中和反应后,
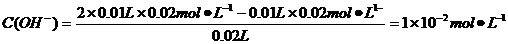
pH=-lgC(H+)=-lg(10-14/10-12)=12,B正确;根据盐的消解规律,可以判断C正确;D项中因钠元素的离子与A原子的物质的量之比为1∶1,对应关系应该为c(Na+)=c(A2-)+c(HA-)+c(H2A),D错。
答案:BC
[例2] (2006四川,12)25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的PH=7时,下列关系正确的是
A.c(NH4+)==c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-)==c(H+)+c(NH4+)
解析: 氨水与稀硫酸反应,至溶液呈中性,即c(H+)=c(OH-);根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),则D错;将前两个等式融合得, c(NH4+)=2c(SO42-),则A错,B对,C错。
答案: B
[例3] 已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
解析:0.1 mol·L-1的强酸pH=1.0,0.1
mol·L-1的H2A溶液pH=4.0,说明它是一种弱酸。Na2A发生水解A2-+H2O HA-+OH-和HA-+H2O
HA-+OH-和HA-+H2O H2A+OH-,溶液中存在HA-、A2-、H+、OH-;NaHA发生水解HA-+H2O
H2A+OH-,溶液中存在HA-、A2-、H+、OH-;NaHA发生水解HA-+H2O H2A+OH-和电离HA-
H2A+OH-和电离HA- H++A2-,溶液中存在HA-、A2-、H+、OH-,所以两溶液中离子种类相同,A不正确。
H++A2-,溶液中存在HA-、A2-、H+、OH-,所以两溶液中离子种类相同,A不正确。
物质的量相等的Na2A和NaHA因为存在上述水解、电离等过程,阴离子数量发生变化,所以阴离子总量不相等,B不正确。
由电荷守恒可知c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),C正确。Na2A溶液显碱性,c(OH-)>c(H+),D不正确。
答案: C
[例4] 化合物SOCl2是一种液态化合物,沸点77 ℃。在盛有10 mL水的锥形瓶中,小心地滴加8-10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
(1)根据上述实验,写出SOCl2和水反应的化学方程式:________________。
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,原因是________________。
解析:水解的本质是化合物中带正电的基团结合水中电离产生的OH-,而带负电部分结合水中电离产生的H+。据题给信息分析,产生的刺激性气体应是SO2,它是由SO2+结合OH-转化成H2SO3,而另一带负电的Cl-结合水电离的H+生成HCl,与AgNO3反应生成白色的AgCl沉淀。
答案: (1)SOCl2+H2O====SO2↑+2HCl
(2)因为蒸干AlCl3溶液时,由于AlCl3水解生成的HCl易挥发,而得到Al(OH)3,但当与SOCl2混合共热时,由于SOCl2极易吸水,防止了AlCl3的水解,有关的化学方程式为6SOCl2+AlCl3·6H2O====6SO2↑+AlCl3+12HCl
[例5]用酚酞、石蕊、0.1mol/L氨水、氯化铵晶体、0.1mol/L盐酸、熟石灰和蒸馏水,若仅用上述试剂怎样用简单实验方法证明氨水是弱碱?并指出是通过什么途径证明氨水是弱碱的?
解析:证明氨水是弱碱,可通过两条途径:一是证明氨水中存在电离平衡,如方案(1)。另一是证明NH4+作为弱碱阳离子能破坏水的电离平衡发生水解反应,如方案(2)、(3)。
答案: 方案(1)取少量氨水,滴加酚酞,溶液呈红色,然后向其中加人少量CH3COONH4晶体,振荡,可看到红色变浅,说明氨水中存在电离平衡,氨水为弱碱。
方案(2)取少量NH4Cl晶体溶于水,滴加石蕊试液,溶液显红色,说明NH4+水解生成了NH3·H2O和HCl,从而破坏了水的电离平衡,亦说明氨水是弱碱。
方案(3)将 0.1mol/L NH3· H2O与0.1mol/L盐酸等体积混合,再滴加石蕊试剂,溶液显红色,说明NH4+水解破坏了水的电离平衡,从而说明氨水是弱碱。
[变式]解释说明化学事实:向盛有少量Mg(OH)2 悬浊液培养皿中加入适量的饱和氯化铵溶液。现象
讨论解释其原因:同学甲:实验中存在Mg(OH)2的溶解、结晶平衡: Mg(OH)2(固)
 Mg2++2OH-。当加入NH4Cl时,由于NH4+水解,NH4++H2O
Mg2++2OH-。当加入NH4Cl时,由于NH4+水解,NH4++H2O NH3·H2O+H+,使溶液呈酸性。H++OH-=H2O,从而使溶液中[OH-]减小,促进Mg(OH)2溶解,使溶液澄清。同学乙:实验中加入NH4Cl后,溶液中NH4+可与OH-结合从而使Mg(OH)2的溶解平衡右移使溶液澄清。甲、乙同学的两种解释谁的更有道理?
通过实验来进一步验证:
。为什么乙更合理?
NH3·H2O+H+,使溶液呈酸性。H++OH-=H2O,从而使溶液中[OH-]减小,促进Mg(OH)2溶解,使溶液澄清。同学乙:实验中加入NH4Cl后,溶液中NH4+可与OH-结合从而使Mg(OH)2的溶解平衡右移使溶液澄清。甲、乙同学的两种解释谁的更有道理?
通过实验来进一步验证:
。为什么乙更合理?
答案: Mg(OH)2溶解,使溶液澄清;乙同学的解释合理;向盛有少量Mg(OH)2悬浊液的培养皿中加入CH3COONH4 固体,观察悬浊液是否变澄清。CH3COONH4属弱酸弱碱盐,虽强烈水解但溶液呈中性。同时,CH3COONH4溶液中也有大量NH4+,若Mg(OH)2没有溶解,说明甲同学的解释正确。若Mg(OH)2溶解,则说明乙同学的解释正确;因为Mg(OH)2比 NH3· H2O的碱性强。
Ⅰ.判断溶液的酸碱性: ;
Ⅱ.判断不同弱电解质的相对强弱: ;
Ⅲ.比较溶液中离子浓度:
①同一溶液中不同离子浓度: 、
②不同溶液中相同离子浓度: 。
Ⅳ.解释某些化学现象及在生产生活中的应用: 。
。
⑴电荷守恒:电解质溶液中阴、阳离子所带的正、负电荷数相等,即溶液不显电性。如磷酸溶液中,c (H+)= c (OH-)+ c(H2PO4-)+2 c(HPO42-)+3 c(PO43-)
⑵物料守恒:就是电解质溶液中某一组分的原始浓度(起始浓度)应该等于它在溶液中各种存在形式的浓度之和。如0.1mol/L的NaHS溶液,0.1= c (HS-)+ c (S2-)+ c (H2S)或
c (Na+)= c (HS-)+ c (S2-)+ c (H2S)
⑶原理守恒:水电离的特征是c (H+)= c (OH-),据此可以得出下列关系如在K2CO3溶液中:c (OH-)= c (H+)+ c (HCO3-)+2(H2CO3)(也称质子守恒)
例题:分别以①H2S②NaHS③Na2S为例离子浓度的守恒关系:
⑴物料守恒① 、
② ③
⑵电荷守恒:① ②
③ ;
⑶质子守恒:① ②
③ 。
①多元弱酸溶液,根据多步电离分析,如在H3PO4的溶液中,c (H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)
②多元弱酸的正盐溶液根据弱酸根的分步水解分析,如Na2CO3的溶液中,c (Na+)>c(CO32-)>c(OH-)>c(HCO3-)
③不同溶液中同一离子浓度的比较,要看溶液中其他离子对其影响的因素。如在相同的物质的量浓度的下列各溶液中a、NH4Cl b、CH3COONH4 c、NH4HSO4。c(NH4+)由大到小的顺序是 c>a>b。
④ 混合溶液中各离子浓度的比较,要进行综合分析,如电解因素、水解因素等。
分别以H2S、NaHS、Na2S为例:
①离子浓度的大小比较:H2S 、NaHS 、Na2S 。
①强酸弱碱盐的水解:溶液呈酸性,弱碱阳离子水解
②强碱弱酸盐的水解:溶液呈碱性,弱酸根离子水解
③弱酸弱碱盐的水解程度很大,溶液的酸碱性决定与酸碱性的相对强弱
Ⅰ.酸强于碱显酸性,如(NH4)2SO3
Ⅱ.碱强于酸显碱性,如NH4CN
Ⅲ.酸碱强弱相当的呈中性,如CH3COONH4
④强酸强碱盐,不水解,呈中性
⑤弱酸的酸式盐水解,酸取决于酸根离子的电离程度和水解程度的相对大小
Ⅰ如电离程度大于水解程度,以电离为主,溶液呈酸性,如NaHSO3、NaH2PO4
Ⅱ如水解程度大于电离程度,以水解为主,溶液呈碱性,如NaHCO3、Na2HPO4、NaHS
⑥完全双水解的盐,如Al3+与HCO3-、CO32-、S2-、AlO2-等发生双水解进行到底。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com