
4.导体内 在电场力作用下重新分布,使导体两端出现 的现象叫静电感应。导体中(包括表面)没有电荷定向移动的状态(此时导体中的自由电荷受到的力达到平衡)叫做 。导体处于静电平衡状态时其内部场强 ;电荷只分布在导体的 ,导体内部没有 ;电场线 导体的表面。(参考答案:自由电荷、等量异种电荷、静电平衡、处处为零、外表面、净电荷、处处垂直于)
[范例精析]
 例1
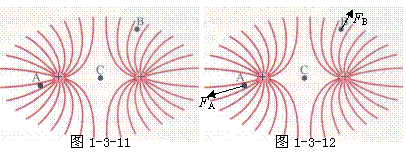
如图1-3-11,考察电场中的A、B、C 三个点的电场强度。先画出单位正电荷在这三个点所受的力的方向;然后从大到小,排列力的大小。
例1
如图1-3-11,考察电场中的A、B、C 三个点的电场强度。先画出单位正电荷在这三个点所受的力的方向;然后从大到小,排列力的大小。
解析 正试探电荷所受电场力的方向就是电场 方向。单位正电荷在A、B两点的受力方向如图1-3-12所示。因为C点是两场源电荷的连线的中点,所以试探电荷在C点受力等于零。单位正电荷在A、B、C三点的受力大小关系是FA>FB>FC。
拓展 根据两等量正点电荷的电场线分布图,试判断两等量正点电荷的连线的垂直平分线上的电场强度的方向如何?
例2下列关于电场线的论述正确的是( )
A.电场线方向就是正试探电荷的运动方向
B.电场线是直线的地方是匀强电场
C.只要初速为零,正电荷必将在电场中沿电场线方向运动
D.画有电场线的地方有电场,未画电场线的地方不一定无电场
解析 电场线的方向为电场方向,即正电荷所受电场力的方向;电场线是直线的电场不一定就是匀强电场,如孤立点电荷的电场;电荷能否沿电场线运动取决于电荷的初速是否为零、电荷的初速方向如何、电荷受不受电场力以外的其它力作用、电场线是直线还是曲线等因素。故只有D选项正确。
拓展(1)仔细观察课本图1.3-6和1.3-7,指出哪些电场中的电场线都是直线?哪些电场中的电场线有直线?(2)在什么条件下电荷的运动轨迹和电场线是重合的?
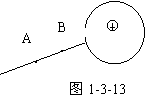 例3 如图1-3-13所示,一个带正电的小球从金属球壳的
例3 如图1-3-13所示,一个带正电的小球从金属球壳的
小孔放入球内但不跟球壳内壁接触。图中画出了球外电场的一
条电场线,此时该电场线的方向如何?用手触摸一下球壳,再
将球壳内的带电小球取出,则此时该电场线的方向又如何?
解析 原来不带电的金属空心球壳处于正电荷的电场中,
发生静电感应,静电平衡时球壳的内壁带负电,外壁带正电,因而球外电场线的方向应由B指向A;若用手接触一下球壳,则球壳外表面的正电荷全部消失,再将正电荷取出,此时球壳内壁原来的感应负电荷将全部分布于球壳外表面,再次达到静电平衡时,球壳内部场强处处为零,外部电场线方向由A指向B。
拓展 手接触球壳,相当于将球壳接地,故球壳外表面的正电荷全部消失,但是球壳内表面的负电荷却被小球所带的正电荷吸引住了,不会因球壳接地而减少。此时若将正电荷从球壳中取出,则球壳内壁原来的感应负电荷由于彼此排斥而将全部分布到球壳外表面。
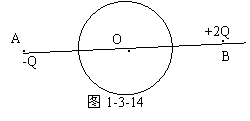 例4 如图1-3-14所示,在真空中有两个点电荷A和B,电量分别为-Q和+2Q,它们相距为l,如果在两点电荷连线的中点O有一个半径为r(2r<l)的金属球,且球心位于O点,则球壳上的感应电荷在O点处的场强大小为 ,方向为 。
例4 如图1-3-14所示,在真空中有两个点电荷A和B,电量分别为-Q和+2Q,它们相距为l,如果在两点电荷连线的中点O有一个半径为r(2r<l)的金属球,且球心位于O点,则球壳上的感应电荷在O点处的场强大小为 ,方向为 。
解析 先求点电荷A、B在O点产生的场强,E0=
2kQ/(l/2)2+kQ/(l/2)2=12kQ/l2,方向沿AB连线指向A。静电平衡后,球壳内部场强处处为零,说明感应电荷在O点产生的场强E’与E0大小相等,方向相反。即 E’=-E0=-12kQ/l2,负号表示感应电荷的电场方向与E0相反。(沿AB连线指向B)
拓展 导体处于静电平衡状态时,其内部场强处处为零。结合本例来说,就是在导体内部任意一点处,感应电荷产生的场强与引起静电感应的电荷(即A、B两处的电荷)产生的场强等大反向,合场强为零。
[能力训练]
3.在电场的某一区域内,如果各点的场强 都相同,这个区域的电场就叫做匀强电场。匀强电场中的电场线是 分布的 直线。
2.如果在电场中画出一些曲线,使曲线上每一点的 方向都跟该点的 方向一致,这样的曲线就叫做电场线。电场线起始于 电荷,终止于 电荷;电场线不 也不 ;任意两条电场线不 ;电场线密集的地方电场 ,电场线稀疏的地方电场 。
[要点导学]
本节主要讨论电场线匀强电场。
1.为了直观的描述电场,英国物理学家 提出了用电场线描述电场的方法。
2.根据元素的单质及其化合物的性质进行判断。
(1)金属性强弱判断原则
①根据单质与水(或酸)反应,置换出水(或酸)中的氢的难易程度来判断:
一般地,能与水反应产生氢气的金属元素的金属性比不能与水反应的金属元素的强,与冷水反应产生氢气的金属元素的金属性比只能与热水反应产生氢气的金属元素的强。
②根据元素的最高价氧化物对应的水化物的碱性强弱来判断:
一般地,元素的最高价氧化物对应的水化物的碱性越强,则对应的金属元素的金属性就越强。反之,则越弱。
③根据置换反应进行的方向来判断:一般是“强”置换“弱”。
④根据金属元素的单质的还原性(或离子的氧化性)来判断:
一般情况下,金属阳离子的氧化性越强,则对应的金属单质的还原性越弱,金属元素的金属性也就越弱。
⑤根据原电池的正、负极及金属腐蚀的难易程度来判断:一般地,负极为金属性强的元素的单质,容易腐蚀。
(2)非金属性强弱判断原则
①根据单质与H2反应生成气态氢化物的剧烈程度或生成的气态氢化物的稳定性强弱来判断:
一般地,单质与H2反应生成气态氢化物越容易,或反应生成的气态氢化物越稳定,则对应的非金属元素的非金属性越强;反之,则越弱。
②根据元素最高价氧化物对应的水化物的酸性强弱来判断:
一般地,元素的最高价氧化物对应的水化物的酸性越强,则对应的非金属元素的非金属性就越强。反之,则越弱。
③根据置换反应进行的方向来判断:一般是“强”置换“弱”。
④根据非金属单质的氧化性(或离子的还原性)强弱来判断:
一般情况下,非金属阴离子的还原性越强,则对应的非金属单质的氧化性越弱,非金属性元素的非金属性也就越弱。
⑤根据与同一种金属反应,生成化合物中金属元素的化合价的高低进行判断。例如: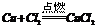 ,2Cu+S=Cu2S,即得非金属性:Cl2>S。
,2Cu+S=Cu2S,即得非金属性:Cl2>S。
特别提醒
一般来说在氧化还原反应中,单质的氧化性越强(或离子的还原性越弱),则元素的非金属性越强;单质的还原性越强(或离子的氧化性越弱),则元素的金属性越强。故元素的金属性和非金属性的强弱判断方法与单质的氧化性和还原性的强弱判断方法是相一致的。
[例3](2008·北京)下列叙述正确的是( )
A.IA族元素的金属性比IIA族元素的金属性强
B.VIA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增加
D.第三周期元素的离子半径从左到右逐渐减小
[解析]本题考查元素周期律,元素性质的递变,同一周期IA族元素的金属性比IIA族元素的金属性强,但不同周期不能确定;氢化物的沸点还要考虑氢键;同周期非金属最高价氧化物对应的水化物的酸性从左到右依次增加;第三周期元素的阴、阳离子半径从左到右逐渐减小,但阳离子半径大于阴离子半径,故选B。
[答案]B
考点4 元素“位-构-性”之间的关系

特别提醒:元素性质和物质结构的常用的突破口
(1)形成化合物种类最多的元素是碳。
(2)某元素的最高价氧化物的水化物能与其气态氢化物化合生成盐,该元素是氮。
(3)在地壳中含量最多的元素是氧,在地壳中含量最多的金属元素是铝。
(4)常温下呈液态的非金属单质是溴,金属单质是汞。
(5)气态氢化物最稳定的元素是氟。
(6)三种元素最高氧化物对应的水化物两两皆能反应,则必定含有Al元素。
(7)焰色反应呈黄色的元素是钠,焰色反应呈紫色的元素是钾。
(8)最高价氧化物对应水化物酸性最强的元素是氯。
(9)单质的硬度最大的元素是碳。
(10)化学式为A2B2形的化合物,则只可能为Na2O2、H2O2、C2H2。
[例4](2007·江苏)有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
[解析]由题目推知,X位于Y的上方,是属于同主族元素,所以当X(OH)n为强碱,则Y(OH)n也一定为强碱,A正确。若X为N,则NH3显碱性,B不正确。若X为H,则C错误。若Y为Cl,则X为F,而F是通常是没有正价。
[答案]A
1.根据元素周期表的知识进行判断
①同一周期,从左到右,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强。元素周期表中最活泼的金属是Fr,天然存在的最活泼的金属是Cs;最活泼的非金属元素是F。
②同一主族,从上到下,随着原子序数的递增,元素的金属性逐渐增强,非金属性逐渐减弱。元素周期表左边为活泼的金属元素,右边为活泼的非金属元素;中间的第VIA、VA族则是从非金属元素过渡到金属元素的完整的族,它们的同族相似性甚少,但具有十分明显的递变性。
有关化学平衡的计算题在高考理综试题中出现的频率很高,然而,无论什么类型的计算题,我们都可以利用“三行式”去分析解决,建立这种思维模式,学生无论遇到怎样复杂的试题时都不至于无从下笔。具体方法为:在可逆反应方程式下面列出到达平衡的过程中,各物质的起始量、转化量和平衡量(其中的“量”为物质的量或浓度,但必须一致),然后根据题中信息找关系,再列方程式计算。
例4.
X、Y、Z三种气体,取X和Y按1︰1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.66%
解析:本题考查有关化学平衡的计算。虽然题中没有给出具体数据,但可以引入数据,列出三行式,再找关系列比例式计算。由题意,X和Y物质的量之比为1︰1,不妨假设均为amol,且设X的变化量为x mol,则可建立以下三行式:
X + 2Y 2Z
2Z
起始量(mol): a a 0
变化量(mol): x 2x 2x
平衡量(mol):(a-x) (a-2x) 2x
= ∴x=
则Y的转化率为 a÷×100%≈67%,答案为D。
对于化学平衡移动问题的分析可建立以下思维模式:

条件改变 平衡移动 各种量变
由外界条件的改变结合反应的特点(正反应为吸热还是放热反应、正反应是气体体积增大还是缩小的反应)可以判断平衡移动的方向,平衡移动必然导致各种量变;反过来,由题目告知的量变信息,可以反过来判断平衡移动的方向,再由平衡移动的方向结合反应特点(或条件的改变)可以判断条件的改变(或反应特点)。那么,在具体解题时,我们所要做的是由题中信息分析“条件的改变”、“反应的特点”、“各种量变”等内容,然后根据它们的联系作答。
例2.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应
mX(g) nY(g) △H= QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) △H= QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
 气体体积
气体体积 c(Y) c(Y)温度 |
1 |
2 |
3 |
|
100℃ |
1.00
mol·L-1 |
0.75
mol·L-1 |
0.53
mol·L-1 |
|
200℃ |
1.20
mol·L-1 |
0.09
mol·L-1 |
0.63
mol·L-1 |
|
300℃ |
1.30
mol·L-1 |
1.00
mol·L-1 |
0.70
mol·L-1 |
下列说法正确的是( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
解析:本题根据表格数据考查化学平衡移动问题。由表中数据可得出条件改变和各种量变间的关系,从而可以分析得出该反应的特点。根据表中数据,若温度恒定为100℃,当气体体积由1变为2时,c(Y) 由1.00mol·L-1变为0.75mol·L-1,根据过程假设的思想,把这个过程假设为两个阶段,第一个阶段为气体体积由1变为2,但平衡未移动,则压强变为原来的一半,c(Y)变为0.50mol·L-1,第二个过程为压强变为原来的一半后,平衡发生移动,使c(Y)由0.50mol·L-1变为0.75mol·L-1,则可以看出减压使c(Y)增大,平衡正向移动,所以正反应为气体体积增大的反应,∴m<n,A选项错;若气体体积为1不变时,从表中数据可看出,升温使c(Y)增大,即升温使平衡正向移动,说明正反应为吸热反应,∴Q>0,B、D选项均错;压强增大,平衡逆向移动,则Y的质量分数减少,C选项对,答案为C。
例3.某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示
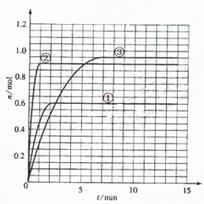
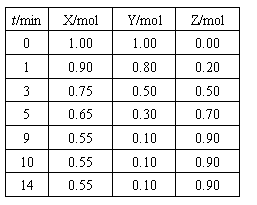
(1)体系中发生反应的化学方程式是 。
(2)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:① ,② ,③ 。
解析:(1)由参加反应的各物质的物质的量之比等于其化学计量数之比不难得出该反应的方程式为:X+2Y 2Z;(2)本小题通过图像考查平衡移动问题,从图像中我们可以分析得出各种量变情况,再结合反应特点可反推出条件的改变。由表格可看出,改变条件前,反应在第9min时达平衡,平衡时Z的物质的量为0.9mol,改变实验条件后,曲线①、②、③达平衡所需时间均缩短(小于9min),即反应速率均加快,则外界条件的改变为升高温度、增大压强或加入催化剂,其中①平衡时Z的物质的量减小为0.6mol,说明平衡逆向移动,结合正反应为放热反应,可知条件改变为升高温度;②平衡时Z的物质的量仍为0.9mol,说明平衡状态未改变,则为加入催化剂;③平衡时Z的物质的量增大为0.95mol,说明平衡正向移动,结合正反应为气体体积缩小的反应,可知条件改变为增大压强。
2Z;(2)本小题通过图像考查平衡移动问题,从图像中我们可以分析得出各种量变情况,再结合反应特点可反推出条件的改变。由表格可看出,改变条件前,反应在第9min时达平衡,平衡时Z的物质的量为0.9mol,改变实验条件后,曲线①、②、③达平衡所需时间均缩短(小于9min),即反应速率均加快,则外界条件的改变为升高温度、增大压强或加入催化剂,其中①平衡时Z的物质的量减小为0.6mol,说明平衡逆向移动,结合正反应为放热反应,可知条件改变为升高温度;②平衡时Z的物质的量仍为0.9mol,说明平衡状态未改变,则为加入催化剂;③平衡时Z的物质的量增大为0.95mol,说明平衡正向移动,结合正反应为气体体积缩小的反应,可知条件改变为增大压强。
答案:(1)X+2Y 2Z (2)升高温度
加入催化剂 增大压强
2Z (2)升高温度
加入催化剂 增大压强
可逆反应达到化学平衡状态后,反应混合物中各组分的浓度保持不变,实际上,不仅各组分的浓度,其他物理量也均保持不变。然而,当外界条件改变时,平衡将被破坏并发生移动,平衡移动则导致一些物理量发生变化。我们可以建立这样的思维模式去判断可逆反应是否达到平衡:若平衡移动必然导致某物理量发生改变,则一旦反应混合物中该物理量不再改变,说明可逆反应已达平衡。如,对于合成氨反应,恒温恒容时,平衡移动必然使总压改变,则当总压不变时,说明反应已达平衡;而对于反应H2(g)+I2(g) 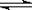 2HI(g),恒温恒容时,平衡移动总压不变,则不能根据总压来判断反应已达平衡。
2HI(g),恒温恒容时,平衡移动总压不变,则不能根据总压来判断反应已达平衡。
例1.将一定量的SO2和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550 ℃时,在催化剂作用下发生反应:2SO2+O2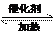 2SO3(正反应放热)。判断该反应达到平衡状态的标志是
。(填字母)
2SO3(正反应放热)。判断该反应达到平衡状态的标志是
。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
解析:SO2和SO3浓度相等仅仅是反应过程中某一瞬时的关系,a错;若平衡正向(或逆向)移动,必然导致SO2百分含量减小(或增大),容器中气体的压强减小(或增大),而容器中混合气体的密度不变,则b、c对,e错;d中“SO3的生成速率”与“SO2的消耗速率”均为正反应速率,错。答案:bc。
21.(本小题满分14分)
(1)用秦九韶算法求多项式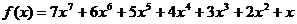
当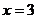 时的值。
时的值。
(2)假设你家订了一份报纸,送报人可能在早上6点-8点之间把报纸送到你家,你每天离家去工作的时间在早上7点-9点之间 ,求你离家前不能看到报纸(称事件A)的概率是多少?(须有过程)
三明一中2010-2011学年度上学期第一次月考
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com