
16.(广东湛江一中5月)a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为  ( )
( )
①(a+b)×63 g ②(a+b)×189 g
③(a+b) mol ④(Vc-)mol
A.①④ B.②③
C.①③ D.②④
解析:由元素守恒知:未被还原的硝酸将转化为Fe(NO3)3,所以显酸性的硝酸的物质的量等于 Fe(NO3)3的物质的量的3倍,由元素守恒知,n[Fe(NO3)3]=n(Fe)=(a+b)mol,所以未被还原的硝酸的质量=3(a+b)mol×63 g·mol-1=(a+b)×189 g,②正确;又根据化合价升降守恒知:
Fe(NO3)3的物质的量的3倍,由元素守恒知,n[Fe(NO3)3]=n(Fe)=(a+b)mol,所以未被还原的硝酸的质量=3(a+b)mol×63 g·mol-1=(a+b)×189 g,②正确;又根据化合价升降守恒知:
a mol →a mol (NO3)3+a mol H2O4 化合价升高:(3-2)a+(6+2)a=9a mol。
b
mol O→b mol (NO3)3 化合价升高:(3-2)b=b mol。
mol (NO3)3 化合价升高:(3-2)b=b mol。
x mol HO3→x mol O 化合价降低:(5-2)x=3x mol。
得9a mol+b mol=3x mol,即显氧化性的硝酸的物质的量x=(9a+b)/3 mol,所以未被还原的硝酸为(Vc-)mol,④正确。
答案:D
15.(2009·上海单科,7)在下列变化①大气固氮 ②硝酸银分解 ③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是 ( )
A.①②③ B.②①③
C.③②① D.③①②
解析:①大气固氮是将游离态的氮转化为化合态的氮,氮元素被氧化。②硝酸银分解生成NO2 ,氮元素被还原。③实验室制取NH3的反应为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,氮元素的化合价没有发生变化。故选A。
,氮元素被还原。③实验室制取NH3的反应为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,氮元素的化合价没有发生变化。故选A。
答案:A
14.已知下述三个实验均能发生化学反应
|
① |
② |
③ |
|
将铁钉放入硫酸铜溶液中 |
向硫酸亚铁溶液 中滴入几滴浓硝酸 中滴入几滴浓硝酸 |
将铜丝放入氯化铁溶液中 |
下列判断正确的是 ( )
A.实验①中铁钉只做还原剂
B.实验②中Fe2+既显氧化性又显还原性
C.实验③中发生的是置换反应
D.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
解析:实验②中Fe2+只显还原性;实验③中反应为2FeCl3+Cu===2FeCl2+CuCl2,而D项氧化性顺序为:Fe3+>Cu2+>Fe2+。
答案:A
13.(2009·广东)常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+===2Fe3++2H2O、2Fe3++H2O2===2Fe2++O2↑+2H+。下列说法正确的是 ( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不 变
变
D.H2O2生产过程要严格避免混入Fe2+
解析:发生的反应可以用总反应表示为2H2O22H2O+O2↑,其中Fe2+作催化剂;由两步反应分析知,氧化性H2O2>Fe3+,还原性H2O2>Fe2+。
答案:CD
12.(2009·全国卷Ⅱ)物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是 ( )
A.1:4 B.1:5
C.2:3 D.2:5
解析:设被还原的硝酸的物质的量为x,参与反应的锌和硝酸的物质的量分别为2 mol、5 mol。据得失电子守恒有(5-1)x=2×2 mol,x=1 mol,未被还原的硝酸即2 mol Zn2+结合的NO为4 mol,二者物质的量之比为1:4。
答案:A
11.(2009·福建)下列类型的反应,一定发生电子转移的是 ( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
解析:置换反应:
答案:C
9.(2008·广州市一中)常温下,在溶液中可以发生反应:X+2Y3+===2Y2++X2+,则有下列叙述①X被氧化;②X是氧化剂;③X是具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。以上叙述中正确的是 ( )
A.②④⑥ B.①③④
C.①③⑤⑥ D.②⑤
解析:X为还原剂,Y3+为氧化剂,Y2+为还原产物,X2+为氧化产物。一个反应中,还原剂和还原产物具有还原性,氧化剂和氧化产物具有氧化性,且还原剂的还原性大于还原产物的还原性,氧化剂的氧化性大于氧化产物的氧 化性。
化性。
答案:C
1 0.(2008·广东广州5月)将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上__________+__________―→__________+_
0.(2008·广东广州5月)将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上__________+__________―→__________+_ _________+__________+H2O组成一个未配平的
_________+__________+H2O组成一个未配平的 化学方程式,正确的顺序是 ( )
化学方程式,正确的顺序是 ( )
A.FeSO4、Fe(NO3)3;Fe2(SO4)3、HNO3、N2O
B.HNO3、FeSO4;Fe2(SO4)3、Fe(NO3)3、N2O
C.HNO3、Fe2(SO4)3;FeSO4、Fe(NO3)3、N2O
D.Fe2(SO4)3、N2O;FeSO4、HNO3、Fe(NO3)3
解析:依据所给物质的性质,可得到是HNO3将FeSO4氧化。
答案:B
8.(2009·山东省烟台市高三模块检测)“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子。下列说法不正确的是 ( )
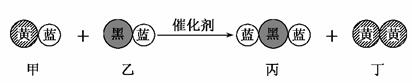
A.该反应属于氧化还原反应
B.甲和丙中同种元素化合价不可能相等
C.丁物质一定是非金属单质
D.配平后甲、乙、丙的化学计量数均为2
答案:B
7.(2009·皖西四校模拟)24 mL0.05 mol·L-1的Na2SO3溶液恰好与40 mL 0.02 mol·L-1的K2RO4酸性溶液反应生成硫酸钠,则元素R在还原产物中的价态是 ( )
A.+6 B.+3 C.+2 D.0
解析:设元素R在还原产物中的价态为+x,已知在K2RO4中R的化合价为+6,据电子守恒可得:0.05 mol/L×24×10-3L×(6-4)=0.02 mol/L×40×10-3L×(6-x),x=3。
答案:B
6.根据下表下列叙述中正确的是( )
|
序号 |
氧化剂 |
还原剂 |
其他反 应物 |
氧化 产物 |
还原 产物 |
|
① |
Cl2 |
FeBr2 |
|
|
FeCl3 |
|
② |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
MnSO4 |
|
③ |
KClO3 |
HCl(浓) |
|
Cl2 |
Cl2 |
|
④ |
KMnO4 |
HCl(浓) |
|
Cl2 |
MnCl2 |
A.表中第①组反应的氧化产物一定只有FeCl3(实为Fe3+)
B.氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性比较:H2O2>Mn2+>Cl-
D.④的离子方程式配平后,H+的化学计量数为16
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com