
4、下列叙述中,正确的是( AC )
A.同一反应中,氧化剂的氧化性比氧化产物的氧化性强
B.同一反应中,还原剂的还原性比还原产物的还原性弱
 C.由X原子变成X2+的反应是氧化反应
C.由X原子变成X2+的反应是氧化反应
D.由X原子变成X2+,需加入还原剂
3、下列反应中,盐酸只作氧化剂的是(A )
A.Zn+2HCl=ZnCl2+H2↑
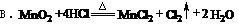
C.Cl2+H2O=HCl+HClO
D.CaCO3+2HCl=CaCl2+H2O+CO2
2.(2003.上海春季高考)苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止此种现象发生,这说明维生素C具有 ( B )
A. 氧化性 B.还原性 C. 碱性 D.酸性
1、下列变化中,需要加入氧化剂的是( AC )
A.SO2→SO3 B.HCl→H2
C.FeCl2→FeCl3 D.Fe2O3→Fe
4. (09上海卷24)某反应中反应物与生成物有:
(09上海卷24)某反应中反应物与生成物有: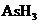 、
、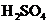 、
、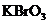 、
、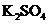 、
、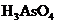 、
、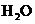 和一种未知物质X。
和一种未知物质X。

 (1)已知
(1)已知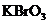 在反应中得到电子,则该反应的还原剂是
。
在反应中得到电子,则该反应的还原剂是
。
 (2)已知0.2mol
(2)已知0.2mol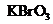 在反应中得到1mol电子生成X,则X的化学式为
。
在反应中得到1mol电子生成X,则X的化学式为
。
 (3)根据上述反应可推知
。
(3)根据上述反应可推知
。
 a.氧化性:
a.氧化性: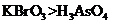 b.氧化性:
b.氧化性:
 c.还原性:
c.还原性: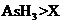 d.还原性:
d.还原性: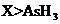
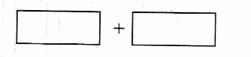
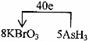
 (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:

 答案:
答案:
 (1)AsH3
(1)AsH3
 (2)Br2
(2)Br2
 (3)a c
(3)a c
 (4)
(4)

基础练习:
3.(08广东卷)氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3++N2+3C 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1molAlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
解析:N的化合价:0→-3,化合价降低,N2作氧化剂,C的化合价:0→+2,化合价升高,C作还原剂;Al的化合价无改变,所以既不是氧化剂也不是还原剂;AlN的摩尔质量为41g·mol-1。
答案:B
2.(08上海卷)已知在热的碱性溶液中,NaClO发生如下反应:3NaClO 2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
A.NaCl、NaClO B.NaCl、NaClO3 C.NaClO、NaClO3 D.NaClO3、NaClO4
解析:在已知反应中氯元素的化合价:+1→+5和+1→-1,既然NaClO2也有类似的反应,即氯元素的化合价既有升高,也有降低,选项A中均降低;选项B、C与题意相符;选项D化合价均升高,但选项C中NaClO不是最终产物。
答案:B
1. (09全国卷Ⅱ6) 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,
(09全国卷Ⅱ6) 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,
反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A. 1:4 B.1:5 C. 2:3 D.2:5
答案:A
解析:设2molZn参与反应,因Zn无剩余,则最终生成了2molZn(NO3)2,显然含有4molNO3- ,这部分是没有参与氧化还原反应的HNO3,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=1mol,即有1molHNO3被还原。
5、价态律:元素处于最高价态时,只有氧化性而无还原性。例如:MnO4-、Fe3+等。元素处于最低价态时,只有还原性而无氧化性。例如:S2-、I-等。元素处于中间价态时,即能表现氧化性又能表现还原性。例如:H2O2、Fe2+等。
典型例题:
4、只靠拢不交叉规律:同种元素不同价态的原子间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而绝不会出现高价态变低,低价态变高的交叉现象。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com