
5.凡链节中主碳链为8个碳原子,含有一个碳碳双键结构时,其单体可为一种二烯烃,两种单烯烃。含有二个碳碳双键时,其单体可为二烯烃等。
例12 93年全国高考题33题(湖北省用):工程塑料ABS树脂(结构简式如下) 合成时用了三种单体,
式中─C6H5是苯基,这三种单体的结构简式分别是:CH2==CHCN,____,____。
答案:工程塑料ABS的单体为:
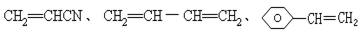
4.凡链节中主碳链为6个碳原子,含有碳碳双键结构,单体为两种(即单烯烃和二烯烃)

3.凡链节中主碳链为4个碳原子,含有碳碳双键结构,单体为一种,属二烯烃:

2.凡链节中主碳链为4个碳原子,无碳碳双键结构,其单体必为两种,从主链中间断开后,再分别将两个半键闭合即得单体。

两种(或两种以上)单体可以同时进行聚合,生成含有这两种(或两种以上)结构单位的大分子。烯类及其衍生物常起共聚反应生成高分子化合物。
1.凡链节的主碳链为两个碳原子,其单体必为一种。将链节的两个半键闭全即为单体。

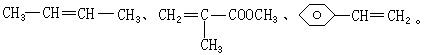
(1) 加成聚合(聚合)反应:不饱和的单体聚合成高分子的反应。




(2)缩合聚合(缩聚)反应:单体间相互反应而生成高分子,同时还生成小分子(如水、氨、氯化氢等)的反应(又叫逐步聚合反应)。

2、有机高分子单体的推断:
由于单体经过某些化学反应(如加聚、缩聚、开环等)生成高聚物,所以在高分子链中,单体转变为在化学组成上能够重复的最小单位,即链节。判断高聚物的单体,就是根据高分子链,结合单体间可能发生的反应机理,找出高分子链中的链节,然后将其完形便得其单体。结合中学课本,归纳出以下几条判断规津:
有机物燃烧的规律是中学有机化学基础中的常见题型,也是高考化学中的热点内容,许多学生对这些知识点往往容易产生混淆,现将其归纳总结如下:
有机物完全燃烧的通式: 烃: CxHy+(x+y/4)O2→xCO2+(y/2)H2O 烃的衍生物: CxHyOz+(x+ y/4 - z/2)O2→xCO2+(y/2)H2O
题型一:有机物的质量一定时: 1、烃类物质(CxHy)完全燃烧的耗氧量与成正比。 2、有机物完全燃烧时生成的CO2或H2O的物质的量一定,则有机物中含碳或氢的质量分数一定;若混合物总质量一定,不论按何种比例混合,完全燃烧后生成的CO2或H2O的物质的量保持不变,则混合物中各组分含碳或氢的质量分数相同。 3、燃烧时耗氧量相同,则两者的关系为:⑴同分异构体 或 ⑵最简式相同。 例1 下列各组有机物完全燃烧时耗氧量不相同的是 A、50g乙醇和50g甲醚 B、100g乙炔和100g苯 C、200g甲醛和200g乙酸 D、100g甲烷和100g乙烷 解析:A中的乙醇和甲醚互为同分异构体,B、C中两组物质的最简式相同,所以答案为D。 例2 下列各组混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定的是 A、甲烷、辛醛 B、乙炔、苯乙烯 C、甲醛、甲酸甲酯 D、苯、甲苯 解析:混合物总质量一定,不论按什么比例混合,完全燃烧后生成CO2的质量保持不变,要求混合物中各组分含碳的质量分数相同。B、C中的两组物质的最简式相同,碳的质量分数相同,A中碳的质量分数也相同,所以答案为D。 例3 分别取等质量的甲烷和A(某饱和一元醇)、B(某饱和一元醛)、C(某稠环芳香烃含氧衍生物),若它们完全燃烧,分别生成了物质的量相同的CO2 .则: ⑴A的分子式为_______;B的分子式为_______,C的分子式为_________(C的分子式有多种可能,只写分子量最小的一种)。 ⑵写出符合上述要求时,CH4和A、B、C的分子组成必须满足的条件是__________(以n表示碳原子数,m表示氧原子数,只写通式)。 解析:A、B、C中的碳的质量分数与甲烷中相同,⑴中A、B的分子式只要结合醇、醛的通式就可以求出答案。稠环芳香烃中最简单的是萘,通过增加氧原子维持含碳的质量分数不变可推出C .⑵的通式推导抓住每少16个氢原子增加一个氧原子即可。 答案:(1)A、C9H20O B、C8H16O C、C10H8O2
(2)CnH4n-16mOm 题型二:有机物的物质的量一定时: 1、比较判断耗氧量的方法步聚:①若属于烃类物质,根据分子中碳、氢原子个数越多,耗氧量越多直接比较;若碳、氢原子数都不同且一多一少,则可以按1个碳原子与4个氢原子的耗氧量相当转换成碳或氢原子个数相同后再进行比较即可。②若属于烃的含氧衍生物,先将分子中的氧原子结合氢或碳改写成H2O或CO2的形式,即将含氧衍生物改写为CxHy·(H2O)n或CxHy·(CO2)m或CxHy·(H2O)n·(CO2)m形式,再按①比较CxHy的耗氧量。 2、有机物完全燃烧时生成的CO2或H2O的物质的量一定,则有机物中碳原子或氢原子的个数一定;若混合物总物质的量一定,不论按何种比例混合,完全燃烧后生成的CO2或H2O的量保持不变,则混合物中各组分中碳或氢原子的个数相同。 例4 相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是 A、C3H4和C2H6 B、C3H6和C3H8O C、C3H6O2和C3H8O D、C3H8O和C4H6O2 解析:A中C3H4的耗氧量相当于C2H8,B、C、D中的C3H8O可改写为C3H6·(H2O),C中的C3H6O2可改为C3H2·(H2O)2,D中的C4H6O2可改为C3H6·(CO2),显然答案为B、D。 例5 1molCxHy(烃)完全燃烧需要5molO2,则X与Y之和可能是 A、X+Y=5 B、X+Y=7 C、X+Y=11 D、X+Y=9 解析:根据烃燃烧通式可知,1molCxHy的耗氧量为 ,讨论易知,当x=3,y=8时合理,答案为C。 例6 有机物A、B只可能烃或烃的含氧衍生物,等物质的量的A和B完全燃烧时,消耗氧气的量相等,则A和B的分子量相差不可能为(n为正整数) ( ) A、8n B、14n C、18n D、44n 解析: A中的一个碳原子被B中的四个氢原子代替,A和B的分子量相差8的倍数,即答案A. 如果A和B的分子组成相差若干个H2O或CO2 ,耗氧量也不变,即分别对应答案C和D。 题型三:一定量的有机物完全燃烧,生成的CO2和消耗的O2的物质的量之比一定时: 1、生成的CO2的物质的量小于消耗的O2的物质的量的情况 例7 某有机物的蒸气完全燃烧时,需要三倍于其体积的O2,产生二倍于其体积的CO2,则该有机物可能是(体积在同温同压下测定) A、C2H4 B、C2H5OH C、CH3CHO D、CH3COOH 解析:产生的CO2与耗氧量的体积比为2:3,设该有机物为1mol,则含2mol的C原子,完全燃烧时只能消耗2mol的氧气,剩余的1mol氧气必须由氢原子消耗,所以氢原子为4mol,即该有机物可以是A,从耗氧量相当的原则可知B也正确。答案为A、B。 2、生成的CO2的物质的量等于消耗的O2的物质的量的情况 符合通式Cn·(H2O)m 3、生成的CO2的物质的量小于消耗的O2的物质的量的情况 ⑴若CO2和O2体积比为4∶3 ,其通式为(C2O)n ·(H2O)m。 ⑵若CO2和O2体积比为2∶1 ,其通式为(CO)n ·(H2O)m。 题型四:有机物完全燃烧时生成的CO2和H2O的物质的量之比一定时: 有机物完全燃烧时,若生成的CO2和H2O的物质的量之比为a:b,则该有机物中碳、氢原子的个数比为a:2b,该有机物是否存在氧原子,有几个氧原子,还要结合燃烧时的耗氧量或该物质的摩尔质量等其他条件才能确定。 例8 某有机物在氧气中充分燃烧,生成的水蒸气和二氧化碳的物质的量之比为1:1,由此可以得出的结论是 A、该有机物分子中C:H:O原子个数比为1:2:1 B、分子中C:H原子个数比为1:2 C、有机物必定含O
D、无法判断有机物是否含O 答案:B、D 题型五:有机物完全燃烧前后气体体积的变化: 1、气态烃(CxHy)在100℃及其以上温度完全燃烧时气体体积变化规律与氢原子个数有关 ①若y=4,燃烧前后体积不变,△V=0 ②若y>4,燃烧前后体积增大,△V>0 ③若y<4,燃烧前后体积减少,△V<0 2、气态烃(CxHy)完全燃烧后恢复到常温常压时气体体积的变化直接用烃类物质燃烧的通式通过差量法确定即可。 例9 120℃时,1体积某烃和4体积O2混和,完全燃烧后恢复到原来的温度,压强体积不变,该烃分子式中所含的碳原子数不可能是 (A)1 (B)2 (C)3 (D)4 解析:要使反应前后压强体积不变,只要氢原子个数可以等于4并保证能使1体积该烃能在4体积氧气里完全燃烧即可。答案:D 例10 两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L.下列各组混合烃中不符合此条件的是 (A)CH4 C2H4 (B)CH4 C3H6 (C)C2H4 C3H4 (D)C2H2 C3H6 答案:B、D 3、液态有机物(大多数烃的衍生物及碳原子数大于4的烃)的燃烧,如果燃烧后水为液态,则燃烧前后气体体积的变化为:氢原子的耗氧量减去有机物本身提供的氧原子数的 。 例11 取3.40ɡ只含羟基、不含其他官能团的液态饱和多元醇,置于5.00L的氧气中,经点燃,醇完全燃烧.反应后气体体积减少0.560L ,将气体经CaO吸收,体积又减少2.8L(所有体积均在标况下测定)。则:3.4ɡ醇中C、H、O的物质的量分别为:C____; H______; O_______;该醇中C、H、O的原子个数之比为___________。 解析:设3.40ɡ醇中含H、O原子的物质的量分别为x和y 则: x+16y=3.40ɡ-2.80L/22.4L·mol-1×12ɡ·mol-1 …………方程① x/4 –y/2 =0.560L/22.4L·mol-1 …………方程② ⑴、⑵联解可得:x=0.300mol y=0.100mol 进而求得原子个数比。 答案:C. 0.125 mol、H. 0.300 mol、O.0.100 mol; 该醇中C、H、O的原子个数之比为 5∶12∶4
6.(1)Al,Cl2,CO2,Na2CO3或NaHCO3;
(2)MnO2 + 4HCl MnCl2 + Cl2↑+ 2H2O ;
MnCl2 + Cl2↑+ 2H2O ;
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓+ 3CO2↑+6NaCl
Al(OH)3 + NaOH = NaAlO2 + 2H2O
(3)钝化
5.(1)Na2O2
(2)NaOH + SO2 = NaHSO3
(3)SO2 + Br2 + 2H2O = H2SO4 + 2HBr
4.(1)稀氨水和酚酞 ;稀氨水中的NH3气逸出,所以溶液的颜色变浅
(2)溶有SO2的品红 ;SO2气体逸出,品红溶液恢复红色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com