
15、如何用实验方法证明两种金属的活泼性的大小(以铁、铜为例,至少设计两种方案)。
四 计算题
14、举例说明原电池原理在实验、生活、生产中的应用(至少三例)。
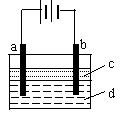
13、由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液
与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用如图所示实验
装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
⑴a电极材料为___________。其电极反应式为___________。
⑵电解液-d可以是__________,则白色沉淀在电极上生成;
也可以是_______,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
⑶液体c为苯,其作用是_____________________,在加入苯之前,对d溶液进行加热处理的目的是__________________。
⑷为了在短时间内看到白色沉淀,可以采取的措施是
A.改用稀硫酸做电解液 B.适当增大电源电压
C.适当缩小两电极间距离 D.适当降低电解液温度
⑸若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为___________________。
12、铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断
⑴蓄电池的负极是_________,其电极反应式为________。
⑵蓄电池的正极是_________,其电极反应式为________。
 ⑶蓄电池工作时,其中电解质溶液的PH_______(增大、减小、不变)
⑶蓄电池工作时,其中电解质溶液的PH_______(增大、减小、不变)
11、如图是可用于测量阿伏加德罗常数的装置示意图,
其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜
片与引出导线相连,引出端分别为X、Y。
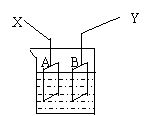 ⑴当以I=0.21A的电流电解60min后,测得铜片A
⑴当以I=0.21A的电流电解60min后,测得铜片A
的质量增加了0.25g,则图装置中的X端应与直流电
的_______极相连,它是电解池的__________ 极。
⑵电解后铜片B的质量____________。(答“增加”“减少”或“不变”)
⑶列式计算实验测得的阿伏加德罗常数NA。(已知电子电量e=1.60×10-19C)
10、下列叙述正确的是( )
①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率。②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀。③电镀时应把镀件置于电解槽的阴极。④冶炼铝时,把氧化铝加入液态冰晶石中成为熔融体后电解。⑤钢铁表面常易腐蚀生成Fe2O3·nH2O
A.①②③④⑤ B.①③④⑤ C.①③⑤ D.②④
9、将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )
A.1:2:3 B.3:2:1 C.6:3:1 D.6:3:2
8、将质量分数为0.052(5.2%)的NaOH溶液1L(密度为1.06g·cm-3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是( )
|
|
NaOH的质量分数 |
阳极析出物的质量/g |
阴极析出物的质量/g |
|
A |
0.062(6.2%) |
19 |
152 |
|
B |
0.062(6.2%) |
152 |
19 |
|
C |
0.042(4.2%) |
1.2 |
9.4 |
|
D |
0.042(4.2%) |
9.4 |
1.2 |
7、下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是正极 B.用电解法精炼粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
6、用惰性电极电解M(NO3)x的水溶液,当阴极上增重ag时,在阳极上同时产生bL氧气(标准状况),从而可知M的相对原子质量是( )
A.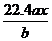 B.
B.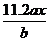 C.
C.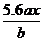 D.
D.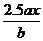
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com