
2.下列各句中加点的成语使用恰当的一句是 ( )
A.为了写这篇文章,刘教授查找文献,寻章摘句,做了上千张卡片,费了很多时间和精力。
B.我把你前些日子送我的一幅字画挂在了书房,一下子就令那小屋蓬荜生辉,真是太感谢你了。
C.我的态度很鲜明,对任何邪教的言论不赞一词,对他们的行为深恶痛绝。
D.林林自卫失手致人死命,的确有罪,但量刑过重,仔细权衡下来其实罪不容诛。
1.下列各组词语没有错误字的一组是( )
A.蔓延 渔船 忘年交 鸿篇巨制
B.脉搏 通牒 煞风景 应接不遐
C.松弛 倾泻 倒记时 拾人牙慧
D.服帖 坐阵 爆冷门 优柔寡断
(三)酸、碱加水稀释后溶液的PH值
6、常温下,将PH=1的H2SO4溶液和PH=13的NaOH溶液分别稀释1000倍,求所得溶液的PH值。
思考:若在常温下,将PH=1的CH3COOH溶液和PH=13的NH3·H2O溶液分别稀释1000倍,则所得溶液的PH值在什么范围之内。
[反馈练习]
1.求下列溶液混合后的pH:
(1) 把pH=2和pH=4的两种强酸溶液等体积混合,其pH= 。
(2) 把pH=12和pH=14的两种强碱溶液等体积混合,其pH= 。
(3) 把pH=5的H2SO4溶液和pH=8的NaOH溶液等体积混合,其pH= 。
2.室温时,将PH=5的H2SO4溶液稀释10倍,则C(H+):C(SO42-)= ;
若再将稀释后的溶液再稀释100倍,则C(H+):C(SO42-)= 。
|
3.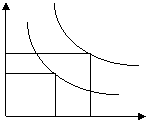 设水的电离平衡线如右图所示。
设水的电离平衡线如右图所示。
(1)若以A点表示25°时水在电离平衡时的粒子浓度,当温
度升高到100°时,水的电离平衡状态到B点,则此时水的离子 10-6
积从_________增加到____________; 10-7
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持
|
酸的体积比为__________ 。


(一)单一溶液的PH计算
1、分别求0.05mol/LH2SO4溶液和0.05mol/L Ba(OH)2溶液的PH值。
2、已知常温下浓度为0.01mol/L的CH3COOH溶液的电离度为1%,求该溶液的PH值。
 (二)酸碱混合溶液的PH计算
(二)酸碱混合溶液的PH计算
3、将PH=2的H2SO4溶液与PH=4的H2SO4溶液等体积混合后,求溶液的PH值。
4、 将PH=8的NaOH溶液与PH=10的NaOH溶液等体积混合后,求溶液的PH值。
将PH=8的NaOH溶液与PH=10的NaOH溶液等体积混合后,求溶液的PH值。
5、常温下PH=4的HCl和PH=10的NaOH分别按体积比为1:1,11:9,9:11混合,分别求三种情况下溶液的PH值。
⒈定义:PH= ,广泛pH的范围为0-14。
注意:当溶液中[H+]或[OH-]大于1mol/L时,不用pH表示溶液的酸碱性。
⒉意义:
溶液的酸碱性 常温(25℃)
中性溶液:C(H+) C(OH-) C(H+) 1×10- 7mol/L pH 7
酸性溶液:C(H+) C(OH-) C(H+) 1×10-7mol/L pH 7
碱性溶液:C(H+) C(OH-) C(H+) 1×10-7mol/L pH 7
⒊溶液PH的测定方法
(1)酸碱指示剂法
说明:常用的酸碱指示剂有石蕊、甲基橙、酚酞试液。
常用酸碱指示剂的pH变色范围
|
指示剂 |
变色范围的pH |
||
|
石蕊 |
<5红色 |
5-8紫色 |
>8蓝色 |
|
甲基橙 |
<3.1红色 |
3.1-4.4橙色 |
>4.4黄色 |
|
酚酞 |
<8无色 |
8-10浅红色 |
>10红色 |
(2)pH试纸法
使用方法:
(3)PH计法
3.100℃时,KW=1×10-12,对纯水的叙述正确的是 ( )
A、pH=6显弱酸性 B、C(H+)=10-6mol/L,溶液为中性
C、KW是常温时的10-2倍 D、温度不变冲稀10倍pH=7
第二节 水的电离和溶液的酸碱性(第2课时)
 [课标要求]⒈了解溶液的酸碱性和pH的关系
[课标要求]⒈了解溶液的酸碱性和pH的关系
⒉掌握有关溶液pH值的简单计算
⒊了解常用的酸碱指示剂
[学习重点]⒈水的离子积,H+浓度、OH-浓度、pH值与溶液酸碱性的关系
⒉有关溶液pH值的简单计算
 [学习难点]pH值的计算
[学习难点]pH值的计算
[学习过程]
[情景创设]
2.向纯水中加入少量的KHSO4固体(温度不变),则溶液的 ( )
A、pH值升高 B、C(H+)和C(OH-)的乘积增大 C、酸性增强 D、OH-离子浓度减小
1.pH=2的强酸溶液,加水稀释,若溶液体积扩大10倍,则C(H+)或C(OH-)的变化( )
A、C(H+)和C(OH-)都减少 B、C(H+)增大 C、C(OH-)增大 D、C(H+)减小
3.溶液的pH: pH=-lgc(H+)
轻松做答:
(1)C(H+)=1×10-6mol/L pH=______;C(H+)=1×10-3mol/L pH=__ ___
C(H+)=1×10-mmol/L pH=______ ;C(OH-)=1×10-6mol/L pH=______
C(OH-)=1×10-10mol/L pH=______ ;C(OH-)=1×10- nmol/L pH=___ ___
(2)pH=2 C(H+)=________ ;pH=8 c(H+)=________
(3)c(H+)=1mol/L pH= ______ ;c(H+)=10mol/L pH= ______
归纳:pH与溶液酸碱性的关系(25℃时)
|
pH |
溶液的酸碱性 |
|
pH<7 |
溶液呈 性,pH越小,溶液的酸性 |
|
pH=7 |
溶液呈 性 |
|
pH>7 |
溶液呈 性,pH越大,溶液的碱性 |
[反馈练习]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com