
24.KMnO4紫红色消褪是因为被还原,而H2O2被氧化。
24.(1)弱酸 (2)还原 (3)PbS+4H2O2=PbSO4+4H2O
讲析:21.根据氧化能力,Cl2将I2继续氧化成IO3-。
23.2Cu+O2+2H2SO4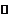 2CuSO4+2H2O,
2CuSO4+2H2O,
Cu+2H2SO4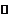 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
前,既节约硫酸,又无大气污染。
(2)①2I-+Cl2=I2+2Cl- ②I2+5Cl2+6H2O=2IO3-+10Cl-+12H+
22.无色,橙色;分液漏斗、烧杯。
19.要考虑Cl2与SO2发生反应:
Cl2+SO2+2H2O=H2SO4+2HCl
18.极端假设:若500mL全部都是Cl2需H2500mL;若500mL全部是O2需H21000mL,则所需H2的体积应在500mL~1000mL之间。
17.亚硫酸与H2S发生反应:H2SO3+2H2S=3S↓+3H2O,随着反应的进行,溶液的pH变大,当某种反应物过量后,溶液的pH又变小,但应注意饱和亚硫酸的pH比饱和氢硫酸pH小。
15.n(Fe)=11.2L/22.4L•mol-1=0.5mol,当n(Fe)=n(s)时,总质量等于44g。
13.Fe溶于盐酸生成Fe2+,加Cl2水能被氧化成Fe3+;加入Zn(NO3)2因引入NO3-而有HNO3,也能将Fe2+氧化。
11.CS2能溶解S单质;S能与热的浓碱反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com