
6.下列实验目的可以达到的是
A.电解熔融氯化镁制取金属镁 B.醋酸钠结晶水合物与碱石灰共热制取甲烷
C.浓硫酸与溴化钠共热制取溴化氢 D.饱和碳酸钠溶液除去二氧化碳中的氯化氢
5.NA为阿伏伽德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L苯含有C-H数目为6NA
B.在2NaOH+2F2=OF2+2NaF+H2O反应中,每生成1molOF2,反应转移电子数为2NA
C. 1.7gH2O2中含有的电子数为0.9 NA
D.常温下,1L1mol/LFeCl3溶液中,含Cl-数目小于3NA
4.能正确表示下列反应的离子方程式是
A.金属铝溶于稀硫酸中:Al + 2H+ = A13+ + H2↑
B.碳酸锌溶于稀硝酸中:CO2- 3 + 2H+ =H2O + CO2↑
C.醋酸钠水溶液中通入足量CO2:2CH3COO- + CO2 + H20 = 2CH3COOH + CO2- 3
D.少量Cl2通入KI溶液中:Cl2+ 2I- =2C1- + I2
3.下图所示的实验装置不能够达到实验目的的是

|




A.喷泉实验 B.实验室制乙烯 C.酯化反应 D.铜锌电池
2.下列化学用语不正确的是
 A.漂粉精的主要成分:CaCl2 B.乙烯的结构简式:CH2=CH2
A.漂粉精的主要成分:CaCl2 B.乙烯的结构简式:CH2=CH2
 C.Na+的结构示意图:
C.Na+的结构示意图: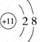
 D.原子核内有10个中子的氧原子:
D.原子核内有10个中子的氧原子: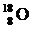
1.2010年9月25日世界运河名城博览会在扬州举行,本届运博会的论坛主题是:运河城市发展低碳经济的重大意义及其途径。下列做法不能体现低碳生活的是
A.减少食物加工过程 B.大量使用薪柴为燃料
C.提倡使用太阳能热水器 D.注意节约用电
25、(5分)标准状况下,用一定量的水吸收氨气后制得浓度为12. 0 mol·L-1、密度为0.915 g·cm-3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。 (本题中氨的式量以 17.0计,水的密度以1.00g·cm-3计
24.(8分)某待测溶液中可能含有Na+、SO42-、SO32-、CO32-、Cl-、NO3-、HCO3-等离子,进行了下述实验。(所加BaCl2、H2SO4、HNO3、Ca(OH)2均过量)
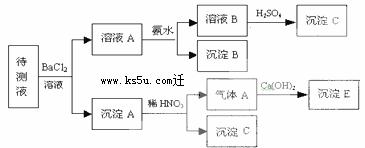
(1) 判断待测液中有无SO42-、SO32-,并说明理由:_____________________________;
(2) 写出沉淀B的化学式:____________;
(3) 沉淀C可能是什么物质:____________;
(4) 写出产生沉淀B的离子方程式:____________________________________。
23. (12分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
(12分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在。则A中含有的金属元素的名称为___________。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
① B的电子式为_________________。
② C与水剧烈反应,生成两种常见酸,反应的化学方程式为:
____________________________________________________________。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
① A中所含有的化学键是_______________、________________。
② 将4.48 L(标准状况下)X通入100 mL3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为__________________________________________________。
22.(5分)某同学用NaOH固体配制250mL 2mol/L的NaOH溶液,并进行有关实验。请回答下列问题:
(1)需要称取NaOH固体__________g。
(2)配制该NaOH溶液时使用的仪器除托盘天平(砝码、镊子)、药匙、量筒、250mL容量瓶、胶头滴管外,还必须用到的仪器有 、 等。
(3)取所配制的NaOH溶液100mL,与一定质量的铝充分反应,铝全部溶解后,生成的气体在标准状况下的体积为3.36L,则参加反应的铝的质量为 g,设反应后溶液的体积仍为100mL,则反应后溶液中OH-的物质的量浓度为(不考虑水解) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com