
16.(14分)聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
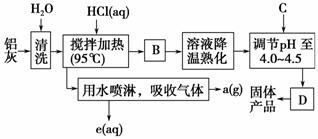
(1)搅拌加热操作过程中发生反应的离子方程式:________________、______________。
(2)生产过程中操作B和D的名称均为 (B和D为简单操作)。
(3)反应中副产 品a是________(用化学式表示)。
品a是________(用化学式表示)。
(4)生产过程中可循环使用的物质是________(用化学式表示)。
(5)调节pH至4.0-4.5的目的是____________________________________。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用 。源:]
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
15.(14分)重铬酸铵 [(NH4)2Cr2O7]是一种橘黄色的晶体,常用于石油精炼、制革、印染、烟火、陶瓷等行业,是一种重要的化工原料。
(1)已知在酸性条件下,重铬酸盐有强氧化性。向冷的酸性重铬酸铵溶液中通入H2S,可得到Cr3+和S,写出反应的离子方程式: 。
(2)在150℃时,重铬酸铵迅速呈膨胀式分解,发生如下主要反应:
(NH4)2Cr2O7=Cr2O3+4H2O+N2↑,
 但同时也发生副反应。某同学设计了如下装置,探究副反应的生成物:
但同时也发生副反应。某同学设计了如下装置,探究副反应的生成物:
①装置中棉花的作用是 ;加热前,该同学先通过导管K向试管中通一会N2,其目的是 ;
②连接a、b,关闭导管K,加热使反应发生。若装置A中所盛溶液为酚酞溶液,且溶液变红,说明有 产生,仪器X的作用是 ;若装置A中所盛溶液为新制的硫酸亚铁溶液,且出现棕红色的沉淀,说明副反应中有 产生,写出产生该沉淀的离子方程式
14.在氯化铝和氯化镁的混合溶液中,向其中滴加 a mLC1mol·L-1 NaOH之后,改成滴加C2mol·L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示。则所加入NaOH溶液的体积为
A .9mL B. 7.5mL C. 7ml D.6mL
第Ⅱ卷(非选择题 78分)
13.图中C%表示某反应物在体系中的百分含量,v表示反应速率,p表示压强,t表示反应时间,图(A)为温度一定时压强与反应速率的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是


A.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H= -808.7 kJ/mol
4NO(g)+6H2O(g) △H= -808.7 kJ/mol
B.N2O3(g) NO2(g)+NO(g) △H= +41.8 kJ/mol
NO2(g)+NO(g) △H= +41.8 kJ/mol
 C.3NO2(g)+H2O(l)
C.3NO2(g)+H2O(l) 2HNO3(l)+NO(g) △H= -261.3 kJ/mol
2HNO3(l)+NO(g) △H= -261.3 kJ/mol
D.CO2(g)+C(s) 2CO(g)
△H= +171.4kJ/mol
2CO(g)
△H= +171.4kJ/mol
12.有Fe2+ ﹑NO3- ﹑Fe3+、NH4+ ﹑H2O 和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是
A.氧化剂与还原剂的物质的量之比为8∶1 B.还原产物为 NH4+
C.若有1mol NO3- 参加还原反应,则转移3mol e-
D.若把该反应设计为原电池,则负极反应为 Fe2+ - e-= Fe3+
11. 右图是一种航天器能量储存系统原理示意图。下列说法正确的是
右图是一种航天器能量储存系统原理示意图。下列说法正确的是
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:

C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
10.下列溶液中有关物质的量浓度关系和计算不正确的是
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3)
<c(CH3COONa)
B.已知25°C时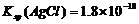 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 mol·L-1
mol·L-1
C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有
9.氯气溶于水达到平衡后,下列叙述正确的是
A.再通入少量氯气,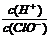 减小 B.通入少量SO2,溶液的漂白性增强
减小 B.通入少量SO2,溶液的漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.该反应的离子方程式为Cl2+H2O H++Cl-+HClO
H++Cl-+HClO
8.镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等领域。下列关于镁铝合金的性质的叙述中,正确的是
A.此合金的熔点比镁和铝的熔点都高 B.此合金能全部溶解于稀盐酸中
C.此合金能全部溶解于氢氧化钠溶液中 D.此合金的硬度比镁和铝的硬度都大
7.下列判断正确的是
A.测定硫酸铜晶体中结晶水含量时,灼烧至固体发黑,测定值小于理论值
B.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
C.0.1mol/L的碳酸钠溶液的pH大于0.1mol/L的醋酸钠溶液的pH
D.1L1mol/L的碳酸钠溶液吸收S02的量大于1L1mol/L硫化钠溶液吸收S02的量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com