
1、 步骤:洗-烧-蘸-烧-洗-烧
3、命题角度:配制步骤及对应离子方程式的书写
2、涉及的化学方程式:Fe3++3H2O 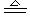 Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
强调之一是用等号,强调之二是标明胶体而不是沉淀,强调之三是加热。
1、步骤:向沸水中加入FeCl3的饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
操作要点:四步曲:①先煮沸,②加入饱和的FeCl3溶液,③再煮沸至红褐色,④停止加热
3、 注意事项:
(1) 容量瓶:只有一个刻度线且标有使用温度和量程规格,只能配制瓶上规定容积的溶液。(另外使用温度和量程规格还有滴定管、量筒)
(2) 常见的容量瓶:50 mL、100mL、250mL、500mL、1000mL。若配制480mL与240mL溶液,应分别用500mL容量瓶和250mL容量瓶。写所用仪器时,容量瓶必须注明规格,托盘天平不能写成托盘天秤!
(3) 容量瓶使用之前必须查漏。方法:向容量瓶内加少量水,塞好瓶塞,用食指顶住瓶塞,用另一只手的五指托住瓶底,把瓶倒立过来,如不漏水,正立,把瓶塞旋转1800后塞紧,再倒立若不漏水,方可使用。(分液漏斗与滴定管使用前也要查漏)
(4)命题角度:一计算所需的固体和液体的量,二是仪器的缺失与选择,三是实验误差分析。
2、 所用仪器:(由步骤写仪器)
托盘天平、药匙、烧杯、玻璃棒、(量筒)、100mL容量瓶、胶头滴管
以配制100mL1.00mol/L的NaOH溶液为例:
1、 步骤:(1)计算 (2)称量:4.0g(保留一位小数)(3)溶解(4)转移:待烧杯中溶液冷却至室温后转移(5)洗涤 (6)定容:将蒸馏水注入容量瓶,当液面离刻度线1-2cm时,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线在同一水平线上(7)摇匀:盖好瓶塞,上下颠倒、摇匀 (8)装瓶贴标签 :标签上注明药品的名称、浓度。
步骤:(1)计算 (2)称量:4.0g(保留一位小数)(3)溶解(4)转移:待烧杯中溶液冷却至室温后转移(5)洗涤 (6)定容:将蒸馏水注入容量瓶,当液面离刻度线1-2cm时,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线在同一水平线上(7)摇匀:盖好瓶塞,上下颠倒、摇匀 (8)装瓶贴标签 :标签上注明药品的名称、浓度。
21.(12分)Zn和Al都具有两性,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
 (1)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式
。
(1)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式
。
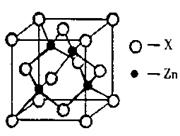
(2)锌与某种元素X通过共价键结合,形成空间网状结构的晶体,右图表示该化合物晶胞,该化合物的化学式为 。
(3) AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体Al2Cl6形式存在,请问两分子AlCl3之间以 方式二聚。
(选择填写:“离子键”“共价键”“金属键”“氢键”)
(4)与锌同周期,最外层有3个未成对电子数的元素名称是 ,该元素对应的最低价氢化物分子的中心原子采取了 杂化方式,分子的空间构型是 。
20.(4分)水垢中含有的CaSO4,先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3 ,而后用酸去除。从CaSO4到CaCO3的沉淀转化中,并存在着两个沉淀溶解平衡。
(1)写出前一个沉淀溶解平衡反应方程式:
(2)已知Ksp(CaCO3) =2.8×10-9 mol2/L2 ,将136gCaSO4固体加入1L Na2CO3溶液中,待沉淀转化后,溶液中c(CO32-) = 0.001mol/L。计算Ksp(CaSO4) = mol2/L2
(忽略溶液体积变化)
17.(10分)锂被誉为“高能金属”。工业上用硫酸与β-锂辉矿(LiAlSi2O6和少量钙镁杂质)在250-300℃反应,生成Li2SO4以及硅铝化合物、MgSO4等,其工业生产流程如下:
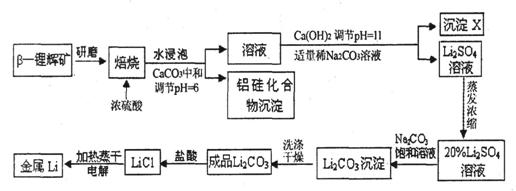
(1)用氧化物形式表示LiAlSi2O6的组成:___________________。
(2)沉淀X的主要成分是(写化学式)________________________。
(3)流程中两次使用了Na2CO3溶液,试说明前后浓度不同的原因:____________。
(4)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体。试写出氢化锂遇水反应的化学方程式:_______________。
(5)将盐酸与Li2CO3完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是_____________________。
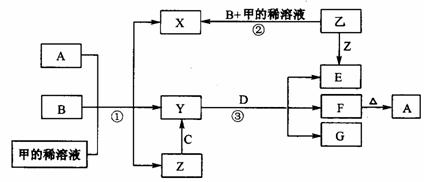 18.(14分)下图表示有关物质(均是中学化学常见的物质)之间的转化关系(其中部分参加反应的水和生成的水未列出),其中B、C为金属单质,E为非金属单质,其余均为化合物,Y、Z的组成元素相同,D为淡黄色的固体。回答系列问题:
18.(14分)下图表示有关物质(均是中学化学常见的物质)之间的转化关系(其中部分参加反应的水和生成的水未列出),其中B、C为金属单质,E为非金属单质,其余均为化合物,Y、Z的组成元素相同,D为淡黄色的固体。回答系列问题:
(1)B与甲稀溶液不反应,但与甲的浓溶液在加热条件下能反应。则甲为 ,C为 (填写化学式)。A与B物质的量应满足的关系为 。
(2)写出反应③的化学方程式 。
(3)反应②观察到溶液由无色变成蓝色,并且有无色气泡产生。请写出反应②发生的化学反应方程式 , ;并分析产生气体的原因 。
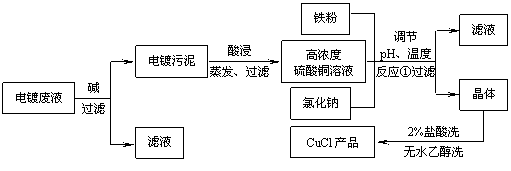
19(10分)、氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂。以下是从含Cu2+、Fe3+的电镀废液中制备氯化亚铜的工艺流程图。

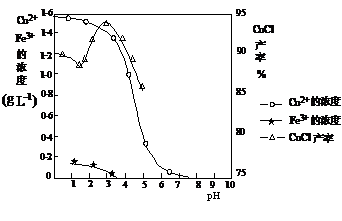
 下图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系。
下图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系。
 试填空。
试填空。
 (1)当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为:
(1)当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为:
。
 (2)由反应①制备CuCl时的最佳pH在 左右。
(2)由反应①制备CuCl时的最佳pH在 左右。
 (3)已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有 的特性。
(3)已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有 的特性。
 (4)反应①中1mol铁粉完全反应转移2mol电子,该离子反应的方程式为: 。
(4)反应①中1mol铁粉完全反应转移2mol电子,该离子反应的方程式为: 。
如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,则化学方程式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com