
7. 在X轴上有两个点电荷,一个带正电Q1,一个带负电Q2。且Q1=2Q2。用E1和E2分别表示两个电荷所产生的场强的大小,则在X轴上(B)
A.E1=E2之点只有一处;该点合场强为0
 B.E1=E2之点共有两处;一处合场强为0,另一处合场强为2E2
B.E1=E2之点共有两处;一处合场强为0,另一处合场强为2E2
C.E1=E2之点共有三处;其中两处合场强为0,另一处合场强为2E2
D.E1=E2之点共有三处;其中一处合场强为0,另两处合场强为2E2
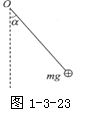
6. 如图9-2-4所示,一电子沿等量异种电荷的中垂线由 A→O→B匀速运动,电子重力不计,则电子除受电场力外,所受的另一个力的大小和方向变化情况是( B )
 A.先变大后变小,方向水平向左
A.先变大后变小,方向水平向左
B.先变大后变小,方向水平向右
C.先变小后变大,方向水平向左
D.先变小后变大,方向水平向右
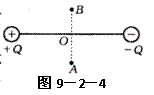
5. (2007广东理科基础12)如图所示,实线是一簇未标明方向的由点电荷Q产生的电场线,若带电粒子q(|Q|>>|q|)由a运动到b,电场力做正功。已知在a、b两点粒子所受电场力分别为Fa、Fb,则下列判断正确的是( A )
(2007广东理科基础12)如图所示,实线是一簇未标明方向的由点电荷Q产生的电场线,若带电粒子q(|Q|>>|q|)由a运动到b,电场力做正功。已知在a、b两点粒子所受电场力分别为Fa、Fb,则下列判断正确的是( A )
A.若Q为正电荷,则q带正电,Fa>Fb
B.若Q为正电荷,则q带正电,Fa<Fb
C.若Q为负电荷,则q带正电,Fa>Fb
D.若Q为负电荷,则q带正电,Fa<F
4. 在同一直线上依次有A、B、C三点,且BC=3AB,在A点固定一个带正电的小球,在B点引入电量为2.0×10-8c的试探电荷,其所受电场力为2.0×10-6N。将该试探电荷移去后,B点的场强为___________,C点的场强为______________。如果要使B点的场强为零,可能在C点放一个电量是A点处带电小球的电量的_________倍的________电荷.
答案:100N/q,6.25N/q,9,正
综合跃升
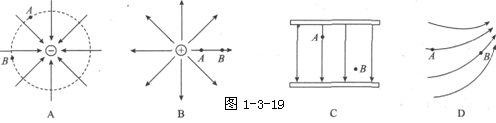
3. 图1-3-19所示的各电场中,A、B两点场强相同的是( C )
2. 在电场中某点放入电荷量为q的正电荷时,测得该点的场强为E,若在同一点放入电荷量q′=-2q的负电荷时,测得场强为E′,则有( D)
A.E′=E,方向与E相反 B.E′=2E,方向与E相同
C.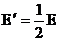 ,方向与E相同 D.E′=E,方向与E相同
,方向与E相同 D.E′=E,方向与E相同
 案例精析:
案例精析:
[例1]在电场中某点放一检验电荷,其电量为q,检验电荷受到的电场力为F,则该点电场强度为E=F/q,那么下列说法正确的是( )
A,若移去检验电荷q,该点的电场强度就变为零
B.若在该点放一个电量为2q的检验电荷,该点的电场强度就变为E/2
C.若在该点放一个电量为-2q的检验电荷,则该点场强的大小仍为E,但电场强度的方向变为原来相反的方向
D.若在该点放一个电量为-q/2的检验电荷,则该点场强的大小仍为E,电场强度的方向也仍为原来的场强方向
解析:电场中某点的电场强度是由场源电荷决定,与检验电荷的有无、正负、电量的多少无关,故正确 答案为D.
答案:D
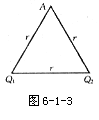
[例2]如图6-1-3所示,在真空中有两个点电荷Q1=+3.0x10-8C和Q2=-3.0x10-8C,它们相距0.1m,求电场中A点场强.A点与两个点电荷的距离r相等, r=0.1m.
解析:真空中点电荷Q1和Q2的电场在A点的场强分别为E1和E2,它们大小相等,方向如图6-1-6,合场强E,场强E1,场强E2向上平移后的矢量,三者构成一正三角形,故E与Q1Q2平行,且E=El=E2=kQ/r2
=9.0x109x3.0x10-8/(0.1)2N/C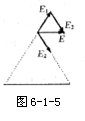
=2.7x104N/C
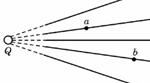
 [例3]图9-2-6中实线是一簇未标明方向的由点电荷 产生的电场线,虚线是某一带电粒子通过该电场区域时的运动轨迹,a、b是诡计上的两点。若带电粒子在运动中只受电场力作用,根据此图可作出正确判断的时( )
[例3]图9-2-6中实线是一簇未标明方向的由点电荷 产生的电场线,虚线是某一带电粒子通过该电场区域时的运动轨迹,a、b是诡计上的两点。若带电粒子在运动中只受电场力作用,根据此图可作出正确判断的时( )
A.带电粒子所带电荷的符号
B.带电粒子在a、b两点的受力方向
C.带电粒子在a、b两点的加速度何处较大
D.带电粒子在a、b两点的动能何处较大
[解析]粒子的加速度大小看其所受电场力的大小,而电场力的大小由电场线的疏密决定。从电场线分布情况可设想电场是由轨迹左侧的“点电荷”产生的,从轨迹的偏向可得“点电荷”给带电离子吸引力,即a、b两点受力方向如图所示;若粒子从a向b运动从图中可得F与v的夹角大于90°角,电场力做负功、粒子动能减少,综上所述:BCD正确。
答案:BCD
三维达标:
基础练习
1. 下列关于点电荷的场强公式 的几种不同的理解,不正确的是(BCD )
的几种不同的理解,不正确的是(BCD )
A.在点电荷Q的电场中,某点的场强大小与Q成正比,与r2成反比
B.当r→0时,E→∞;当r→∞时,E→0
C.点电荷Q产生的电场中,各点的场强方向一定是背向点电荷Q
D.以点电荷Q为中心,r为半径的球面上各处的场强相等
课堂探究:
2.盖斯定律的应用
盖斯定律在科学研究中具有重要意义。因为有些反应进行的很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。此时如果应用盖斯定律,就可以间接的把它们的反应热计算出来。
[例4] (08宁夏卷)已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.-44.2kJ·mol-1 B.+44.2kJ·mlo-1
C.-330kJ·mol-1 D.+330kJ·mlo-1
[解析] 由题意可知:C2H4(g)+3O2(g) 2CO2(g)+2H2O(l);△H=-1411.0kJ·mol-1,
2CO2(g)+2H2O(l);△H=-1411.0kJ·mol-1,
C2H5OH(1)+3O2(g) 2CO2(g)+3H2O(l);△H=-1366.8kJ·mol-1,将上述两个方程式相减得:C2H4(g)+H2O(l)
2CO2(g)+3H2O(l);△H=-1366.8kJ·mol-1,将上述两个方程式相减得:C2H4(g)+H2O(l) C2H5OH(l);△H=-44.2kJ·mol-1。
C2H5OH(l);△H=-44.2kJ·mol-1。
[答案] A
[方法技巧] 用盖斯定律解题首先要知道有关的反应式和相应的反应热,然后将反应合并成所求的反应式,其相应的反应热要同样合并。
1.盖斯定律的涵义:
化学反应的反应热只与反应的 (各反应物)和 (各生成物)有关,而与反应的 无关。即如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com