
2、必须控制170℃才能发生的反应,必是制取乙烯的反应;
1、需催化剂的无机反应:
(1)氯酸钾的分解:2KClO3 2KCl+3O2;(MnO2做催化剂)
2KCl+3O2;(MnO2做催化剂)
(2)过氧化氢的分解:2H2O2 2H2O+O2↑;(MnO2做催化剂)
2H2O+O2↑;(MnO2做催化剂)
(3)合成氨反应:N2+3H2 2NH3;(可逆,高温高压催化剂)
2NH3;(可逆,高温高压催化剂)
(4)氨的催化氧化:4NH3+5O2  4NO+6H2O;(高温催化剂)
4NO+6H2O;(高温催化剂)
(5)二氧化硫的催化氧化:2SO2+O2 2SO3;(可逆,高温催化剂)
2SO3;(可逆,高温催化剂)
(6)水煤汽生产的第二步反应:CO+H2O CO2+H2;(催化剂)
CO2+H2;(催化剂)
4、三角转换:
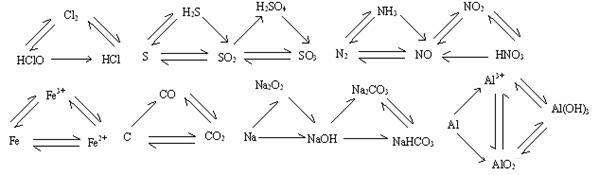 四、重要的反应条件:
四、重要的反应条件:
3、特征转换:A B
B C
C D(酸或碱)
D(酸或碱)
①NH3 NO
NO NO2
NO2 HNO3
②H2S
HNO3
②H2S SO2
SO2 SO3
SO3 H2SO4
H2SO4
③C CO
CO CO2
CO2 H2CO3
④Na
H2CO3
④Na Na2O
Na2O Na2O2
Na2O2 NaOH
NaOH
2、置换反应的类型
①金属置换非金属的反应:
2Na + 2H2O
= 2NaOH + H2↑
Mg + 2H2O Mg(OH)2
+ H2↑
Mg(OH)2
+ H2↑
3Fe + 4H2O(气) Fe3O4
+ 4H2↑
2Mg+CO2
Fe3O4
+ 4H2↑
2Mg+CO2 2MgO+C,
2MgO+C,
②金属置金属:2Al+Fe2O3 Al2O3+2Fe
Fe+Cu2+=Fe2++Cu
Al2O3+2Fe
Fe+Cu2+=Fe2++Cu
③非金属置金属:C+2CuO CO2+2Cu
H2+CuO
CO2+2Cu
H2+CuO Cu+H2O
Cu+H2O
④非金属置非金属:C + H2O CO + H2
2F2 + 2H2O = 4HF + O2
CO + H2
2F2 + 2H2O = 4HF + O2
Cl2+2Br-=2Cl-+Br2
1、与水反应既有沉淀生成又有气体生成的有关方程式:
Mg3N2 + 6H2O = 3Mg(OH)2↓ + 2NH3↑ Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
CaC2
+ 2H2O Ca(OH)2↓ + C2H2↑
Ca(OH)2↓ + C2H2↑
3、归纳和熟记1-18号元素的一些“专用语言”。
(1) H:原子半径最小;外层电子数=周期数;电子总数=电子层数;第IA族中能形成共价化合物的元素;在化合物中其数量的改变,对化合物相对分子质量变化影响不大;原子序数最小;有一种氢原子没有中子;是形成酸、碱的必须元素;单质密度最小;单质可由金属与水或酸反应得到;单质是水电解产物之一;与氧可生成两种物质H2O、H2O2;
(2)He:最外层属于饱和结构,但不是8电子;电子总数是电子层数的2倍。
(3)Li:最外层电子数是次外层电子数的一半;单质在空气中燃烧,不能形成过氧化物;密度最小的金属;保存于石蜡中。
(4)Be:最外层电子数=次外层电子数;最外层电子数=电子层;氧化物为BeO;价态为+2价。
(5)BF3属非极性分子;跟大多数金属形成金属硼化物。
(6)C:尿素仿N质量分数为46%;除稀有气体外,是既能得电子,又难失电子,难以形成离子;可以和浓硫酸和浓硝酸在加热条件下反应。
(7)N:单质空气中含量中最多;N2具有一定的惰性,通常情况下难与其它物质反应;华化肥三元素之一;氢化物NH3;氧化物形式最多(六种);含氧酸有HNO3和HNO2;气态氢化物水溶液碱一呈碱性;
(8)O:有H2O2 H2O Na2O2 Na2O等特殊氧化物。非常活泼,与除稀有气体以外的所有元素形成氧化物。
(9) F:前18号元素中除氢外原子半径最小;无正价;不能被任何物质氧化;能与水反应置换中水中的氧;没有含氧酸;HF水溶液是弱酸,并且形成氢键。
(10)Ne:化学性质不活泼。用于装饰灯(霓红灯广告牌)。
(11)Na:最外层电子数是最内层的一半,可以形成一些特殊的氧化物,Na2O2可以和水或二氧化碳反应。
(12)Mg:最外层电子数=最内层电子数;次外层电子数是最外层电子数的4倍;Mg可以和N2反应,生成的Mg3N2和水反应生成Mg(OH)2和氨气。
(13)Al:最外层电子数=电子层数;注意Al Al2O3 Al(OH)3 的两性;地壳中含量最多的金属元素。
(14)Si:最外层电子数是次外层数的一半;地壳含量中排第二位;SiO2是硅酸盐水泥、玻璃的主要成分;SiO2是原子晶体的化合物。
(15)P:PH3可自燃(鬼火);有同素异形体白磷和红磷;磷酸为三元中强酸,磷酸可形成三种形式的盐;
(16)S:可形成SO2 SO3 两种氧化物,FeS2是黄色物质,其中硫呈-1价。
(17) Cl:单质为黄绿色;电解食盐水制氯气;HClO具有漂白性。
(18) Ar:
3、物质的数据特征:
(1)组成的数据关系:如分析元素X和Y元素按1:2组成化合物时,除了要考虑无机物外,还在考虑有机物中的烯烃,按1:3形成化合物还要考虑乙烷。形成1:1和按1:2(或2:1)主要有H2O2和H2O,Na2O和Na2O2,FeS和FeS2,CuS和CuS2。
(2)相对分子质量相等的情况:①式量为28:N2、CO、C2H4②式量为30:NO、HCHO;32有S 、O2③式量为44:CO2、CH3CHO、C3H8、N2O④式量为78:Na2O2、Al(OH)3、Na2S、C6H6;84有NaHCO3 、MgCO3⑤式量为98:H2SO4、H3PO4⑥式量为100:CaCO3、KHCO3、Mg3N2⑦式量为120:Al2S3、MgSO4、NaHSO4 ⑧式量为160:Fe2O3、CuSO4
(3)10电子微粒:①分子:CH4、NH3、H2O、HF、Ne;
②离子:NH4+、H3O+、OH-、Mg2+、Al3+、F-、O2-;
③关系:OH-+H3O+=2H2O;NH4++OH- NH3↑+H2O; CH4+H2O
NH3↑+H2O; CH4+H2O 3H2+CO;
3H2+CO;
2F2+2H2O=4HF+2O2 Al3++3OH-=Al(OH)3↓
Al3++4OH-=AlO2-+H2O Mg2++2OH-=Mg(OH)2↓
18电子微粒:K+、Ca2+、P3-、S2-、HS-、Cl-、Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4
(4)数据差量关系:如连续氧化前后相差16;
(5)题设的特殊条件:
2、转化的特征关系
反应规律特征:
如与碱反应能产生气体的单质有Al、Si、双水解;S2O32-与酸的反应;Na2S与Na2SO3溶液反应;Ca2C与水反应;Na2O2与水或CO2反应;Al、Al2O3、Al(OH)3的特殊性质;弱酸弱碱盐、酸式盐的问题;电化学的问题;金属与酸、水的反应;非金属和碱的反应;连续与H+或OH-(或氨水)反应形式(如Al3+、AlO2-、CO32-、Ag+);连续氧化形式(Na、H2S、S、N2、NH3、C、CH4、醇、烃等)
1、物质的特征现象:
(1)物质的颜色:
有色气体单质:F2、Cl2、O3
其他有色单质:Br2(深红色液体,蒸气为红棕色)、I2(紫黑色固体)、S(淡黄色固体)、Cu(紫红色固体)、P(白磷是白色固体,红磷是暗红色固体)、Si(灰黑色晶体)、C(黑色粉未)
无色气体单质:N2、O2、H2
有色气体化合物:NO2(红棕色)
黄色固体:S、Na2O2、AgBr(浅黄)、AgI、Ag3PO4(黄色)
黑色固体:FeO、Fe3O4、MnO2、C、CuS、PbS、Ag2S、CuO
红色固体:Fe(OH)3(红褐色)、Fe2O3(红棕色)、Cu2O(红色)、Cu(红色)、红磷(暗红)
蓝色固体:五水合硫酸铜(胆矾或蓝矾)CuSO4·5H2O、Cu(OH)2;
绿色固体:七水合硫酸亚铁(绿矾)FeSO4·7H2O;
紫黑色固体:KMnO4、碘单质。
有色离子(溶液):Cu2+(蓝色或绿色)、Fe2+(浅绿)、Fe3+(棕黄)、MnO4-(紫红色)、Fe(SCN)2+(血红色)、(淀粉遇碘单质(I2)水溶液呈蓝色、Fe3+与苯酚呈紫色)
不溶于稀酸的白色沉淀:AgCl、BaSO4、Ag2SO4
不溶于稀酸的黄色沉淀:S、AgBr、AgI
焰色反应显黄色的是钠元素,显紫色的钾元素(透过蓝色钴玻璃观察)
(2)气体特征:
常见的气体有:
单质:H2、Cl2、O2
氢化物:NH3、H2S、HCl、
氧化物:CO2 、SO2、NO、NO2、CO
有机物:CH4、C2H2、C2H4、HCHO
如能使品红溶液褪色加热又恢复红色的气体是SO2;Cl2能使品红溶液褪色加热不能恢复红色;滴有石蕊试液的CO2(或SO2)溶液加热后红色变紫色;滴有甲基橙溶液的CO2(或SO2)溶液加热后红色变橙色或黄色等。
(3)物质的气味:
有臭鸡蛋气味的气体:H2S
有刺激性气味的气体:Cl2、SO2、NO2、HX、NH3
有刺激性气味的液体:浓盐酸、浓硝酸、浓氨水、氯水、溴水
(4)物质的毒性:
非金属单质有毒的:Cl2、Br2、I2、F2、S、P4
常见的有毒气体化合物:CO、NO、NO2、SO2、H2S、
能与血红蛋白结合的是CO和NO
(5)物质的溶解性特征:
CO2(1∶1)、SO2(1∶40)、HCl(1∶500)、NH3(1∶700)
极易溶于水的气体:HX、NH3
常见的难溶于水的气体:H2、N2、NO、CO、CH4、C2H4、C2H2
S和P4不溶于水,微溶于酒精,易溶于二硫化碳。
(6)熔沸点特征:H2O HF NH3形成氢键反常;原子晶体问题;离子化合物MgO、Al2O3熔点高可以做耐火材料。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com