
8.将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是 BC
A.硫酸 B.氯水 C.硝酸锌 D.氯化铜
7.下列排列顺序正确的是B
 ①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
A.①③ B.②④ C.①④ D.②③
6.无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体依次经过下图实验的处理,结果得到酸性溶液。则甲气体的组成为B
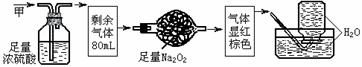
A.NH3、NO2、N2 B.NH3、NO、CO2
C.NH3、NO2、CO2 D.NO、CO2、N2
5.已知结构为正四面体型的离子E和直线型离子G反应,生成三角锥型分子L和V形分子M(组成E、G、L、M微粒的元素原子序数均小于10),反应过程用下图表示,则下列判断错误的是D
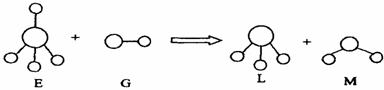
A.E、G、L、M都是10 e-微粒 B.L、M都是极性分子
C.L能使紫色石蕊试液变蓝色 D.E离子中,质子数一定大于中子数
4.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是BD
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是BD
A.加少量烧碱溶液 B.升高温度 C.加少量冰醋酸 D.加水
3.下列关于盐酸与醋酸两种稀溶液的说法正确的是B
A.相同浓度的两溶液中c(H+)相同
B.100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加人少量对应的钠盐,c(H+)均明显减小
2.下列化工产品生产中不涉及氧化还原反应的是 C
A.制硫酸 B.制漂白粉 C.制玻璃 D.制盐酸
1.以下反应的离子方程式正确的是C
A.实验室制CO2:CO32-+2H+=CO2↑+H2O
B.碳酸钠溶液呈碱性:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
C.二氧化硫气体通入氯水:SO2+Cl2+2H2O=SO42-+2Cl-+4H+
D.少量氯气通入碘化亚铁溶液中:Cl2+Fe2+=2Cl-+Fe2+
15.2mol·L-1解析:本题的反应式很多,有Fe2O3与H2SO4反应,生成的Fe2(SO4)3又与Fe反应,Fe与H2SO4反应;加入的NaOH与H2SO4、FeSO4反应等。但最终产物是Na2SO4和Fe(OH)2。根据守恒原理:
 (SO
(SO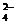 )=
)=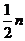 (Na+),
(Na+),
亦即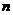 (H2SO4)=
(H2SO4)=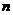 (NaOH)=
(NaOH)=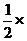 0.6mol=0.3mol。
0.6mol=0.3mol。
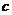 (H2SO4)=
(H2SO4)=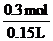 =2mol·L-l。
=2mol·L-l。
14.Zn、Cu
ZnCO3 ZnO+CO2↑
ZnO+CO2↑
C+2Cu2O 4Cu+CO2↑
4Cu+CO2↑
C+2ZnO 2Zn+CO2↑
2Zn+CO2↑
解析:我们知道,煅烧石灰石(CaCO3)能得到其氧化物,而木炭可以还原金属氧化物。把所学知识迁移过来,善于运用,不难解答。
点评:所学知识一定要灵活运用,要特别注意知识的迁移。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com