
1、已知集合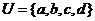 ,集合
,集合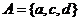 ,
,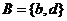 ,则集合
,则集合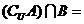
A、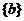 B、
B、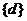 C、
C、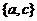 D、
D、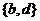
14.(广东09怀集一中高三月考化学试卷一) (15分)回答下列有关常数的问题
(1)Kw的数学表达式是Kw= ,温度升高Kw的变化情况是 (选填“变大”、“变小”或“不变”),若定义pOH=-lgc(OH-),则pH+pOH= (用含Kw的代数式表示)
(2)K通常表示化学平衡常数,K值越大表示该反应进行得越
,对于反应2NO2(g)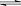 N2O4(g),其化学平衡常K的数学表达式为
。
N2O4(g),其化学平衡常K的数学表达式为
。
(3)Ka通常表示弱酸的电离平衡常数,Ka值越大表示该弱酸 ,α通常称为电离度,顾名思义是表示弱电解质的电离程度大小的一个指标,对于某一元弱酸,当用蒸馏水稀释该酸时,溶液越稀,Ka的变化情况是 (选填“变大”、“变小”或“不变”),α的变化情况是 (选填“变大”、“变小”或“不变”)。
(4)Ksp表示难溶物的溶度积常数,该常数越大表示 。
(5) 已知CO(g)+2H2(g) CH3OH(g)某温度时,向一定容积的密闭容器中充入CO和H2,浓度分别为1mol·L-1、2mol·L-1,达到平衡时CO的浓度为0.6mol·L-1。试求该温度下的化学平衡常数。
CH3OH(g)某温度时,向一定容积的密闭容器中充入CO和H2,浓度分别为1mol·L-1、2mol·L-1,达到平衡时CO的浓度为0.6mol·L-1。试求该温度下的化学平衡常数。
W w
13.(惠州市2009届高三第一次调研 )下列反应的离子方程式书写正确的是
A.碳酸钠水解:CO32-+H2O HCO-+OH-
HCO-+OH-
B.将SO2通人次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓
C.澄清石灰水与盐酸反应:H++OH-=H2O
D.过量的C12通入FeCl2溶液中:Fe2++C12=Fe3+十2Cl-
12.(惠州市2009届高三第一次调研 )一定温度下,难溶电解质AmBn在水中溶解平衡的溶度积为Ksp=cm(An+)×cn(Bm-)。
25℃,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,先出现黄
色沉淀,最终生成黑色沉淀。已知有关物质的颜色和溶度积如下:
|
物质 |
AgCl |
AgI |
Ag2S |
|
颜色 |
白 |
黄 |
黑 |
|
Ksp(25℃) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列叙述不正确的是
 A.溶度积小的沉淀可以转化为溶度积更小的沉淀
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
11.(惠州市2009届高三第二次调研考试 ) (7分)进行胃部透视时,常在检查之前服用“钡餐”,其主要成分是硫酸钡。已知25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10
⑴Ba2+是有毒的重金属离子,当人体中Ba2+浓度达到2×10-3mol·L-1时,就会对健
康产生危害,若有人误将氯化钡当做食盐食用,请通过计算说明是否可以服用5%的硫酸钠溶液有效除去胃中的Ba2+。(注:5%的硫酸钠溶液物质的量浓度约0.36mol·L-1)
⑵25℃时,已知胃液的PH在0.9-1.5之间,请问_______(填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”使用,简述你做出判断的理由_____________________。
答案(1)BaSO4(s)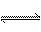 Ba2+(aq)+SO42-(aq)(1分)
Ba2+(aq)+SO42-(aq)(1分)
[Ba2+]=1.1×10-10/0.36=3.1×10-10<2×10-3mol·L-1(2分)
根据计算说明,可以有效除去Ba2+(1分)
(2)不能(1分),由于存在溶解平衡:BaCO3(s)  Ba2+(aq)+CO32-(aq)(1分),服下
Ba2+(aq)+CO32-(aq)(1分),服下
BaCO3后,胃酸可与CO32-反应生成CO2和水,CO32-浓度降低,BaCO3的沉淀溶解平衡向
右移动,Ba2+浓度增大引起人体中毒(1分)。(或直接说BaCO3会与胃酸反应产生Ba2+使人
中毒)。
10.(2009届汕头市龙湖区第二次高三化学联考)(11分)如图:横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题。
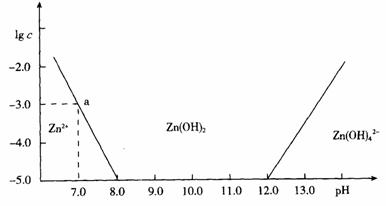
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:
__________________ 。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)== ____ 。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是 ___ 。
(4)往1.00L 1.00mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH ____ mol
 (5)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
(5)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
|
C(HCl)/(mol·L-1) |
0.50 |
1.00 |
2.04 |
2.90 |
4.02 |
5.16 |
5.78 |
|
C(PbCl2)/(mol·L-1)×10-3 |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是 (填字母序号)
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
答案(1)Zn2++ 4OH-==[Zn(OH)4]2-(2分);
(2)10-17(2分); (3)(8.0,12.0)(2分); (4)1.80(2分,写1.8得1分);
(5)A B C D (3分,写对1个得0分,写对2个得1分,写对3个得2分,漏1个扣1分,扣完为止)。
9.(2009届汕头市龙湖区第二次高三化学联考)已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数KSP(CaF2)=1.46×10-10
mol3·L-3。现向1L 0.2 mol·L-1HF溶液中加入1L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确
的是
A.25℃时,0.1 mol·L-1HF溶液中pH=1 B.KSP(CaF2)随温度和浓度的变化而变化
C.该体系中KSP(CaF2)=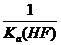 D.该体系中有CaF2沉淀产生
D.该体系中有CaF2沉淀产生
8.(广东09届达濠华侨中学高三第二次月考)右图是M、N两种物质的溶解度曲线,在t2℃时往盛有100g水的烧杯中先后加入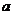 gM和
gM和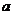 gN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t1℃,下列说法正确的是
gN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t1℃,下列说法正确的是
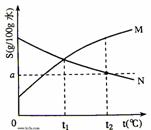 A.t1℃时,M、N的溶解度相等,得到M、N的饱和溶液
A.t1℃时,M、N的溶解度相等,得到M、N的饱和溶液
B.t2℃时,得到M的饱和溶液、N的不饱和溶液
C.t1℃时,M、N的溶质质量分数一定相等
D.t2℃时,M、N的物质的量浓度一定相等
7.(潮州市金山中学高三化学08年10月考试)某温度时,化合物甲的饱和溶液m g中含溶质a g,化合物乙的饱和溶液m g中含溶质b g.则在此温度时,甲、乙两化合物的溶解度之比是( B )
A.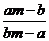 B.
B.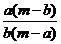 C.
C.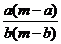 D.
D.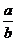
6.(潮州市金山中学高三化学08年10月考试)在25℃时,硫酸铜的溶解度为S g,把无水硫酸铜粉末S g加入到(100+S)g饱和硫酸铜溶液中,得到一定量的蓝色晶体.若将此蓝色晶体溶解成饱和溶液,应加水的质量是( B)
A.(100+S)g B.100
g C. D.
D.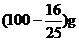
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com