
1. (09全国卷Ⅱ6) 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,
(09全国卷Ⅱ6) 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,
反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A. 1:4 B.1:5 C. 2:3 D.2:5
答案:A
解析:设2molZn参与反应,因Zn无剩余,则最终生成了2molZn(NO3)2,显然含有4molNO3- ,这部分是没有参与氧化还原反应的HNO3,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=1mol,即有1molHNO3被还原。
5、价态律:元素处于最高价态时,只有氧化性而无还原性。例如:MnO4-、Fe3+等。元素处于最低价态时,只有还原性而无氧化性。例如:S2-、I-等。元素处于中间价态时,即能表现氧化性又能表现还原性。例如:H2O2、Fe2+等。
典型例题:
4、只靠拢不交叉规律:同种元素不同价态的原子间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而绝不会出现高价态变低,低价态变高的交叉现象。
3、 临位转化规律:在一般情况下,大多数氧化还原反应转化,氧化剂和还原剂的价态变化是临位转化。例如:H2S与浓H2SO4的反应,H2S一般被氧化成S,浓硫酸一般被还原成SO2.
临位转化规律:在一般情况下,大多数氧化还原反应转化,氧化剂和还原剂的价态变化是临位转化。例如:H2S与浓H2SO4的反应,H2S一般被氧化成S,浓硫酸一般被还原成SO2.
2、先后律:当一种氧化剂(还原剂)同时遇到几种还原剂(氧化剂)时,还原剂(氧化剂)按还原性(氧化性)的强弱顺序依次被氧化(还原)。
1、电子守恒规律:在任何氧化还原反应中,氧化剂得到的电子总数与还原剂失去的电子总数相等。此规律应用于解氧化还原反应的计算题、氧化还原反应方程式的配平。
4、根据氧化产物的价态高低判断:当变价的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性的强弱。例如:2Fe+3Cl2=2FeCl3 Fe+S=FeS可以判断氧化性Cl2强于S.
巩固性练习、已知 2Fe3+ +2I- =2Fe2+ +I2 ,2Fe2+ +Cl2 =2Fe3+ +2Cl- 则有关离子的还原性强弱顺序为
A.Cl->Fe2+>I- B. Fe2+>I->Cl- C.I->Fe2+>Cl- D.Fe2+>Cl->I-
3、从反应条件来比较。一般来讲,一组反应中,反应条件越简单,对应反应物的氧化性或还原性越强.

从反应条件可以看出氧化剂的氧化能力:KMnO4>MnO2>O2
2、(1)随着金属活动顺序表中金属活动性的减弱,金属的还原性越来越弱,其对应离子的氧化性越来越强.(除Fe3+外)
|
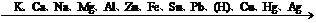
|
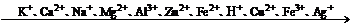
(2)对于非金属单质
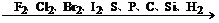 氧化性逐渐减弱
氧化性逐渐减弱
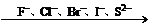 还原性逐渐增强
还原性逐渐增强
常见的氧化剂:KMnO4,浓H2SO4,浓、稀HNO3,Cl2
 常见的还原剂:H2、CO、C、大多数金属。
常见的还原剂:H2、CO、C、大多数金属。
1、氧化剂的氧化性>氧化产物的氧化性
还原剂的还原性>还原产物的还原性
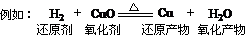
则:还原性:H2>Cu
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com