
4.(2009江西卷文)下列命题是真命题的为
(1).若 ,则
,则 (2).若
(2).若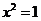 ,则
,则
(3).若 ,则
,则 (4).若
(4).若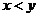 ,则
,则 
3.(2009安徽卷文)“ ”是“
”是“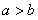 且
且 ”的
条件
”的
条件
2.(2009浙江文)“ ”是“
”是“ ”的
条件
”的
条件 
1.(2009浙江理)已知 是实数,则“
是实数,则“ 且
且 ”是“
”是“ 且
且 ”的
”的
条件
11.(15分)
(1)C2H6O2 (2分) 羟基(1分)
 (2)ac(2分)
(2)ac(2分)
(3)CH3CH(OH)COOH CH2=CHCOOH+H2O(2分) 消去(2分)
(4)CH2=CHCH2COOH(2分) CH3CH=CHCOOH(2分)
 (5)
(5)

4Fe(OH)2+O2+2H2O==4Fe(OH)3(2分)
(3)3Fe2++4H++NO3-==3Fe3++NO↑+2H2O
2Fe2++2H++H2O2==2Fe3++2H2O
2Fe2++4OH一+H2O2==2Fe(OH)3↓(以上任写两组)(4分)
(4)② 几枚铁钉(2分)
11.(15分)已知:
 (R、R′可表示烃基或官能团)
(R、R′可表示烃基或官能团)
A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):

请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量金属钠作用产生H2 22.4 L(标准状况),则F的分子式是 ,所含官能团的名称是 。
(2)G与F的相对分子质量之差为4,则G具有的性质是 (填字母)。
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1 mol G最多可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是
,该反应类型是 反应。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是
、 。
(5)A转化为B和F的化学方程式是 。
(1)某同学想不用其他试剂,仅通过用试管取少量上述溶液进行两两混合实验而给试剂瓶贴上正确的标签,他能成功吗? (填“能”或“不能”)。
(2)实验中发现,有一组在混合时,随着试剂滴加的顺序不同而出现明显不同的现象.该组是 ;有一组在混合时,随着试剂滴加后的时间不同而出现明显不同的现象,该组是 ,其中涉及氧化还原反应的化学方程式为 .
(3)鉴别后,该同学又用FeSO4做了三个体现Fe2+还原性的实验,每次加入上述两种已鉴别的物质的溶液与其混合。试写出其中两个反应的离子方程式 、
(4)实际上实验室配制的FeSO4溶液不可长期保存,短期保存时可在FeSO4溶液配制时加入少量的上述 (填编号)防止水解,若能再加上 (填物质名称)效果会更好。
10.(16分)(一)(1)28.0 C (各1分)
(2)蒸发皿 5.8或5.9 100 mL容量瓶 (各1分)
[例1] 下列反应属于放热反应的是 ( )
A.氢气还原氧化铜 B.氢气在氧气中燃烧
C.氢氧化钾和硫酸中和 D.碳酸钙高温分解成氧化钙和二氧化碳
[例2] 下列反应过程中,ΔH>0且ΔS>0的是 ( )
A.NH3(g)+HCl(g) NH4Cl(s) B.CaCO3(s)
NH4Cl(s) B.CaCO3(s) CaO(s)+CO2(g)
CaO(s)+CO2(g)
C.4Al(s)+3O2(g) 2Al2O3(s)
D.HCl(aq)+NaOH(aq)
2Al2O3(s)
D.HCl(aq)+NaOH(aq) NaCl(aq)+H2O(l)
NaCl(aq)+H2O(l)
[例3] 甲醇广泛用作燃料电池的燃料,可出天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71 kJ·mol-1
②CO(g)+2H2(g)=CH3OH(l) △H=-90.5 kJ·mol-1
③CH4(g)+2O2(g)=CO2+2H2O(g) △H=-890 kJ·mol-1
下列说法不能得出的结论是 ( )
A、反应②在任何温度下均能自发进行
B.CO(g)+2H2(g)=CH3OH(g)△H>-90.5 kJ·mol-1
C.甲醇的燃烧热为764 kJ·mol-1
D、若CO的燃烧热为282.5 kJ·mol-1,则H2的燃烧热为286 kJ·mol-1
[例4] 已知:(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g) △H=74.9 kJ·mol-1,下列说法中正确的是 ( )
A.该反应是吸热反应,因此一定不能自发进行
B.该反应中熵变、焓变皆大于0
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
[例5]下列各组热化学方程式中,化学反应的△H前者大于后者的是 ( )
①C(s)+O2(g)= CO2(g);△H1 C(s)+O2(g)= CO(g);△H2
②S(s)+O2(g)= SO2(g);△H3 S(g)+O2(g)= SO2(g);△H4
③H2(g)+O2(g)= H2O(l);△H5 2H2(g)+O2(g)= 2H2O(l);△H6
④CaCO3(s)= CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)= Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
[例6] 化学家已发现在高压下氮气会聚合成高聚氮晶体, 该晶体中相邻氮原子间以氮氮单键连接形成空间网状结构,每个氮原子最外层均满足8电子稳定结构。这种高聚氮的N-N键键能为160 kJ/mol (N2的键能为942 kJ/mol)。下列有关高聚氮说法不正确的是 ( )
A.该晶体中每个氮原子与其它3个氮原子相连
B.该晶体属于分子晶体,它与N2属于同素异形体
C.理论上该高聚氮可作为高能炸药,爆炸后生成氮气,热化学方程式可表示为
2N(s) = N2 (g) △H = - 462 k J/mol
D.高聚氮爆炸生成氮气的反应在任何温度下可自发进行
[例7] 1 molH-I 键的键能是299kJ。 1mol I-I 键的键能是151kJ,1mol H-H键的键能是436kJ, 则H2(g)+I2(g)=2HI(g)反应是 ( )
A.吸热反应 B.放热反应 C.分解反应 D.可逆反应
[例8] 化学键的键能是原子间形成1mol化学键(或其逆过程)时释放(或吸收)的能量。以下部分共价键键能数据:H-S 364 kJ·mol-1,S-S 266 kJ·mol-1,S=O 522 kJ·mol-1,H-O 464 kJ·mol-1。
(1)试根据这些数据计算下面这个反应的反应热:2H2S(g)+SO2(g)=3S(g)+2H2O;△H= -Q kJ/mol,反应产物中的S实为S8,实际分子是一个8元环状分子。求Q。
(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热多少kJ·mol-1;当a<2b时,反应放热多少kJ·mol-1
6.(1)154 (2)88b 3.44a
[例9] 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)反应的热化学方程式为_______ ______________。
(2)又已知H2O(l)=H2O(g),ΔH=+44 kJ·mol-1,由16 g液态肼与液态双氧水反应生成液态水时放出的热量是__________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是___________________________________ _____。
(1)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g);ΔH=-641.63 kJ·mol-1 (2)408.815 (3)产物不会造成环境污染
[例10] 北京时间2008年2月21日上午11时26分,美国用导弹击毁了失控的卫星。美方称,卫星坠落地面时,燃料罐中装有的约453 kg联氨(N2H4),可能发生泄漏,造成伤害。
(1)联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
(2)联氨(N2H4)是航天飞船常用的高能燃料。联氨可用氨和次氯酸钠按一定物质的量之比混合反应生成联氨、氯化钠和水;该反应的氧化产物是 。也可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,写出其反应的化学方程式 。
(3)火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量;
H2O(l)=H2O (g) DH=+44 kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) DH=–196.4 kJ·mol-1
则写出表示联氨燃烧热的热化学方程式为 。
(五)、反应热与化学键能的计算
反应热△H=反应物的键能总和-生成物的键能总和
(四)、盖斯定律及其应用
盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成的反应热是相同的,这就是盖斯定律。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com